4.4: Caractéristiques des Liaisons Covalentes
Électronégativité et Polarité des liaisons
Bien que nous ayons défini la liaison covalente comme un partage d’électrons, les électrons d’une liaison covalente ne sont pas toujours partagés également par les deux atomes liés. À moins que la liaison ne relie deux atomes du même élément, comme dans H2, il y aura toujours un atome qui attire les électrons dans la liaison plus fortement que l’autre atome, comme dans HCl, montré dans la figure \(\PageIndex{1}\). Une liaison covalente qui a un partage égal d’électrons (Figure \(\PageIndex{1a}\)) est appelée une liaison covalente non polaire. Une liaison covalente qui a un partage inégal d’électrons, comme dans la figure \(\PageIndex{1b}\), est appelée liaison covalente polaire.

Figure\(\PageIndex{1}\) Liaisons covalentes polaires versus Non polaires. (a) Les électrons de la liaison covalente sont également partagés par les deux atomes d’hydrogène. Il s’agit d’une liaison covalente non polaire. (b) L’atome de chlore attire les électrons dans la liaison plus que l’atome d’hydrogène, ce qui entraîne un déséquilibre dans la distribution des électrons. C’est une liaison covalente polaire.
La distribution de la densité électronique dans une liaison polaire est inégale. Il est plus grand autour de l’atome qui attire les électrons plus que l’autre. Par exemple, les électrons dans la liaison H-Cl d’une molécule de chlorure d’hydrogène passent plus de temps près de l’atome de chlore que près de l’atome d’hydrogène. Notez que la zone ombrée autour de Cl sur la figure \(\PageIndex{1b}\) est beaucoup plus grande qu’elle ne l’est autour de H.
Ce déséquilibre de densité électronique se traduit par une accumulation de charge négative partielle (désignée δ−) d’un côté de la liaison (Cl) et d’une charge positive partielle (désignée δ+) de l’autre côté de la liaison (H). Ceci est vu dans la figure \(\PageIndex{2a}\). La séparation de la charge dans une liaison covalente polaire se traduit par un dipôle électrique (deux pôles), représenté par la flèche de la figure \(\PageIndex{2b}\). La direction de la flèche est pointée vers l’extrémité δ tandis que la queue + de la flèche indique l’extrémité δ+ de la liaison.
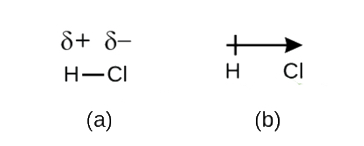
Figure \(\PageIndex{2}\): (a) Un partage inégal de la paire d’électrons de liaison entre H et Cl entraîne une charge positive partielle sur l’atome H et une charge négative partielle sur le Cl. Les symboles δ+ et δ- indiquent la polarité de la liaison H–Cl. (b) Le dipôle est représenté par une flèche avec une croix à la queue. La croix est proche de l’extrémité δ+ et la pointe de flèche coïncide avec le δ-.
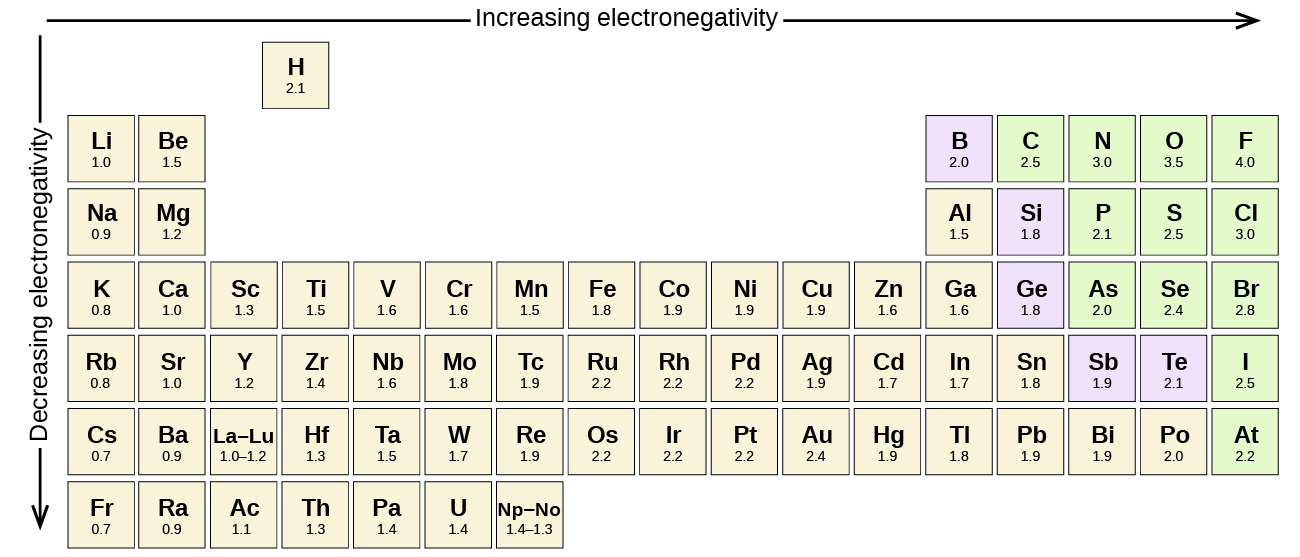
Toute liaison covalente entre des atomes de différents éléments est une liaison polaire, mais le degré de polarité varie considérablement. Certaines liaisons entre différents éléments ne sont que peu polaires, tandis que d’autres sont fortement polaires. Les liaisons ioniques peuvent être considérées comme la polarité ultime, les électrons étant transférés plutôt que partagés. Pour juger de la polarité relative d’une liaison covalente, les chimistes utilisent l’électronégativité, qui est une mesure relative de la force avec laquelle un atome attire les électrons lorsqu’il forme une liaison covalente. Il existe différentes échelles numériques pour évaluer l’électronégativité. Figure \(\PageIndex{3}\) montre l’une des plus populaires — l’échelle de Pauling.
En regardant de plus près: Linus Pauling
Sans doute le chimiste le plus influent du XXe siècle, Linus Pauling (1901-94) est la seule personne à avoir remporté deux prix Nobel individuels (c’est-à-dire non partagés). Dans les années 1930, Pauling a utilisé de nouvelles théories mathématiques pour énoncer certains principes fondamentaux de la liaison chimique. Son livre de 1939 The Nature of the Chemical Bond est l’un des livres les plus importants jamais publiés en chimie.
En 1935, Pauling s’intéresse aux molécules biologiques et il reçoit le prix Nobel de chimie en 1954 pour ses travaux sur la structure des protéines. (Il était très proche de découvrir la structure en double hélice de l’ADN lorsque James Watson et James Crick ont annoncé leur propre découverte de sa structure en 1953.) Il a ensuite reçu le prix Nobel de la paix en 1962 pour ses efforts visant à interdire les essais d’armes nucléaires.

Linus Pauling était l’un des chimistes les plus influents du XXe siècle.
Dans ses dernières années, Pauling est devenu convaincu que de fortes doses de vitamine C préviendraient les maladies, y compris le rhume. La plupart des recherches cliniques n’ont pas montré de lien, mais Pauling a continué à prendre de fortes doses quotidiennement. Il est décédé en 1994, après avoir passé toute sa vie à établir un héritage scientifique que peu d’hommes auront jamais égalé.
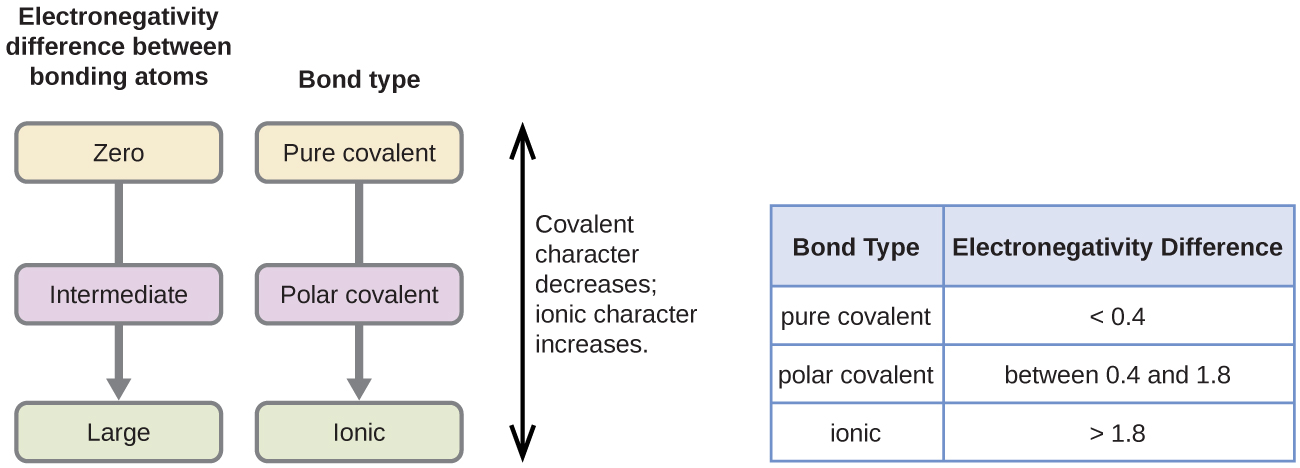
La polarité d’une liaison covalente peut être jugée en déterminant la différence des électronégativités des deux atomes faisant la liaison. Plus la différence d’électronégativités est grande, plus le déséquilibre du partage d’électrons dans la liaison est important. Bien qu’il n’y ait pas de règles strictes, la règle générale est si la différence d’électronégativités est inférieure à environ 0.4, la liaison est considérée comme non polaire; si la différence est supérieure à 0,4, la liaison est considérée comme polaire. Si la différence d’électronégativités est suffisamment importante (généralement supérieure à environ 1,8), le composé résultant est considéré comme ionique plutôt que covalent. Une différence d’électronégativité nulle, bien sûr, indique une liaison covalente non polaire.
Exemple \(\PageIndex{1}\)
Décrivez la différence d’électronégativité entre chaque paire d’atomes et la polarité résultante (ou le type de liaison).
- C et H
- H et H
- Na et Cl
- O et H
Solution
- Le carbone a une électronégativité de 2,5, tandis que la valeur pour l’hydrogène est de 2,1. La différence est de 0,4, ce qui est plutôt faible. La liaison C-H est donc considérée comme non polaire.
- Les deux atomes d’hydrogène ont la même valeur d’électronégativité – 2,1. La différence est nulle, donc la liaison est non polaire.
- L’électronégativité du sodium est de 0,9, tandis que celle du chlore est de 3,0. La différence est de 2,1, ce qui est assez élevé, et le sodium et le chlore forment donc un composé ionique.
- Avec 2,1 pour l’hydrogène et 3,5 pour l’oxygène, la différence d’électronégativité est de 1,4. On s’attendrait à un lien très polaire. Le partage des électrons entre O et H est inégal avec les électrons plus fortement attirés vers O.
Exercice \(\PageIndex{1}\)
Décrivez la différence d’électronégativité (EN) entre chaque paire d’atomes et la polarité (ou type de liaison) résultante.
- C et O
- K et Br
- N et N
- Cs et F
Réponse a:
La différence EN est de 1,0, donc polaire. Le partage des électrons entre C et O est inégal avec les électrons plus fortement attirés vers O.
Réponse b :
La différence EN est supérieure à 1,8, donc ionique.
Réponse c:
Les atomes identiques ont une différence EN nulle, donc non polaire.
Réponse d:
La différence EN est supérieure à 1,8, donc ionique.
Leave a Reply