4.4: Kjennetegn Ved Kovalente Bindinger
Elektronegativitet og Bindingspolaritet
Selv om vi definerte kovalent binding som elektrondeling, deles elektronene i en kovalent binding ikke alltid likt av de to bundne atomer. Med mindre bindingen forbinder to atomer av samme element, som I H2, vil det alltid være ett atom som tiltrekker elektronene i bindingen sterkere enn det andre atomet gjør, som I HCl, vist I Figur \(\PageIndex{1}\). En kovalent binding som har en lik deling av elektroner (Figur \(\PageIndex{1a}\)) kalles en ikke-polar kovalent binding. En kovalent binding som har en ulik deling av elektroner, som I Figur \(\PageIndex{1b}\), kalles en polar kovalent binding.

Figur \(\PageIndex{1}\) Polare versus Ikke-Polare Kovalente Bindinger. (a) elektronene i den kovalente bindingen deles likt av begge hydrogenatomer. Dette er en ikke-polar kovalent binding. (b) kloratomet tiltrekker elektronene i bindingen mer enn hydrogenatomet gjør, noe som fører til ubalanse i elektronfordelingen. Dette er en polar kovalent binding.
fordelingen av elektrontetthet i en polarbinding er ujevn. Det er større rundt atomet som tiltrekker elektronene mer enn det andre. For eksempel bruker elektronene I H–Cl-bindingen av et hydrogenkloridmolekyl mer tid nær kloratomet enn nær hydrogenatomet. Merk at det skyggelagte området rundt Cl I Figur \(\PageIndex{1b}\) er mye større enn det er rundt H.
denne ubalansen i elektrontetthet resulterer i en oppbygging av delvis negativ ladning (betegnet som δ−) på den ene siden av bindingen (Cl) og en delvis positiv ladning (betegnet δ+) på den andre siden av bindingen (H). Dette er sett I Figur \(\PageIndex{2a}\). Separasjonen av ladning i en polar kovalent binding resulterer i en elektrisk dipol (to poler), representert ved pilen I Figur \(\PageIndex{2b}\). Pilens retning peker mot den δ-enden mens pilens + hale indikerer den δ+ enden av obligasjonen.
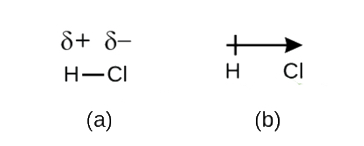
Figur \(\PageIndex{2}\): (a) Ulik deling Av bindingsparet elektroner mellom H og Cl fører til delvis positiv ladning På h-atomet og delvis negativ ladning På Cl. Symboler δ+ og δ-indikerer polariteten Til H-Cl-obligasjonen. (b) dipolen er representert av en pil med et kryss i halen. Krysset er nær δ+ slutt, og pilspissen faller sammen med δ.
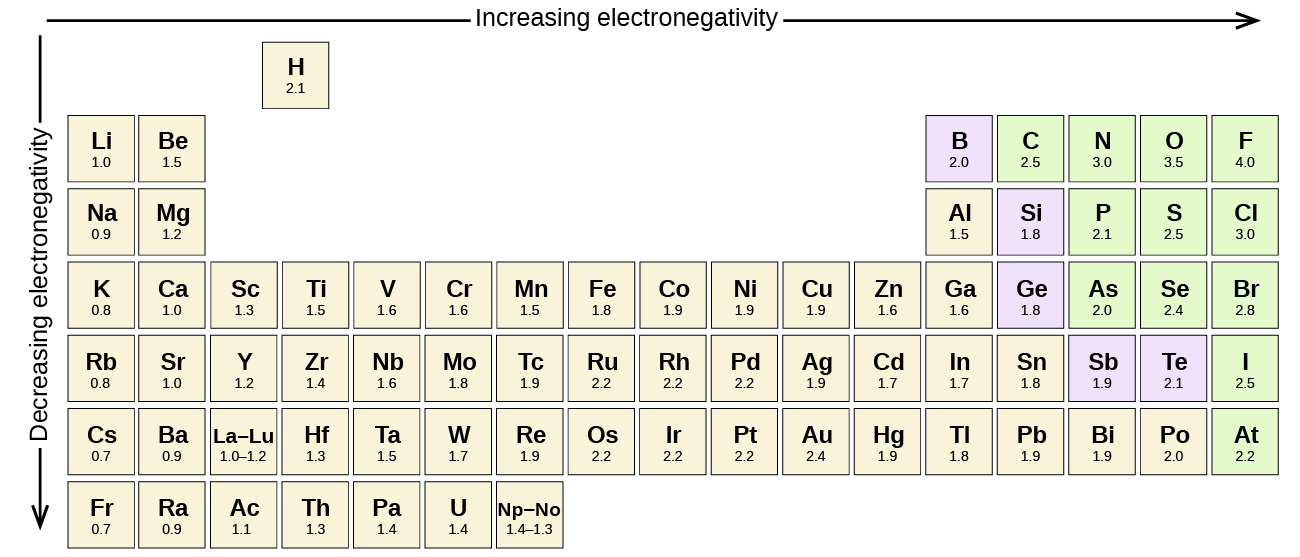
Enhver kovalent binding mellom atomer av forskjellige elementer er en polarbinding, men graden av polaritet varierer mye. Noen bindinger mellom ulike elementer er bare minimalt polare, mens andre er sterkt polare. Ioniske bindinger kan betraktes som den ultimate i polaritet, med elektroner blir overført i stedet for delt. For å bedømme den relative polariteten til en kovalent binding, bruker kjemikere elektronegativitet, som er et relativt mål på hvor sterkt et atom tiltrekker elektroner når det danner en kovalent binding. Det finnes ulike numeriske skalaer for vurdering elektronegativitet. Figur \(\PageIndex{3}\) viser en Av De mest populære—Pauling skalaen.
Ser Nærmere: Linus Pauling Er Uten Tvil Den mest innflytelsesrike kjemikeren i det 20. århundre, Linus Pauling (1901-94) Er den eneste personen som har vunnet to individuelle (det vil si udelte) Nobelpriser. På 1930-tallet brukte Pauling nye matematiske teorier for å uttale noen grunnleggende prinsipper for kjemisk binding. Hans bok The Nature Of The Chemical Bond Fra 1939 er en av de mest betydningsfulle bøkene som noensinne er utgitt i kjemi.I 1935 vendte Paulings interesse seg til biologiske molekyler, og Han ble tildelt Nobelprisen i Kjemi i 1954 for sitt arbeid med proteinstruktur. (Han var svært nær å oppdage dna-dobbeltspiralstrukturen da James Watson og James Crick annonserte sin egen oppdagelse av sin struktur i 1953.) Han ble senere tildelt Nobels Fredspris i 1962 for sin innsats for å forby testing av atomvåpen.

Linus Pauling var en av De mest innflytelsesrike kjemikerne i det 20. århundre.I Sine senere år ble Pauling overbevist om at store doser c-vitamin ville forhindre sykdom, inkludert forkjølelse. De fleste kliniske studier viste ingen sammenheng, Men Pauling fortsatte å ta store doser daglig. Han døde i 1994, etter å ha tilbrakt et helt liv å etablere en vitenskapelig arv som få noensinne vil like.
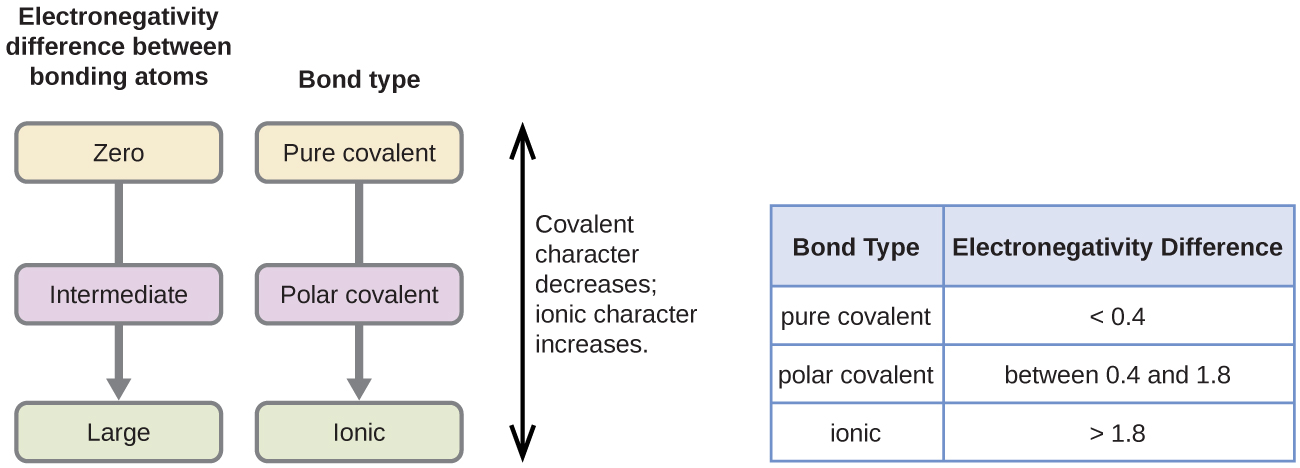
polariteten til en kovalent binding kan dømmes ved å bestemme forskjellen i elektronegativitetene til de to atomene som gjør bindingen. Jo større forskjellen i elektronegativiteter, desto større er ubalansen i elektrondeling i bindingen. Selv om det ikke er noen harde og raske regler, er den generelle regelen om forskjellen i elektronegativiteter er mindre enn 0.4, bindingen anses som ikke-polar; hvis forskjellen er større enn 0,4, betraktes bindingen som polar. Hvis forskjellen i elektronegativiteter er stor nok (generelt større enn omtrent 1,8), betraktes den resulterende forbindelsen som ionisk snarere enn kovalent. En elektronegativitetsforskjell på null indikerer selvsagt en ikke-polar kovalent binding.
Eksempel \(\PageIndex{1}\)
Beskriv elektronegativitetsforskjellen mellom hvert par atomer og den resulterende polariteten (eller bindingstypen).
- C og H
- H Og H
- Na Og Cl
- O og H
Løsning
- Karbon har en elektronegativitet på 2,5, mens verdien for hydrogen er 2,1. Forskjellen er 0,4, som er ganske liten. C – h-bindingen anses derfor som ikke-polar.
- begge hydrogenatomer har samme elektronegativitetsverdi-2.1. Forskjellen er null, så bindingen er ikke-polar.
- natriums elektronegativitet er 0,9, mens klor er 3,0. Forskjellen er 2,1, som er ganske høy, og derfor danner natrium og klor en ionisk forbindelse.med 2,1 for hydrogen og 3,5 for oksygen er elektronegativitetsforskjellen 1,4. Vi forventer et veldig polært bånd. Fordelingen av elektroner Mellom O Og H er ulik med elektronene sterkere trukket mot O.
Øvelse \(\PageIndex{1}\)
Beskriv elektronegativiteten (EN) forskjellen mellom hvert par atomer og den resulterende polariteten (eller bindingstypen).
- C og O
- K Og Br
- N Og N
- Cs og F
Svar a:
EN-forskjellen er 1,0 , derav polar. Fordelingen av elektroner Mellom C og O er ulik med elektronene sterkere trukket mot O.
Svar b:
EN-forskjellen er større enn 1,8, dermed ionisk.
Svar c:
Identiske atomer har null EN forskjell, derfor ikke-polare.
Svar d:
EN-forskjellen er større enn 1,8, derav ionisk.
Leave a Reply