Lihassupistus

selkärankaisilla eläimillä on kolmenlaisia lihaskudoksia: luusto, sileä ja sydän. Luustolihas muodostaa suurimman osan kehon lihasmassasta ja vastaa liikuntaelimistön toiminnasta. Sileälihas muodostaa verisuonia, ruoansulatuskanavaa ja muita kehon alueita, jotka tuottavat pysyviä supistuksia. Sydänlihas muodostaa sydämen, joka pumppaa verta. Luuston ja sydämen lihaksia kutsutaan poikkijuovaisiksi lihaksiksi, koska ne näyttävät mikroskoopilla raidallisilta, mikä johtuu A-ja I-nauhojen hyvin organisoidusta vuorottelukuviosta.
Luustolihasedit

refleksejä lukuun ottamatta kaikki luurankolihasten supistukset tapahtuvat aivoista lähtöisin olevan tietoisen ponnistuksen seurauksena. Aivot lähettävät hermoston kautta sähkökemiallisia signaaleja motoneuronille, joka sisältää useita lihassyitä. Joidenkin refleksien tapauksessa supistumissignaali voi saada alkunsa selkäytimestä takaisinkytkentäsilmukan kautta harmaan aineen kanssa. Muillakin toiminnoilla, kuten liikkumisella, hengittämisellä ja pureskelulla, on refleksinomainen aspekti: supistukset voidaan aloittaa sekä tietoisesti että tiedostamatta.
neuromuskulaarinen liitos

neuromuskulaarinen liitos on kemiallinen synapsi, joka muodostuu motoneuronin ja lihassyyn välisestä kosketuksesta. Se on paikka, jossa motoneuroni lähettää signaalin lihassuidulle, joka aloittaa lihassupistuksen. Tapahtumasarja, joka johtaa lihassyyn depolarisaatioon neuromuskulaarisessa liitoksessa, alkaa, kun motoneuronin solurungossa käynnistyy aktiopotentiaali, joka sitten etenee suolajohtumalla aksonia pitkin kohti neuromuskulaarista liitosta. Kun se saavuttaa terminaalin Boutonin, aktiopotentiaali aiheuttaa Ca2 +
– ionitulvan päätepisteeseen jännitesidottujen kalsiumkanavien kautta. Ca2 +
– virta aiheuttaa asetyylikoliinia välittäjäaineena sisältävien synaptisten rakkuloiden sulautumisen plasmakalvoon, jolloin asetyylikoliinia vapautuu motoneuroniterminaalin ja luurankolihassyyn kuuluvan hermolihasliitoksen väliseen synaptiseen halkeamaan. Asetyylikoliini diffundoituu synapsissa ja sitoutuu ja aktivoi nikotiinisia asetyylikoliinireseptoreita hermo-lihasliitoksessa. Nikotiinireseptorin aktivaatio avaa sen sisäisen natrium / kalium-kanavan, jolloin natrium syöksyy sisään ja kalium valuu ulos. Tämän seurauksena sarkolemma kääntää napaisuuden ja sen jännite hyppää nopeasti-90mV: n lepokalvopotentiaalista jopa +75mV: hen natriumin saapuessa. Kalvopotentiaali sitten hyperpolarisoituu, kun kalium poistuu ja se säädetään takaisin lepokalvopotentiaaliin. Tätä nopeaa vaihtelua kutsutaan päätylevypotentiaaliksi, jossa päätylevyn vieressä olevan sarkolemman jännitteiset ionikanavat avautuvat vastauksena päätylevypotentiaaliin. Ne ovat natrium – ja kaliumpitoisia ja sallivat vain yhden läpimenon. Tämä ioniliikkeiden Aalto luo toimintapotentiaalin, joka leviää Moottorin päätylevystä kaikkiin suuntiin. Jos toiminta potentiaalit lakkaavat saapumasta, asetyylikoliini lakkaa vapautumasta terminaalista boutonista. Jäljellä oleva asetyylikoliini synaptisessa halkeamassa joko hajoaa aktiivisen asetyylikoliiniesteraasin vaikutuksesta tai imeytyy uudelleen synaptisessa nuppiin, eikä mitään jää korvaamaan hajonnutta asetyylikoliinia.
eksitaatio-supistuskytkentä
eksitaatio–supistuskytkentä on prosessi, jossa lihassyyn sisältyvä lihasten toimintapotentiaali saa myofibrillit supistumaan. Luustolihaksissa eksitaatio-supistumiskytkentä perustuu keskeisten proteiinien, sarkoplasmisen retikulumin (SR) kalsiumin vapautuskanavan (tunnistettu ryanodiinireseptoriksi, RyR) ja jännitteellä varustettujen L-tyypin kalsiumkanavien (tunnistettu dihydropyridiinireseptoreiksi, DHPRs) väliseen suoraan kytkentään. DHPRs sijaitsevat sarkolemmassa (johon kuuluvat pinnan sarkolemma ja poikittaiset tubulukset), kun taas RyRs asuvat SR-kalvon poikki. Poikittaisen tubuluksen ja kahden RyRs: ää sisältävän SR–alueen läheistä appositiota kuvaillaan kolmioksi, ja se on pääasiassa siellä, missä magnetaatio-supistumiskytkentä tapahtuu. Magnetaatio-supistumiskytkentä tapahtuu, kun luurankolihassolun depolarisaatio johtaa lihasten toimintapotentiaaliin, joka leviää solun pinnalle ja lihassyyn t-tubulusten verkostoon, jolloin lihassyyn sisäosa depolarisoituu. Sisäosien depolarisaatio aktivoi terminaalisen sisäsäiliön dihydropyridiinireseptoreita, jotka ovat lähellä viereisen sarkoplasmisen retikulumin ryanodiinireseptoreita. Aktivoidut dihydropyridiinireseptorit ovat fyysisesti vuorovaikutuksessa ryanodiinireseptoreiden kanssa aktivoidakseen niitä jalkaprosessien kautta (joihin liittyy konformaatiomuutoksia, jotka allosteerisesti aktivoivat ryanodiinireseptoreita). Ryanodiinireseptorien avautuessa Ca2 +
vapautuu sarkoplasmaisesta retikulumista paikalliseen liitosavaruuteen ja diffundoituu irtosytoplasmaan aiheuttaen kalsiumkipinän. Huomaa, että sarkoplasmisella retikulaatilla on suuri kalsiumin puskurointikyky, joka johtuu osittain kalsequestriini-nimisestä kalsiumia sitovasta proteiinista. Tuhansien kalsiumkipinöiden lähes synkroninen aktivoituminen aktiopotentiaalin avulla aiheuttaa solulaajuisen kalsiumpitoisuuden suurenemisen, joka johtaa kalsiumin transientin kohoamiseen. Sytosoliin vapautuva Ca2 +
sitoutuu Aktiinifilamenttien avulla troponiini C: hen mahdollistaen ristisiteen pyörimisen tuottaen voimaa ja joissakin tilanteissa liikettä. Sarko / endoplasminen retikulumikalsium – ATPaasi (SERCA) pumppaa Ca2+
aktiivisesti takaisin sarkoplasmiseen retikulumiin. Kun Ca2 +
laskee Takaisin lepotasolle, voima heikkenee ja relaksaatio tapahtuu.
Sliding filament theoryEdit

liukufilamenttiteoria kuvaa prosessia, jossa lihakset supistuvat. Se on toistuvien tapahtumien kierre, joka saa ohuen hehkulangan liukumaan paksun hehkulangan yli ja synnyttää jännitettä lihakseen. Sen kehittivät itsenäisesti Andrew Huxley ja Rolf Niedergerke sekä Hugh Huxley ja Jean Hanson vuonna 1954. Fysiologisesti tämä supistuma ei ole yhtenäinen koko sarkomeerin alueella; paksujen rihmastojen keskusasento muuttuu epävakaaksi ja voi siirtyä supistumisen aikana. Kimmoproteiinien, kuten titiinin, toiminnan oletetaan kuitenkin säilyttävän tasaisen jännityksen sarkomeerin yli ja vetävän paksun hehkulangan keskusasentoon.
Crossbridge cyclingEdit

Crossbridge cycling on molekyylitapahtumien sarja, joka on liukuhehkuteorian taustalla. Ristiside on kahdesta myosiinipäästä koostuva myosiiniprojektio, joka ulottuu paksuista rihmastoista. Jokaisessa myosiinipäässä on kaksi sitoutumispaikkaa: yksi ATP: lle ja toinen aktiinille. ATP: n sitoutuminen myosiinin päähän irrottaa myosiinin aktiinista, jolloin myosiini sitoutuu toiseen aktiinimolekyyliin. Kiinnittymisen jälkeen myosiini hydrolysoi ATP: n, joka käyttää vapautuneen energian siirtyäkseen ”koteloituneeseen asentoon”, jossa se sitoutuu heikosti osaan aktiinin sitoutumiskohdasta. Tropomyosiini estää aktiinin sitoutumiskohdan loppuosan. ATP: n hydrolysoituessa koteloituneessa myosiinipäässä on nyt ADP + Pi. Kaksi Ca2+
– Ionia sitoutuu troponiini C: hen aktiinifilamenteissa. Troponiini-Ca2 +
– kompleksi aiheuttaa sen, että tropomyosiini liukuu yli ja avaa aktiinin sitoutumiskohdan jäljelle jäävän osan. Muiden aktiinisitoutumiskohtien avautuminen mahdollistaa kahden myosiinipään sulkeutumisen ja myosiinin sitoutumisen voimakkaasti aktiiniin. Tämän jälkeen myosiinipää vapauttaa epäorgaanisen fosfaatin ja käynnistää voimanoton, joka synnyttää 2 pN: n voiman. Voimanisku siirtää aktiinifilamenttia sisäänpäin, jolloin sarkomeeri lyhenee. Myosiini vapauttaa ADP: tä, mutta pysyy silti tiukasti sitoutuneena aktiiniin. Tehoiskun lopussa myosiinin päästä vapautuu ADP: tä, jolloin aktiiniin kiinnittynyt myosiini jää jäykäksi, kunnes toinen ATP sitoutuu myosiiniin. ATP: n puuttuminen johtaisi kuolonkankeudelle tyypilliseen jäykkyystilaan. Kun toinen ATP sitoutuu myosiiniin, myosiinin pää irtoaa jälleen aktiinista ja tapahtuu toinen ristisyykierto.
Crossbridge-pyöräilyä voidaan jatkaa niin kauan kuin solulimassa on riittävästi ATP: tä ja Ca2+
: ää. Crossbridge-pyöräilyn päättyminen voi tapahtua, kun Ca2+
pumpataan aktiivisesti takaisin sarkoplasmaiseen retikulumiin. Kun ohuessa hehkulangassa ei ole enää Ca2+
, tropomyosiini muuttaa konformaatiota takaisin entiseen tilaansa niin, että sitoutumiskohdat tukkeutuvat uudelleen. Myosiini lakkaa sitoutumasta ohueen hehkulankaan, ja lihas rentoutuu. Ca2 +
– ionit poistuvat troponiinimolekyylistä, jotta Ca2+
– ionipitoisuus säilyy sarkoplasmassa. Ca2 +
– ionien aktiivinen pumppaus sarkoplasmaiseen verkkokalvoon aiheuttaa puutoksen myofibriilejä ympäröivässä nesteessä. Tämä aiheuttaa Ca2+
– ionien poistumisen troponiinista. Näin tropomyosiini-troponiinikompleksi kattaa jälleen aktiinifilamenttien sitoutumiskohdat ja supistuminen lakkaa.
luustolihasten supistumisen aste
luurankolihassupistusten vahvuus voidaan jakaa karkeasti nykäykseen, summaukseen ja tetanukseen. Nykiminen on yksittäinen supistumis-ja relaksaatiosykli, jonka tuottaa itse lihassyyn sisältyvä toimintapotentiaali. Liikehermoon kohdistuvan ärsykkeen ja innervatoidun lihaksen myöhemmän supistumisen välistä aikaa kutsutaan latentiksi ajanjaksoksi, joka kestää yleensä noin 10 ms ja joka johtuu hermotoimintapotentiaalin leviämiseen kuluvasta ajasta, kemiallisen lähetyksen ajasta hermolihasliitoksessa ja sen jälkeen heräte-supistumiskytkennän myöhemmistä vaiheista.
Jos ennen lihasten nykimisen täydellistä rentoutumista tulisi tuottaa toinen lihastoimintapotentiaali, seuraava nykäisy yksinkertaisesti summautuu edelliseen nykäisyyn, jolloin syntyy summaus. Yhteenlasku voidaan saavuttaa kahdella tavalla: taajuussumman ja monikuitusumman avulla. Frekvenssisummassa luurankolihaksen kohdistamaa voimaa ohjataan vaihtelemalla sitä taajuutta, jolla toimintapotentiaalit lähetetään lihassäikeisiin. Toimintapotentiaalit eivät saavu lihaksiin synkronisesti, ja supistuksen aikana jokin osa lihassäikeistä laukeaa milloin tahansa. Tyypillisessä tilanteessa, kun ihmiset rasittavat lihaksiaan niin kovaa kuin he tietoisesti pystyvät, noin kolmasosa kunkin lihaksen säikeistä syttyy kerralla, vaikka tähän suhteeseen voivat vaikuttaa erilaiset fysiologiset ja psykologiset tekijät (mukaan lukien Golgin jänneelimet ja Renshawin solut). Tämä’ Matala ’ supistumistaso on suojamekanismi, joka estää jänteen purkautumisen—kaikkien kuitujen 95-prosenttisesta supistumisesta syntyvä voima riittää vahingoittamaan kehoa. Monikuituisessa summauksessa, jos keskushermosto lähettää heikon signaalin lihaksen supistamiseksi, pienemmät motoriset yksiköt, jotka ovat jännittyneempiä kuin suuremmat, stimuloituvat ensin. Signaalin voimakkuuden kasvaessa yhä useampi moottoriyksikkö kiihtyy isompien lisäksi, ja suurimmilla moottoriyksiköillä on jopa 50-kertainen supistumiskyky pienempiin verrattuna. Kun yhä useampi ja suurempi motorinen yksikkö aktivoituu, lihasten supistumisen voima voimistuu asteittain. Kokoperiaatteena tunnettu käsite mahdollistaa lihasvoiman porrastuksen heikon supistumisen aikana pienissä portaissa, jotka sitten kasvavat asteittain, kun tarvitaan suurempia voimamääriä.
lopuksi, jos lihasten toimintapotentiaalien taajuus kasvaa niin, että lihasten supistuminen saavuttaa huippuvoimansa ja tasankonsa tällä tasolla, supistuminen on jäykkäkouristus.
Pituus-jännityssuhde

Pituus-jännityssuhde suhteuttaa isometrisen supistumisen voimakkuuden sen lihaksen pituuteen, jossa supistuminen tapahtuu. Lihakset toimivat suurimman aktiivisen jännitteen ollessa lähellä ihannepituutta (usein niiden lepopituus). Kun venytetään tai lyhennetään tämän yli (johtuipa se sitten itse lihaksen toiminnasta tai ulkopuolisesta voimasta), suurin aikaansaatu aktiivinen jännitys vähenee. Tämä lasku on minimaalinen pieniä poikkeamia, mutta jännitys putoaa pois nopeasti, kun Pituus poikkeaa edelleen ihanteellinen. Koska lihassolussa on elastisia proteiineja (kuten titiini) ja solunulkoinen matriisi, kun lihas venyy yli tietyn pituuden, on täysin passiivinen jännitys, joka vastustaa pidentymistä. Yhdessä on vahva vastustuskyky aktiivisen lihaksen pidentämiselle paljon aktiivisen jännityksen huippua pidemmälle.
voima-nopeus–relaatiosedit
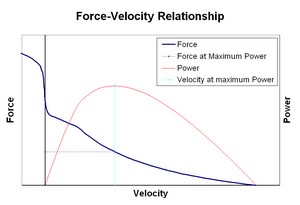
voiman ja nopeuden suhde suhteuttaa nopeuden, jolla lihas muuttaa pituuttaan (jota yleensä säätelevät ulkoiset voimat, kuten kuormitus tai muut lihakset) sen synnyttämään voiman määrään. Voima heikkenee hyperbolisesti suhteessa isometriseen voimaan lyhentymisnopeuden kasvaessa ja saavuttaa lopulta nollan jossain maksiminopeudessa. Käänteinen pätee, kun lihas venyy-voima kasvaa isometrisen maksimin yläpuolelle, kunnes lopulta saavuttaa absoluuttisen maksimin. Tämä aktiivisen lihaskudoksen luontainen ominaisuus vaikuttaa nivelten aktiiviseen vaimennukseen, jota aktivoivat samanaikaisesti aktiiviset vastakkaiset lihakset. Tällöin voima-nopeus-profiili lisää pidentyvän lihaksen tuottamaa voimaa lyhentyvän lihaksen kustannuksella. Tämä suosiminen kumpi tahansa lihas palauttaa yhteisen tasapainoon tehokkaasti lisää vaimennus yhteisen. Lisäksi vaimennuksen vahvuus kasvaa lihasvoimalla. Moottorijärjestelmä voi siis aktiivisesti hallita nivelvaimennusta vastakkaisten lihasryhmien samanaikaisen supistumisen (co-contraction) kautta.
Sileälihas

sileät lihakset voidaan jakaa kahteen alaryhmään: yksiyksikköön (unitary) ja moniyksikköön. Yhden yksikön sileitä lihassoluja löytyy suolesta ja verisuonista. Koska nämä solut liittyvät toisiinsa aukkoliitoksilla, ne pystyvät supistumaan syncytiumiksi. Yhden yksikön sileät lihassolut supistuvat myogeenisesti, jota autonominen hermosto voi moduloida.
toisin kuin yksiyksikköisiä sileälihassoluja, moniyksikköisiä sileälihassoluja on silmän lihaksessa ja karvatuppien tyvessä. Moniyksikköiset sileät lihassolut supistuvat siten, että autonomisen hermoston hermot stimuloivat niitä erikseen. Sellaisenaan ne mahdollistavat hienon kontrollin ja asteittaisen vasteen, aivan kuten motorisen yksikön rekrytointi luurankolihaksissa.
sileän lihaksen supistumisen mekanismit
sileiden lihassolujen supistumiskykyiseen aktiivisuuteen vaikuttavat useat syötteet, kuten spontaani sähköinen aktiivisuus, hermosto-ja hormonitoiminta, paikalliset muutokset kemiallisessa koostumuksessa ja venyminen. Tämä on toisin kuin luustolihassolujen supistumiskyky, joka nojaa yhteen hermotuloon. Tietyntyyppiset sileät lihassolut pystyvät tuottamaan omia toimintapotentiaalejaan spontaanisti, jotka yleensä tapahtuvat sydämentahdistinpotentiaalin tai hitaan aallon potentiaalin jälkeen. Nämä toimintapotentiaalit syntyvät solunulkoisen Ca2+
: n virrasta eikä Na+
: n virrasta. Kuten luustolihaksissa, myös sytosolisia Ca2+
– ioneja tarvitaan sileiden lihassolujen ristisiteen kiertoon.
sytosolisen Ca2+
: n kaksi lähdettä sileissä lihassoluissa ovat solunulkoinen Ca2+
, joka menee kalsiumkanavien läpi, ja Ca2+
ionit, jotka vapautuvat sarkoplasmaisesta retikulumista. Sytosolisen Ca2+
: n nousu johtaa siihen, että Ca2+
sitoutuu kalmoduliiniin, joka sitten sitoutuu ja aktivoi myosiinin valoketjukinaasin. Kalsium-kalmoduliini-myosiini-valoketjukinaasikompleksi fosforyloi myosiinin 20 kilodaltonin (kDa) myosiini-valoketjuissa aminohappojäännös-seriini 19: ssä aloittaen supistumisen ja aktivoiden myosiini-ATPaasin. Toisin kuin luurankolihassoluissa, sileälihassoluissa ei ole troponiinia, vaikka ne sisältävätkin ohutta filamenttiproteiinia tropomyosiinia ja muita merkittäviä proteiineja – kaldesmonia ja kalponiinia. Siten sileät lihassupistukset aloitetaan myosiinin Ca2 +
– aktivoidulla fosforylaatiolla sen sijaan, että Ca2+
sitoutuisi troponiinikompleksiin, joka säätelee myosiinin sitoutumiskohtaa aktiinissa, kuten luuston ja sydämen lihaksissa.
crossbridge Cyclingin Päättyminen (ja lihaksen jättäminen salpatilaan) tapahtuu, kun myosiinin kevytketjufosfataasi poistaa fosfaattiryhmät myosiinipäistä. 20 kDa: n myosiinin kevyiden ketjujen fosforylaatio korreloi hyvin sileän lihaksen lyhentymisnopeuden kanssa. Tänä aikana tapahtuu nopea energiakäytön purkaus hapenkulutuksella mitattuna. Muutaman minuutin kuluttua aloituksesta kalsiumpitoisuus laskee huomattavasti, 20 kDa: n myosiinin kevyiden ketjujen fosforylaatio vähenee ja energian käyttö vähenee; kuitenkin voima toonisessa sileässä lihaksessa säilyy. Lihasten supistumisen aikana aktivoidun aktiinin ja fosforyloidun myosiinin välille muodostuu nopeasti kiertäviä ristisyitä, jotka synnyttävät voimaa. On oletettu, että voiman ylläpito johtuu defosforyloiduista ”salpaussilloista”, jotka hitaasti kiertävät ja ylläpitävät voimaa. Useiden kinaasien kuten rho-kinaasin, DAPK3: n ja proteiinikinaasi C: n uskotaan osallistuvan pitkäkestoiseen supistumisvaiheeseen, ja Ca2+
– vuo voi olla merkittävä.
NeuromodulationEdit
vaikka sileät lihassupistukset ovat myogeenisiä, autonominen hermosto voi moduloida niiden supistusten nopeutta ja voimakkuutta. Parasympaattisen hermoston postganglioniset hermosyyt vapauttavat välittäjäaine asetyylikoliinia, joka sitoutuu sileiden lihassolujen muskariinisiin asetyylikoliinireseptoreihin (mAChRs). Nämä reseptorit ovat metabotrooppisia eli G-proteiinikytkentäisiä reseptoreita, jotka käynnistävät toisen viestikaskadin. Toisaalta sympaattisen hermoston postganglioniset hermosyyt vapauttavat välittäjäaineita epinefriiniä ja noradrenaliinia, jotka sitoutuvat adrenergisiin reseptoreihin, jotka ovat myös metabotrooppisia. Tarkat vaikutukset sileään lihakseen riippuvat reseptorin aktivoituneen ominaispiirteistä-sekä parasympaattinen tulo että sympaattinen tulo voivat olla joko eksitatorisia (supistuvia) tai estäviä (rentouttavia).
sydänlihassolut

sydänlihassoluja on kahdenlaisia: autorytmisiä ja supistumiskykyinen. Autorytmiset solut eivät supistu, vaan määräävät supistumisvauhdin muille sydänlihassoluille, joita autonominen hermosto voi moduloida. Sen sijaan supistumiskykyiset lihassolut (kardiomyosyytit) muodostavat suurimman osan sydänlihaksesta ja pystyvät supistumaan.
Magnetaatio-supistuskytkentä
sekä luuston että sydämen lihasten magnetaatio-supistuskytkentä (E-C), depolarisaatiojohtuminen ja Ca2+ vapautumisprosessit tapahtuvat. Vaikka kyseessä olevat proteiinit ovat samankaltaisia, ne ovat kuitenkin rakenteeltaan ja säätelyltään erillisiä. Dihydropyridiinireseptoreita (DHPRs) koodaavat eri geenit, ja ryanodiinireseptorit (RyRs) ovat erillisiä isoformeja. Lisäksi DHPR-kontaktit RyR1: n (luustolihaksen pääryr-isoformi) kanssa säätelevät Ca2+: n vapautumista luurankolihaksessa, kun taas L-tyypin kalsiumkanava (sydämen myosyyttien DHPR) ja RyR2 (sydänlihaksen pääryr-isoformi) eivät ole fyysisesti kytkettyinä sydänlihakseen, vaan kasvot toisiinsa liitoskytkennällä.
toisin kuin luustolihaksissa, sydänlihaksen E-C-kytkennän ajatellaan riippuvan ensisijaisesti mekanismista, jota kutsutaan kalsiumin indusoimaksi kalsiumin vapautumiseksi, mikä perustuu T-tubuluksen ja sarkoplasmisen retikulumin väliseen liitosrakenteeseen. Junctophilin-2 (JPH2) on välttämätöntä säilyttää tämä rakenne sekä eheys t-tubule. Toinen proteiini, reseptorin lisäproteiini 5 (REEP5), toimii pitämään normaalin morfologian junctional SR. vikojen junctional kytkentä voi johtua puutteista jompikumpi kahdesta proteiinista. Kalsiumin aiheuttaman kalsiumin vapautumisprosessin aikana Ryr2: t aktivoituvat kalsiumlaukaisimella, joka saadaan aikaan Ca2+: n virratessa L-tyypin kalsiumkanavien läpi. Tämän jälkeen sydänlihaksessa esiintyy yleensä diad (tai dyad) rakenteita Triadien sijaan.
heräte-supistuskytkentä sydänlihassoluissa tapahtuu, kun sinusolmukkeessa tai eteis-Kammiosolmukkeessa olevat tahdistinsolut käynnistävät aktiopotentiaalin ja se johdetaan kaikkiin sydämen soluihin aukkoliitosten kautta. Aktiopotentiaali kulkeutuu pintakalvoa pitkin T-tubuluksiin (jälkimmäisiä ei ole kaikissa sydämen solutyypeissä) ja depolarisaatio aiheuttaa solunulkoisen Ca2+
: n kulkeutumisen soluun L-tyypin kalsiumkanavien ja mahdollisesti natriumkalsiumin vaihtimen (NCX) kautta tasannevaiheen alkupuolella. Vaikka tämä Ca2+ – tulva on vain noin 10% aktivointiin tarvittavasta Ca2+ – virrasta, se on suhteellisesti suurempi kuin luustolihasten. Tämä Ca2+
: n sisäänvirtaus aiheuttaa pienen paikallisen solunsisäisen Ca2 +
: n suurenemisen. Solunsisäisen Ca2+
: n lisääntyminen havaitaan ryr2: lla sarkoplasmaisen retikulumin kalvossa, jolloin Ca2+
vapautuu positiivisessa takaisinkytkentäfysiologisessa vasteessa. Tätä positiivista palautetta kutsutaan kalsiumin indusoimaksi kalsiumin vapautumiseksi ja se synnyttää kalsiumkipinöitä (Ca2 +
kipinöitä). Spatiaalinen ja ajallinen summaus ~30 000 Ca2+
sparks antaa solulaajuisen sytoplasmisen kalsiumpitoisuuden kasvun. Solukalvon läpi kulkevan kalsiumin ja sarkoplasmaisen retikulumin kautta tapahtuvaa sytosolikalsiumin lisääntymistä hillitään kalsiumpuskureilla, jotka sitovat suuren osan solunsisäisestä kalsiumista. Tämän seurauksena kokonaiskalsiumin suuri kasvu johtaa suhteellisen pieneen vapaan Ca2+
: n nousuun.
sytoplasmainen kalsium sitoutuu troponiini C: hen, jolloin tropomyosiinikompleksi irtoaa aktiinisitoutumiskohdasta, jolloin myosiinin Pää sitoutuu aktiinifilamenttiin. Tästä lähtien supistumiskyky on periaatteessa sama kuin luustolihaksilla (yllä). Lyhyesti ATP-hydrolyysin avulla myosiinipää vetää aktiinihehkulankaa kohti sarkomeerin keskustaa.

systolin jälkeen Sarco/endoplasmic reticulum ATPase (SERCA) – pumppu ottaa solunsisäisen kalsiumin takaisin sarkoplasminen verkkokalvo valmiina seuraavan syklin alkuun. Kalsiumia poistuu solusta myös pääasiassa natriumkalsiumin vaihtimen (NCX) ja vähäisemmässä määrin plasman kalvokalsium-ATPaasin avulla. Jonkin verran kalsiumia ottavat myös mitokondriot. Eräs entsyymi, fosfolambaani, toimii Sercan jarruna. Alhaisilla syketiheyksillä fosfolambaani on aktiivinen ja hidastaa ATPaasin toimintaa niin, ettei Ca2+
: n tarvitse poistua solusta kokonaan. Suurella syketiheydellä fosfolambaani fosforyloituu ja deaktivoituu, jolloin suurin osa Ca2 +
: stä siirtyy sytoplasmasta takaisin sarkoplasmaiseen retikulumiin. Jälleen kerran kalsiumpuskurit vähensivät Ca2+
– pitoisuutta maltillisesti, mikä mahdollistaa vapaan Ca2 +
– pitoisuuden suhteellisen pienen pienenemisen vastauksena kalsiumin kokonaispitoisuuden suureen muutokseen. Laskeva Ca2 +
– konsentraatio mahdollistaa troponiinikompleksin irtautumisen aktiinifilamentista, jolloin supistuminen päättyy. Sydän rentoutuu, jolloin kammiot täyttyvät verellä ja sydämen kiertokulku alkaa uudelleen.
Leave a Reply