Frontiers in Oncology
introduktion
omkring 25% af de tidlige brystkræftpatienter oplever stadig lokal gentagelse og udvikler fjerne metastaser efter aktiv behandling (1), og næsten 10% af patienterne er i fase IV sygdom ved første diagnose i den udviklede verden, der kaldes de novo metastatisk brystkræft (MBC) (2). På trods af fremskridt i behandlingen forbliver MBC uhelbredelig, og op til 70-80% af MBC-patienter dør af kræft inden for 5 år (2). Som et resultat af heterogeniteten af MBC udvikles flere prognostiske modeller baseret på prognostiske faktorer eller scoringer for at forudsige deres kliniske resultater og direkte klinikere til at træffe passende terapeutiske beslutninger (3-5). Desuden er der også en række prognostiske modeller for brystkræft med hjernemetastase (BCBM) for klinikere til nøjagtigt at forudsige overlevelse hos disse patienter (6, 7).
brystkræft kan metastasere overalt i kroppen, men metastaserer primært til lunge, knogle, lever, ikke-aksillære lymfeknuder og hjerne (8). Især levermetastase (LM) er ikke kun et almindeligt metastatisk sted, men også forbundet med signifikant øget dødsrisiko svarende til hjernemetastase, en uforholdsmæssigt højere dødelighed sammenlignet med lunge-eller knoglemetastaser (5, 8). Da graderet prognostisk vurdering (GPA) er bredt accepteret hos BCBM-patienter, stimulerer de ovennævnte prognostiske modeller os til at foreslå en praktisk model for BCLM (3-7). Vores mål var at konstruere en pålidelig og brugervenlig prognostisk model for BCLM og at evaluere dens overensstemmelse og nøjagtighed ved at validere den både internt og eksternt. Den prognostiske model kan hjælpe klinikere med at estimere dødsrisikoen for BCLM-patienter og vælge optimal behandling.
patienter og metoder
udvælgelse af patienter
denne undersøgelse blev godkendt af fuscc ‘ s uafhængige etiske udvalg. På hinanden følgende MBC-patienter diagnosticeret ved FUSCC fra januar 2007 til December 2018 blev identificeret (n = 9.062). Kriterierne for støtteberettigelse var som følger: (1) histologisk bekræftet brystkræft, (2) kvindelige patienter, (3) leveren som det første sted for metastatisk sygdom i enten de novo metastatisk eller tilbagevendende brystkræft og (4) komplette og detaljerede optegnelser. Patienter med bilateral brystkræft, andre invasive neoplasmer eller med ukendt opfølgning blev ekskluderet. Endelig var der 1.022 kvalificerede patienter udvalgt til yderligere analyse. De fulde trin i udvælgelsen er vist i figur S1.
undersøgelse af variabler og udvælgelse af afskæringsværdier
Information blev indsamlet om følgende klinikopatologiske variabler: alder, molekylære undertyper, forudgående behandlingsinformation (kirurgi og systemisk kemoterapi), MFI, steder med ekstrahepatisk metastase (hjerne, lunge, knogle og lymfeknuder), egenskaber ved levermetastase (fordeling, antal, maksimal diameter), hæmoglobin (HB), leverfunktionstest og overlevelsestid. Molekylære undertyper omfattede hormonreceptor (HR) og human epidermal vækstfaktorreceptor 2 (HER2) status. Vi definerede MFI som intervallet mellem datoen for diagnosen primær brystkræft og datoen for den første fjerne metastase. Afskæringspunkterne for MFI anvendt i denne undersøgelse var 3 og 24 måneder ifølge reference (9). Derfor kunne patienter opdeles i tre grupper: patienter med de novo MBC (MFI < 3 måneder), patienter med en kort MFI (kur 24 måneder) og patienter med en lang MFI > 24 måneder. Fjern lymfeknudemetastase blev defineret som metastase ud af ipsilaterale aksillære, supraklavikulære, infraklavikulære eller indre brystlymfeknuder. Diagnosen af LM var baseret på den radiografiske billeddannelse eller patologiske beviser. Karakteristika for levermetastase blev evalueret ved hjælp af abdominal computertomografi (CT), magnetisk resonansafbildning (MRI) eller kirurgiske resektionsprøver. Leverfunktionstest blev også analyseret i den foreliggende undersøgelse, herunder total bilirubin, alaninaminotransferase (alat), aspartataminotransferase (ASAT), alkalisk phosphatase (ALP), lactatdehydrogenase (LDH) og forholdet mellem rela-glutamyltransferase og albumin (GAR). Blodprøver blev taget til laboratorieundersøgelser inden for 1 uge efter diagnosen LM. Klassifikationer af distribution, antal eller maksimal diameter af levermetastaser og LDH var baseret på andre undersøgelser (10-13). Afskæringsværdierne for HB, total bilirubin, ALAT, ASAT og ALP blev bestemt i henhold til de fælles Terminologikriterier for bivirkninger (CTCAE), fordi moderate eller grad II abnormiteter i hæmoglobinniveauer eller leverfunktion kan påvirke terapeutiske valg (14). Værdien af GAR blev defineret som et simpelt forhold mellem serumy-glutamyltransferase (GGT, U/L) niveau og serumalbumin (ALB g/L) niveau. OS fra tidspunktet for metastase blev målt fra datoen for diagnose af LM til døden for enhver årsag. Den sidste opfølgningsperiode var November 2019 med en median opfølgningstid på 18,63 måneder. Hvis patienter gik tabt for opfølgning, blev det censureret på den sidste opfølgningsdag.
statistisk analyse
patienter blev opdelt i træningen (2007-2016, n = 715) og validering (2016-2018, n = 307) sat i et forhold på 7:3. Den optimale afskæringsværdi for GAR blev valgt ved beregningen af Youden-indekset og modtagerens driftskarakteristikkurve (ROC) – analyse (figur S2). Pearson chi-kvadreret test eller Fishers nøjagtige test blev brugt til at foretage en sammenligning mellem kategoriske variabler. Regressionsmodeller med den bagudvalgte metode blev brugt til multivariat analyse og til beregning af fareforhold. Regressionskoefficienterne blev beregnet gennem multivariat regressionsanalyse og derefter ganget med 10 og afrundet for at repræsentere endelige prognostiske score. Bootstrapping blev brugt til intern Validering. Derefter, tidsafhængige ROC-kurver og kalibreringsplotter blev brugt til at vurdere diskrimination og kalibrering af denne prognostiske model i valideringssættet. Afskæringsværdierne for risikogrupper blev bestemt af Røntgenplotter (15). Overlevelsesanalyse blev udført ved hjælp af Kaplan-Meier-overlevelseskurver, og log-rank-test blev brugt til at sammenligne overlevelseskurver. Alle P-værdier var tosidede, og værdier af P < 0,05 blev betragtet som statistisk signifikante. Statistisk analyse blev udført ved hjælp af SPSS-programmer (SPSS 20, Chicago, IL, USA) og R-programmer version 4.0.1.
resultater
karakteristika og forhold til risikostratificering
i alt 1.022 patienter udvalgt i denne undersøgelse blev opdelt i træning (n = 715) og validering (n = 307) sæt. En beskrivelse af klinikopatologiske egenskaber er angivet i tabel 1 og tabel S1. I træningsgruppen var der 126 patienter (17,6%) diagnosticeret med de novo MBC og 589 patienter (82,4%) med tilbagevendende MBC, hvoraf 297 patienter (50,4%) havde en kort MFI og 292 patienter (49,6%) havde en lang MFI. Medianalderen ved diagnosen LM var 50 (interval 21-87) år med 617 patienter (86.3%) yngre end 60 år. Af disse patienter var andelen af HR-positive og HER2-positive patienter henholdsvis 62, 2 og 38, 0%. Blandt tilbagevendende MBC-patienter gennemgik næsten alle patienter operation på den primære tumor (584, 99, 2%) og modtog (neo)adjuverende kemoterapi (569, 96, 6%). Mønstre af fjern metastase viste, at det mest almindelige sted for ekstrahepatisk metastase var knogle (42,7%) efterfulgt af fjerne lymfeknuder (36,1%), lunge (25,6%) og hjerne (2,9%). Levermetastase var karakteriseret ved diffus fordeling og små knuder, hvoraf størstedelen var flere (IRR 3 metastaser, 77,3%), men små knuder (IRR 3 cm, 59,4%) og involverede højre og venstre lobes (74,4%). I det tidlige stadium af LM var leverfunktionen nedsat i varierende grad, men generelt mild. Stigningen af LDH (36,1%) og GAR (35,9%) syntes at være følsomme leverdysfunktionsindikatorer, og moderate eller over abnormiteter i HB (2,9%), total bilirubin (2,7%), alat (3,6%), ASAT (9,5%) og ALP (3,9%) niveauer var usædvanlige ifølge CTCAE. Sammenlignet med lavrisikogruppen præsenterede mellem – og højrisikogruppen en højere HR-og HER2-negativitet, en kort MFI, ekstrahepatisk metastase, levermetastase-tumorbelastning og abnormiteter i hæmoglobinniveauer eller leverfunktion (alle Ps-kar 0,001), hvilket antyder, at disse faktorer kan påvirke prognosen for BCLM.
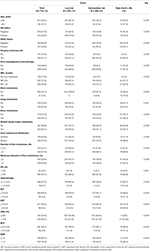
tabel 1. Baseline karakteristika og dens forhold til risiko stratificering af uddannelse sæt.
prognostisk Model og validering
i den multivariate regressionsmodel blev molekylære undertyper (HR og HER2-status), MFI, steder med ekstrahepatisk metastase (hjerne -, lunge-og knoglemetastase) og leverfunktionstest (total bilirubin, LDH og GAR) forbundet med OS (tabel 2). Specifikt dødsrisikoen for HR–negativ (HR 1.740, 95% CI 1.424–2.127, p < 0.001) og HER2-negativ (HR 1.615, 95% CI 1.316-1.983, P < 0.001) patienter steg sammenlignet med HR eller HER2 positive kolleger. Længden af MFI havde også en signifikant indflydelse på overlevelsen af BCLM–patienter, og derfor blev overlevelsen af patienter med en lang MFI (HR 1.612, 95% CI 1.195–2.174, P < 0.001) forkortet i sammenligning med patienter med de novo MBC og patienter med en kort MFI (HR 2.563, 95% CI 1.904-3.449, p < 0.001) havde mere end dobbelt så stor risiko for død i forhold til dem. Derudover var tilstedeværelsen af ekstrahepatisk metastase (hjerne -, lunge-og knoglemetastase) og unormal leverfunktion (total bilirubin, LDH og GAR) alle korreleret med en ugunstig prognostisk indvirkning på OS. Denne prognostiske model havde området under kurven (AUC) for tidsafhængig ROC ved 1 års OS med 0,78 i træningssættet og 0,80 i valideringssættet, hvilket indikerer, at denne model havde en god forskelsbehandling (Figur 1). Bootstrapping-metoden blev brugt til at bekræfte stabiliteten af vores prognostiske model i træningssættet, og de endelige resultater var ret robuste (tabel S2). Kalibreringskurver for den prognostiske model for 1 år og 3 år OS i træningssættet samt 1 år OS i valideringssættet viste sin gode overensstemmelse (figur 2).

tabel 2. Multivariat regressionsmodel (træningssæt).
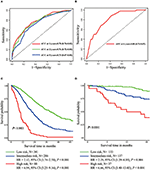
Figur 1. Tidsafhængige ROC-kurver for den prognostiske model i træningssættet (A) og valideringssættet (B). Samlet overlevelse fra metastase af de tre prognostiske grupper i træning (C) og validering sæt (D).
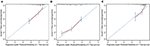
figur 2. Kalibreringskurven til forudsigelse af patientens overlevelse efter 1 år (A) og 3 år (B) i træningssættet og efter 1 år (C) i valideringssættet.
risikostratificering og overlevelse

tabel 3. Beregning af score og cutoff point for de prognostiske grupper.
Diskussion
i den nuværende analyse af 1.022 patienter behandlet i vores institution fra 2007 til 2018 har vi vist, at molekylære undertyper (HR og HER2 status), MFI, steder med ekstrahepatisk metastase (hjerne -, lunge-og knoglemetastase), leverfunktionstest (total bilirubin, LDH og GAR) var uafhængige prognostiske faktorer for BCLM-patienter. Derfor blev en prognostisk model for BCLM-patienter konstrueret ved hjælp af prognostiske faktorer.
med hensyn til molekylære undertyper kan HR-positiv indikere, at vækst og spredning af brystkræft stadig reguleres af hormoner, kaldet hormonafhængige tumorer. Samtidig har endokrin terapi fordele, herunder få bivirkninger og langvarige virkninger, som ofte kan medføre langsigtede overlevelsesfordele for HR-positive patienter. Derfor er HR-positiv blevet betragtet som en signifikant faktor, der tyder på en gunstig prognose i tidlig og metastatisk brystkræft (1, 3-5, 8-10, 16). Selvom HER2-amplifikation og overekspression anses for at være en forudsigelse for en risiko for fjern metastase og brystkræftrelateret død, har efterfølgende udviklede anti–HER2-midler bemærkelsesværdigt forbedret overlevelse af HER2-positive brystkræftpatienter (2, 9, 17). I æraen med målrettet terapi fandt en undersøgelse i det sydøstlige Holland, at dødelighedsrisikoen for HER2-negative patienter blev øget med 44% (95% CI 1,13–1,83, P = 0,003) sammenlignet med HER2-positive patienter (9). I vores undersøgelse steg dødsrisikoen for HR-negative og HER2-negative patienter sammenlignet med HR eller HER2-positive kolleger i overensstemmelse med disse observationer. Patienter med en kort MFI, normalt defineret som 24 måneder med kronisk nyresvigt, havde en dårligere prognose (3, 5, 9). Desuden syntes de novo MBC-patienter at have en signifikant bedre prognose i forhold til tilbagevendende MBC-patienter, selvom denne forskel gradvist blev reduceret med forlængelsen af sygdomsfrit interval (DFI) eller MFI (9, 18, 19). Et al. 24 måneder havde signifikant kortere overlevelsestid (9,1 vs. 29.4 måneder ,P <0,001) end dem med de novo stadium IV sygdomme, men patienter med en længere MFI (> 24 måneder) havde en lignende prognose (27,9 vs. 29,4 måneder, P = 0,73) (9). Den mulige årsag til dette fænomen er, at patienter med recidiverende MBC, der tidligere har gennemgået systematisk behandling, kan være mere resistente over for kemoterapi end behandlingsnaive patienter med de novo MBC, men yderligere undersøgelse er berettiget (9, 18, 19). Denne undersøgelse bekræftede, at overlevelsestiden for patienter med en lang MFI blev forkortet i sammenligning med de novo MBC med patienter med en kort MFI, der gav et signifikant dårligere resultat.
MBC-overlevelse varierede signifikant afhængigt af metastatiske steder, og patienter med visceral metastase var forbundet med en øget risiko for dødelighed sammenlignet med dem med ikke-visceral metastase (3-5, 9, 18). Desuden havde tilstedeværelsen af hjernemetastase en større indflydelse på overlevelse end nogen andre metastatiske steder (3, 5, 9, 18). Det var ikke overraskende, at flere metastaser havde en mere ugunstig indflydelse på prognosen (3, 5, 9, 17, 18). I denne analyse kunne ekstrahepatisk metastase, bortset fra fjern lymfeknudemetastase, føre til forkortet overlevelse, sandsynligvis fordi levermetastase var den kritisk livstruende faktor sammenlignet med lymfeknudemetastase.
det skal bemærkes, at patienter med højere bilirubinniveauer havde meget lavere risiko for flere sygdomme delvis via dets antioksidante og antiinflammatoriske egenskaber (20). En nylig undersøgelse rapporterede også, at en næsten 40% reduktion af dødsrisikoen blev vist blandt tidlige brystkræftpatienter med højere total bilirubin niveau (21). Hyperbilirubinæmi var imidlertid forbundet med dårlig prognose blandt BCLM-patienter (22). Det er muligt, at i modsætning til relativt højere total bilirubin blandt ikke-metastatiske brystkræftpatienter kan en hævet bilirubin 1,5 gange mere end den øvre grænse for normal (ULN) blandt BCLM-patienter forudsige alvorlig leverskade og således bidrage til seponering af lægemidler eller hepatisk encefalopati.effekten får kræftceller til at afhænge af aerob glykolyse, selv når iltforsyningen er tilstrækkelig, hvilket er kendetegnende for kræftmetabolisme i modsætning til normalt væv (23). LDH spiller en uundværlig rolle i glykolyse på grund af dets evne til at omdanne pyruvat til lactat under anaerobe forhold (24). Deregulerede niveauer af LDH kunne afspejle højere tumorbyrde, dårligere behandlingsrespons og prognose, som tidligere var rapporteret i flere tumorer (21, 24-26). En metaanalyse af prognostisk effekt af LDH hos brystkræftpatienter viste, at højere LDH-niveauer resulterede i utilfredsstillende OS og progressionsfri overlevelse, som omfattede 11 undersøgelser, der involverede 6.102 patienter (27).
GGT, det vigtigste endogene antioksidant, gør forstadier aminosyrer assimileret og involverer i glutathionsyntese (28). GGT i tumorer gør det muligt for celler hurtigt at genopbygge glutathion efter at have modtaget anticancerbehandling og er derfor korreleret med lægemiddelresistens og dårlig overlevelse (29). Interessant, Fentiman et al. rapporterede, at der blev identificeret et signifikant positivt forhold mellem forhøjet GGT og brystkræftrisiko (30). ALB syntetiseret af leveren fungerer som et antioksidant, transportør af næringsstoffer og har deltagelse i signalveje på grund af dets unikke strukturelle egenskaber (31). Hypoalbuminæmi forekommer normalt hos avancerede kræftpatienter og tilskrives forskellige mekanismer, herunder nedsat leversyntese, øget katabolisme og kakeksi (21, 31). Hypoalbuminæmi er en uafhængig indikator for dårlig prognose for forskellige tumorer (21, 22, 32, 33). I modsætning til nedsatte serumalbuminniveauer har serum GGT-niveauer tendens til at være forhøjet, når leverfunktionen er nedsat. Derfor kan GAR baseret på ovenstående to parametre have den fordel at afspejle leverreserve evne og forudsige prognosen (32, 33). I den nuværende undersøgelse var unormal leverfunktion (total bilirubin, LDH og GAR) alle korreleret med en ugunstig prognostisk indvirkning på OS.
efter analyse af prognosen for 123 BCLM-patienter, duan et al. fandt, at patienter med tre eller flere levermetastaser bar 2.26 gange øget risiko for død i forhold til patienter med <3 levermetastaser i multivariat analyse (10). Karakteristika ved levermetastase i denne undersøgelse syntes imidlertid ikke at gøre nogen forskel. Der er to mulige årsager, der bidrager til denne uoverensstemmelse. Først og fremmest var fordelingen, antallet og den maksimale diameter af levermetastaser signifikant forskellige i de tre risikogrupper, hvilket indikerer, at risikoen for dødelighed steg med udvidelsen af levermetastase i univariat analyse. Derefter var unormal leverfunktion tæt forbundet med tumorbelastningen af levermetastase, hvilket justerede disse faktorers rolle i multivariat analyse.
der har været mange undersøgelser af prognostiske faktorer i indstillingen af BCLM. En analyse af 145 BCLM-patienter viste, at hypoalbuminæmi, ældre alder og er-negativitet var uafhængige forudsigere for dårlig overlevelse (22). En græsk registeranalyse opnåede lignende resultater, hvor HR-positivitet, lav histologisk grad, fravær af ekstrahepatisk metastase og god præstationsstatus var signifikante prognostiske faktorer for gunstig prognose i univariat analyse (34). En nylig populationsbaseret undersøgelse med mere end 4.000 patienter med de novo BCLM har identificeret demografiske og socioøkonomiske faktorer, patologisk grad, samlet antal ekstrahepatisk metastase, behandling og molekylær subtype som parametre, der påvirker den samlede overlevelse signifikant (17). Regierer et al. udviklet en prognostisk score for MBC baseret på HR-status, MFI og metastasesteder for at forudsige deres prognose og individualisere optimal behandling, som blev valideret internt og eksternt (5). Desværre var HER2-status ikke inkluderet i den prognostiske score og begrænsede derfor dens anvendelighed. Den modificerede bryst-GPA for BCBM-patienter, der integrerede fire enkle kliniske parametre, havde en øjeblikkelig rolle i forudsigelsen af deres overlevelse, men var ikke anvendelig for BCLM-patienter (7). Så vidt vi ved, er der ingen prognostisk model, der integrerer disse prognostiske faktorer for BCLM-patienter, så vores model giver pragmatisk mening.
der var også nogle begrænsninger i denne forskning. Først, en enkelt-center og retrospektiv undersøgelse resulterede uundgåeligt i selektionsforstyrrelse, selvom vores prognostiske model blev valideret internt og eksternt. For det andet blev patienter, der udviklede levermetastase senere i sygdomsforløbet, udelukket, så vi ikke var i stand til at evaluere disse patienter. For det tredje var detaljerede oplysninger om præstationsstatus og behandling ikke tilgængelige i denne undersøgelse.
konklusioner
På trods af disse begrænsninger kan denne forskning give en enkel og pålidelig prognostisk model. Den største fordel ved vores undersøgelse er inkorporering af parametre, der er let tilgængelige i klinisk praksis på basis af den store prøve af BCLM-patienter. Bortset fra udsøgt klassificering af tumorer i henhold til næste generations sekventeringsmetoder, vores model kan hjælpe med at identificere undergrupper med forskellig prognose og guide efterfølgende terapi.
Datatilgængelighedserklæring
de originale bidrag, der præsenteres i undersøgelsen, er inkluderet i artiklen/supplerende materiale, yderligere undersøgelser kan rettes til den tilsvarende forfatter/S.
etisk Erklæring
denne undersøgelse blev godkendt af fuscc ‘ s uafhængige etiske udvalg. Patienterne / deltagerne gav deres skriftlige informerede samtykke til at deltage i denne undersøgelse.
Forfatterbidrag
LJ foreslog undersøgelsen. JFR og jfr har indsamlet data. LJ og LF analyserede dataene og skrev det første udkast. DF har gennemgået manuskriptet kritisk. Alle forfattere bidrog til artiklen og godkendte den indsendte version.
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
Vi anerkender Lei Cheng for at udføre dataanalyse.
supplerende materiale
forkortelser
BCLM, brystkræft med levermetastase; FUSCC, Fudan University Shanghai Cancer Center; ROC, modtager operativ karakteristisk kurve; MFI, metastatisk-frit interval; HR, fareforhold; CI, konfidensinterval; OS, samlet overlevelse; MBC, metastatisk brystkræft; BCBM, brystkræft med hjernemetastase; LM, levermetastase; GPA, graderet prognostisk vurdering; HB, hæmoglobin; HR, hormonreceptor; HER2, human epidermal vækstfaktorreceptor 2; CT, computeriseret tomografi; MR, magnetisk resonansbilleddannelse; ALT, alaninaminotransferase; AST, aspartataminotransferase; ALP, alkalisk fosfatase; LDH, lactatdehydrogenase; gar, forholdet mellem rela-glutamyltransferase og albumin; GGT, Kurt-glutamyltransferase; ALB, albumin; CTCAE, fælles Terminologikriterier for bivirkninger; ULN, øvre normalgrænse.
4. Puente J, Lopes-Tarruella S, Ruis A, Lluch a, Pastor M, Alba E, et al. Praktisk prognostisk indeks for patienter med metastatisk tilbagevendende brystkræft: retrospektiv analyse af 2.322 patienter fra GEICAM Spanish El Alamo Register. Brystkræft Res Behandle. (2010) 122:591–600. doi: 10.1007/s10549–009-0687–4
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Regierer AC, Wolters R, Ufen MP, Weigel A, Novopashenny I, Kohne CH, et al. An internally and externally validated prognostic score for metastatic breast cancer: analysis of 2269 patients. Ann Oncol. (2014) 25:633–8. doi: 10.1093/annonc/mdt539
PubMed Abstract | CrossRef Full Text
6. Marko NF, Gao T, Kattan MVH, VJ RJ. Forudsigelse af overlevelse hos kvinder med brystkræft og hjernemetastase: et nomogram overgår de nuværende overlevelsesforudsigelsesmodeller. Kræft. (2012) 118:3749–57. doi: 10.1002 / cncr.26716
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
7. Jeg er, jeg er, jeg er, jeg er, Sulman EP, Chaves-MacGregor M, Tripathy D, et al. Validering og udvikling af en modificeret brystgraderet prognostisk vurdering som et redskab til overlevelse hos patienter med brystkræft og hjernemetastaser. J Clin Oncol. (2015) 33:2239–45. doi: 10.1200 / JCO.2014.58.8517
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
9. Jørgensen, Jørgensen Jørgensen, Jørgensen Jørgensen, Jørgensen Jørgensen, Jørgensen Jørgensen, Jørgensen Jørgensen, Jørgensen Jørgensen, et al. Prognose for metastatisk brystkræft: er der forskelle mellem patienter med de novo og tilbagevendende metastatisk brystkræft? Br J Cancer. (2015) 112:1445–51. doi: 10.1038/bjc.2015.127
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Duan XF, Dong NN, Zhang T, Li Q. The prognostic analysis of clinical breast cancer subtypes among patients with liver metastases from breast cancer. Int J Clin Oncol. (2013) 18:26–32. doi: 10.1007/s10147–011-0336-x
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dueck AC, Mitchell SA, Reeve BB, Castro KM, Rogak LJ, et al. Gyldighed og pålidelighed af US National Cancer Institute ‘ s patientrapporterede Resultatversion af Common Terminology Criteria for Adverse Events (PRO-CTCAE). JAMA Oncol. (2015) 1:1051–9. doi: 10.1001 / jamaoncol.2015.2639
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
17. En populationsbaseret undersøgelse af levermetastaser hos kvinder med nydiagnosticeret brystkræft. Kræftepidemiol Biomarkører Forrige. (2019) 28:283–92. doi: 10.1158/1055–9965.EPI-18–0591
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dawood S, Broglio K, Ensor J, Hortobagyi GN, Giordano SH. Survival differences among women with de novo stage IV and relapsed breast cancer. Ann Oncol. (2010) 21:2169–74. doi: 10.1093/annonc/mdq220
PubMed Abstract | CrossRef Full Text
19. den Brok, Speers CH, Gondara L, Tyldesley SK, Lohrisch CA. Overlevelse med metastatisk brystkræft baseret på indledende præsentation, de novo versus recidiverende. Brystkræft Res Behandle. (2017) 161:549–56. doi: 10.1007 / s10549–016-4080–9
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
20. Systemisk regulering af bilirubin-homeostase: potentielle fordele ved hyperbilirubinæmi. Hepatologi. (2018) 67:1609–19. doi: 10.1002/hep.29599
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Liu X, Meng QH, Ye Y, Hildebrandt MAT, Gu J, Wu X. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer. Carcinogenesis. (2015) 36:243–8. doi: 10.1093/carcin/bgu247
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Vander Heiden MG, Cantley LC, Thompson CB. De metaboliske krav til celleproliferation. Videnskab. (2009) 324:1029–33. doi: 10.1126 / videnskab.1160809
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
24. Mishra D, Banerjee D. Lactatdehydrogenaser som metaboliske forbindelser mellem tumor og stroma i tumormikromiljøet. Kræft. (2019) 11:750. doi: 10.3390/cancers11060750
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Pelizzari G, Basile D, Zago S, Lisanti C, Bartoletti M, Bortot L, et al. Lactate dehydrogenase (ldh) response to first-line treatment predicts survival in metastatic breast cancer: first clues for a cost-effective and dynamic biomarker. Cancers. (2019) 11:1243. doi: 10.3390/cancers11091243
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Hopkins AM, Rowland A, McKinnon RA, Sorich MJ. Predictors of long-term disease control and survival for HER2-positive advanced breast cancer patients treated with pertuzumab, trastuzumab, and docetaxel. Front Oncol. (2019) 9:789. doi: 10.3389/fonc.2019.00789
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Bafaloukou V, Pectasides D, Skarlos d, et al. Metastatisk brystkræft med levermetastaser: en registeranalyse af klinikopatologiske, ledelses-og resultategenskaber hos 500 kvinder. Brystkræft Res Behandle. (2006) 97:237–44. doi: 10.1007 / s10549–005-9117–4
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Leave a Reply