grænser i farmakologi
introduktion
Liposomer er en type nanocarrier, der er blevet undersøgt bredt til lægemiddelafgivelsesformål. De er sammensat af phospholipid dobbeltlag, der omslutter et særskilt vandigt rum og derved tillader indkapsling af både hydrofile og hydrofobe forbindelser (Metselaar og Storm, 2005). Liposomer er i stand til at stabilisere terapeutiske forbindelser og overvinde barrierer for cellulær og vævsoptagelse (ding et al., 2006; Hua og Hu, 2013). Dette gør det muligt for dem at forbedre målretningen af forbindelser til sygdomssteder og følgelig reducere akkumulering i ikke-målorganer., 1994; Mastrobattista et al., 1999; Hua, 2013; Hua et al., 2015; Sercombe et al., 2015; Vahed et al., 2017). Der er fire hovedtyper af liposomer baseret på deres overfladeegenskaber – konventionelle liposomer, pegylerede liposomer, ligandmålrettede liposomer og theranostiske liposomer (Figur 1; Sercombe et al., 2015). Ligandmålrettede liposomer giver potentialet for stedsspecifik levering af lægemidler til visse væv eller organer, der selektivt udtrykker den målrettede ligand (Vilis og Forssen, 1998; Bendas, 2001; Savant og Torchilin, 2012), mens pegylerede liposomer giver sterisk hindring for at forbedre cirkulationshalveringstiden for leveringssystemet efter systemisk administration (Torchilin, 1994; Vang et al., 2015). Liposomer, der indeholder en kombination af de forskellige leveringsplatforme, kan yderligere forbedre leveringen af indkapslede forbindelser afhængigt af indgivelsesvejen og sygdomsstedet.
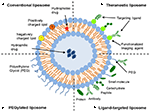
figur 1. Skematisk repræsentation af de forskellige typer liposomale lægemiddelafgivelsessystemer – (a) konventionelt liposom, (B) pegyleret liposom, (C) Ligandmålrettet liposom og (d) Theranostisk liposom (Sercombe et al., 2015).
efter fremstillingsprocessen er liposomer karakteriseret for at sikre homogenitet på tværs af en række parametre, herunder lægemiddelindkapsling, ligandkonjugering, lipidsammensætning, overfladeafladning og morfologiske egenskaber (f.eks. størrelse, form og antal lameller) (Kuntsche et al., 2011). Disse egenskaber er vigtige, da de kan have stor indflydelse på liposomernes opførsel både in vitro og in vivo (Savant og Torchilin, 2012; Sercombe et al., 2015). Anerkendelse og clearance af liposomer ved kroppens forsvar, herunder reticuloendothelial system (RES) og adsorption af opsoniner med efterfølgende optagelse af det mononukleære fagocytiske system, er vigtige bidragydere til clearance og nedbrydning af liposomer (Senior, 1987; Cullis et al., 1998; Ishida et al., 2001). Derfor er det vigtigt at kunne bestemme de fysisk-kemiske egenskaber af fremstillede liposomer for at optimere en formulering til yderligere translationel evaluering.
et vigtigt aspekt i den fysisk-kemiske vurdering af liposomer er visualisering af nanopartiklernes morfologi ved hjælp af mikroskopi. Der er en række teknikker til rådighed til billeddannelse af liposomer og andre nanopartikler, der bredt kan kategoriseres i lys -, elektron-eller atomkraftmikroskopi (Bibi et al., 2011). Hver teknik har sine egne fordele og begrænsninger, som bør overvejes ved evaluering af undersøgelser af nanopartikelbaserede lægemiddelafgivelsessystemer (tabel 1). Denne gennemgang vil evaluere hver billeddannelsesteknik, der bruges til at vurdere de morfologiske egenskaber ved liposomer.

tabel 1. Oversigt over aktuelle billeddannelsesteknikker til karakterisering af liposommorfologi.
lysmikroskopi
lys eller optisk mikroskopi henviser til mikroskoper, der bruger synligt lys og et arrangement af linser til at forstørre et synsfelt (Murphy and Davidson, 2012c). Grundlæggende lysmikroskopi i sig selv er ikke i stand til at give omfattende information om lipid-dobbeltlaget sammenlignet med detaljerne, der tilbydes af andre mikroskopiteknikker. Det kan dog bruges til hurtigt at opnå et billede af vesikler ved hjælp af grundlæggende laboratorieudstyr (Bibi et al., 2011). Denne teknik kan være særlig nyttig ved indsamling af generel information om størrelse, form, homogenitet og grad af aggregering af en liposomprøve (Nallamothu et al., 2006). Lysmikroskoper har en ultimativ opløsning på 250 nm (styret af den mindste diffraktionsbegrænsede pletstørrelse, der kan opnås ved hjælp af instrumentet) og er som sådan typisk ude af stand til at give detaljerede oplysninger om strukturer af små unilamellære vesikler (SUV ‘ er) og lamellariteten af vesikler (Bibi et al., 2011). Generelt kan lysmikroskopi kun give væsentlig information om gigantiske unilamellære vesikler (Guv ‘ er), som kan variere fra enkelt til hundreder af mikrometer i diameter (Bagatolli, 2009). Inkorporering af fluorescerende prober, polariseringsteknikker og anvendelse af konfokal mikroskopi med høj opløsning kan give mere information om 3D-strukturen og lamellariteten af vesiklerne (Bagatolli, 2009).
Polarisationsmikroskopi
denne type lysmikroskopi udnytter polariseret lysets unikke evne til at interagere med polariserbare bindinger af ordnede molekyler (Murphy og Davidson, 2012d). Forbedret lysabsorption opstår, når molekylære dipoler i prøven er justeret med polarisationsvektoren for den indfaldende lysbølge; hvilket resulterer i faseforskelle mellem prøveudtagning af lysstråler, som igen producerer interferensafhængige ændringer i amplitude i billedplanet (Murphy og Davidson, 2012d). Billedkontrast opstår derefter ikke kun fra virkningerne af interferens og diffraktion, men også på grund af tilstedeværelsen af ordnede molekylære arrangementer (Murphy og Davidson, 2012d). Det kan bruges til at studere form og dynamik for mange ordnede cellulære strukturer, herunder lipid-dobbeltlag af plasmamembraner (Bibi et al., 2011; Murphy og Davidson, 2012d). Billeder kan fås i enten monokrom eller farve. Denne teknik giver en alternativ metode til at visualisere liposomer, især for at bekræfte dannelsen af vesikler. Det giver ikke afgørende observationer vedrørende dobbeltlagskarakteristika eller lamellaritet af vesiklerne (Bibi et al., 2011). Derudover er polarisationsmikroskopi også begrænset af størrelsen på de vesikler, der kan visualiseres, med store vesikler i mikrometerområdet med den optimale klarhed. Denne teknik giver ikke klare billeder af partikler i nanometerområdet.
fluorescensmikroskopi
fluorescens eller “epifluorescens” mikroskopi er en speciel form for lysmikroskopi, der udnytter fluorokromernes evne til at udsende lys efter at være ophidset med lys med en bestemt bølgelængde (Murphy og Davidson, 2012b). Denne teknik bruges i vid udstrækning i biofysik til at give væsentlig information om strukturen og dynamikken i membrankomponenter (Bouvrais et al., 2010). I disse undersøgelser inkorporeres fluorescerende prober specifikt i den undersøgte membran, hvilket tillader visualisering af strukturen. Et stort udvalg af fluorescerende farvestoffer med forskellige kemiske og fotoniske egenskaber er kommercielt tilgængelige, catering til en række forskningsspørgsmål. For eksempel kan visse fluorescerende farvestoffer foretrække specifikke membranmiljøer, der udviser forskellige arrangementer og lateral pakning (Bouvrais et al., 2010). Som sådan tillader fluorescensmikroskopi potentialet til samtidig at anvende flere sonder i en prøve for at give information om selve membranstrukturen. De fluorescerende prober kan placeres i det vandige rum såvel som lipid-dobbeltlaget af liposomer (Bibi et al., 2011). Dette arrangement kan være særligt nyttigt, når man ser Guv ‘ er, hvor der kan fås information om formen, størrelsen og fluiditeten af lipidvesiklerne (Klymchenko et al., 2009; Bouvrais et al., 2010). Inkorporering af prober, såsom rhodaminmærkede lipider, direkte i lipid-dobbeltlaget kan også muliggøre visualisering af lamellariteten af liposomer (Bibi et al., 2011).
ulempen ved fluorescerende mikroskopi er, at tilsætningen af prober og farvestoffer til et membransystem potentielt kan forstyrre egenskaberne af det liposomale afgivelsessystem (Bouvrais et al., 2010; Bibi et al., 2011; Murphy og Davidson, 2012b). Imidlertid har brugen af lave farvestofkoncentrationer (Kur 1 mol%) vist sig at have minimal indflydelse på membranens fysiske egenskaber (Bouvrais et al., 2010). Det er også vigtigt at bemærke, at valget af fluorescerende farvestof er et kritisk trin, da nogle farvestoffer kan fremkalde store ændringer i værtsmembranen og/eller forårsage eksperimentelle artefakter, hvilket resulterer i unøjagtig datatolkning (Bouvrais et al., 2010). Derudover kan fotoinduceret lipid peroksidering også føre til domænedannelse selv i enkle farvestofsystemer. Denne proces kan resultere i dannelse af store flåder og spontan facetdannelse (Bouvrais et al., 2010). Langvarig eksponering for fluorescerende lys kan også resultere i blegning og tab af fluorescensintensitet. Derfor er valget af fluorescerende farvestof og udviklingen af nye membranprober vigtige overvejelser ved anvendelse af fluorescensmikroskopi (Klymchenko et al., 2009).
konfokal mikroskopi
konfokal scanningsmikroskopi har været et fremskridt inden for fluorescensmikroskopi. I stedet for at belyse hele prøven bygges et billede ved at scanne en (eller flere) fokuserede lysstråler over prøven. Lys, der vender tilbage fra den oplyste prøve, passerer gennem en blænde, der afviser lys uden for fokus ovenfra og under det interesserede plan; sikring af, at der kun opnås billeder fra en lille dybdeskarphed, hvilket forbedrer opløsningen uden for flyet (Bibi et al., 2011; Murphy og Davidson, 2012A). Ved hjælp af denne teknik indsamles en “å-stak” af billeder startende fra toppen af vesiklen efterfulgt af billeder taget i definerede å-trin til bunden af prøven, hvilket resulterer i et sammensat 3D-billede af prøven (Bibi et al., 2011; Murphy og Davidson, 2012A). Konfokal scanningsmikroskopi er blevet en mere attraktiv teknik i forhold til epifluorescerende lysmikroskoper på grund af dets overlegne billedklarhed. I tilfælde af Guv ‘ er er denne teknik i stand til at visualisere lipidsystemernes indre struktur, hvilket ofte ikke er muligt med andre mikroskopimetoder (Ruosi et al., 2011; Mertins og Dimova, 2013). For eksempel kan adskillelse af den vandige og lipid-dobbeltlagsfase tydeligt visualiseres i større vesikler (Mertiner og Dimova, 2013). Imidlertid er konfokal mikroskopi stadig diffraktionsbegrænset og derfor ikke i stand til at producere HD-billeder af SUV ‘ er eller oligolamellære liposomer., 2011).
elektronmikroskopi teknikker
elektronmikroskopi er en metode til visualisering af vesikler under meget høj forstørrelse (Henry, 2005). Det bruges i vid udstrækning til karakterisering af lipidvesikler som elektronbølgelængde (og dermed diffraktionsbegrænset opløsning), er mange størrelsesordener lavere end for optisk mikroskopi og giver derfor superopløsning til klar visualisering af små liposomer (Bibi et al., 2011; Pernille et al., 2011). Denne teknik bruger en stråle af elektroner fokuseret på overfladen af prøven af forskellige elektromagnetiske linser. Elektronerne spredes derefter af prøven og fokuseres derefter igen og forstørres af en yderligere række elektromagnetiske linser i billedkolonnen for at producere et projiceret billede (Henry, 2005). Der er en række forskellige typer elektronmikroskoper, der hver kræver en anden prøveforberedelsesmetode.
Scanningselektronmikroskopi (SEM)
Scanningselektronmikroskoper (SEMs) bruger en elektronstråle, der scannes over eller over en prøve (snarere end gennem en prøve) til at producere et forstørret billede af et objekt (Adler og Schiemann, 1985). Alder et al. først forsøgte at bruge SEM til at karakterisere liposomer i 1984 (Adler og Schiemann, 1985). De viste, at anvendelse af frysetørringsmetoden til fremstilling af liposomprøverne til sem resulterede i en stor del af synlige klumper og crusted materiale (Adler og Schiemann, 1985). Nyere undersøgelser har vist, at liposomstrukturen i sig selv kan lide forstyrrelser på grund af de høje vakuumbetingelser og farvningsprocesser, der kræves til denne præparationsteknik., 2011). SEM bruges nu ikke almindeligt til analyse af liposomer, fordi det kræver, at prøven tørres eller fastgøres inden billeddannelse., 2011). Sem kan imidlertid give generel information om den koncentriske struktur af de forskellige lipidlag samt give detaljer om størrelsen og sfærisk morfologi af et præparat (Nirale et al., 2009).
transmissionselektronmikroskopi (TEM)
transmissionselektronmikroskopi (TEM) er den hyppigst anvendte billeddannelsesmetode til evaluering af strukturen af nanopartikler (Henry, 2005; Kuntsche et al., 2011). Det involverer fremstilling af en tynd prøve (<100 nm tyk), der placeres i et vakuumkammer. Elektronstrålen krydser prøven, hvor den derefter fokuseres af objektivlinsen for at danne et billede. TEM kan let afbilde bløde stofprøver med en rumlig opløsning ned til godt under 1 nm i størrelse (Henry, 2005; Kuntsche et al., 2011; Pernille et al., 2011). Denne teknik kan yderligere kategoriseres baseret på den anvendte prøveforberedelsesmetode-især negativ farvning, frysebrud og kryogen TEM. Det kan give information om overflademodifikationer af nanopartikler, da det giver bedre kontrast og kontur af billeder end andre mikroskopiteknikker. For eksempel viste konjugering af transferrin til overfladen af DSPC/cholesterol liposomer en partikelformet overfladebelægning med negativ plet TEM, som var fraværende i de ukonjugerede liposompræparater (Anabousi et al., 2005). I et separat eksperiment blev specifikke antistoffer hævet mod humant transferrin tilsat før den negative pletprocedure for at bekræfte identiteten af den partikelformede overfladebelægning (Anabousi et al., 2005). Derfor giver TEM mulighed for at opnå meget forbedret opløsning ved vurdering af konjugationen af ligander til overfladen af liposomer.
negativ farvningsteknik
i negativ-plet TEM involverer prøveforberedelse en lille mængde hydreret prøve, der placeres på et gitter. Da vesiklerne er i direkte kontakt med gitteret, kan deres orientering og morfologi blive påvirket, og derfor bør dette tages i betragtning (Bibi et al., 2011). Det er også nødvendigt at indlejre liposomerne i et egnet elektrontæt materiale (f. eks., tungmetalsalte som uranylacetat eller phosphotungstic syre), der giver høj kontrast, så vesikler kan ses mod en mørkfarvet baggrund., 2011). Den negative farvningsteknik er relativt hurtig og enkel; det har imidlertid vist sig at forårsage ændringer i den oprindelige liposomstruktur og kan føre til oprettelse af lyse og mørke frynser, der kan forveksles med lamellære strukturer (Bibi et al., 2011; Pernille et al., 2011). Derudover kan Placering af prøven under vakuum forårsage yderligere dehydrering af prøven, hvilket igen kan forårsage ændringer i vesiklernes struktur (Bibi et al., 2011). Mens tem-teknikken med negativ plet kan give meget højere forstørrelse til billeddannelse af nanopartikler, gør skaden på liposomstrukturen det vanskeligt nøjagtigt at evaluere prøveens morfologiske egenskaber. Derfor kræves der generelt andre billeddannelsesteknikker for at bekræfte resultaterne.
Frysefrakturteknik
frysefrakturteknikken kræver ingen tørringsproces og kan give yderligere oplysninger om den indre struktur af nanopartikler (Kuntsche et al., 2011). Denne metode indebærer at placere en prøve på et TEM-gitter, der er klemt mellem to kobber-eller guldholdere (Severs, 2007). Prøven forglases via hurtig frysning, typisk med flydende propan eller flydende nitrogen, inden den brydes langs områder af prøven med svage molekylære interaktioner. Denne brudoverflade kan ætses yderligere og skygges med et tyndt platin-eller carbonlag for at tilvejebringe en “negativ” replika af brudprøveplanet (Severs, 2007; Kuntsche et al., 2011). Kopien rengøres derefter med et organisk opløsningsmiddel for at fjerne alle rester inden visualisering under et TEM-mikroskop. Da disse replikaer er så stabile, kan de opbevares og ses senere (Kuntsche et al., 2011). Den største fordel ved denne teknik er, at replikaerne nøje afspejler prøveens oprindelige tilstand og kan give detaljerede oplysninger om 3D-strukturen i vesiklerne og dobbeltlagsorganisationen (Bibi et al., 2011; Kuntsche et al., 2011). Disse oplysninger omfatter multilamellar konstruktion og dobbeltlag pakning af multilamellære vesikler. Denne teknik kan også vurdere aggregatstørrelse og kan være særlig nyttig til undersøgelse af interaktionen mellem kationiske liposomer og DNA (Bibi et al., 2011). Imidlertid kan artefakter stadig forekomme i prøven under tilberedning på grund af utilstrækkelig frysehastighed, genaflejring af opløsningsmiddelmolekyler og/eller mekanisk belastning (Severs, 2007; Kuntsche et al., 2011). For eksempel kan en “krusende effekt” forekomme på SUV ‘ erne i prøven (Bibi et al., 2011). Dette er en almindelig dobbeltlagsdeformation, der skyldes en lidelse i overgangene af acylkæderne før frysning. Inkubering af vesikler mellem præovergangen og den faktiske overgangstemperatur kan også forårsage krusninger (Bibi et al., 2011). Interessant nok kan dette bruges til at give information om lipidfaseovergange, der forekommer med den varierende natur af lipider, der anvendes til liposomale præparater (Bibi et al., 2011).
kryogen TEM
kryogen TEM (cryo-TEM) er en variation af TEM, hvor tynde vandige hydratiserede film, der er forglaset i flydende Ethan, anvendes inden billeddannelse. Denne teknik giver mulighed for analyse af liposomer i deres mest oprindelige tilstand og er et værdifuldt værktøj til at bestemme størrelsen, formen, den indre struktur og lamellariteten af liposomer., 2004; Bibi et al., 2011; Kuntsche et al., 2011). Den største fordel ved hurtigt frysning af liposomprøver er at minimere dannelsen af iskrystaller og bevare proteiner eller andre materialer (Bibi et al., 2011; Kuntsche et al., 2011). Dette er gavnligt, hvor proteiner eller DNA er indkapslet i nanopartiklerne., 2004; Kuntsche et al., 2011). Cryo-TEM er den mest nyttige form for mikroskopi, der i øjeblikket er tilgængelig til undersøgelse af liposomer, da det undgår problemer med kemisk fiksering, dehydrering, skæring og farvning – som alle kan påvirke morfologien af vesikler (Bibi et al., 2011). Opløsningsområdet er 5 til 500 nm, som defineret af filmens tykkelse (Almgren et al., 2000). Imidlertid skal der bemærkes flere begrænsninger med denne teknik, herunder det faktum, at kun et 2D-billede opnås fra 3D-objekter (hvilket generelt også gælder for de fleste af de andre mikroskopiteknikker). For at overvinde denne begrænsning er rekonstruktion af 3d-former fra et tilstrækkeligt stort antal 2D-billeder af tilfældigt orienterede ikke-sfæriske partikler mulig (Orlova et al., 1999), samt at se prøven i forskellige hældningsvinkler for at opnå information om 3D-form (Van Gilkey og Gilkey, 1994). Kryogen elektrontomografi (cryo-et) kan også bruges i stedet for at opnå 3d-billeder (Le Bihan et al., 2009). Cryo-TEM bruger også lavere doser elektroner, hvilket betyder, at det ofte har en lavere opløsning sammenlignet med andre metoder (Bibi et al., 2011; Kuntsche et al., 2011). Artefakter er stadig mulige på grund af dannelsen af en tynd film af amorf is og brugen af blotting på prøven, der anvender forskydningskræfter under filmdannelsen (Almgren et al., 2000; Bibi et al., 2011).
Miljøscanningselektronmikroskopi (ESEM)
miljøscanningselektronmikroskopi (ESEM) er et billeddannelsessystem, der ikke kræver brug af fastgørelse, farvning eller frysning af vesikler og kan tillade billeddannelse af dynamiske ændringer i våde systemer uden tidligere prøveforberedelse (Muscariello et al., 2005; Pernille et al., 2011). Hovedtræk ved ESEM er tilstedeværelsen af vanddamp i mikroskopkammeret. Evnen til at opretholde en vandholdig atmosfære omkring prøven, der kan være delvist eller endda fuldt hydreret, gøres mulig ved brug af et gradueret vakuumsystem med flere blænder, der gør det muligt at opretholde billedkammeret ved tryk op til 55 hPa (Bibi et al., 2011; Pernille et al., 2011). Den primære elektronstråle kan generere sekundære elektroner, der derefter støder på dampmolekyler, hvilket fører til en kaskadeforstærkning af signalet, inden de når detektoren. På grund af dette kræver ESEM ikke prøveforberedelse (Muscariello et al., 2005). Denne teknik muliggør variation i prøvemiljøet gennem en række tryk -, temperatur-og gassammensætninger (Mohammed et al., 2004), hvilket er nyttigt, når man bestemmer, hvordan miljøændringer påvirker vesiklerne. Dette gælder for nanofarmaceutiske formulerings-og stabilitetsundersøgelser (Bibi et al., 2011). ESEM er også blevet brugt til at analysere lægemiddelbelastning i dobbeltlaget af liposomer (Mohammed et al., 2004), samt bestemmelse af vesiklernes størrelse og form. En begrænsning af ESEM er, at den ikke kan give detaljerede oplysninger om lamellariteten og den interne arkitektur af nanoskalastrukturerne., 2011).
Atomic Force Microscopy (AFM)
Atomic force microscopy (AFM), også kendt som scanning-force microscopy (SFM), er en type scanning probe mikroskop teknik. Det virker ved at køre en skarp spids fastgjort til en cantilever og sensor over overfladen af en prøve og måle overfladekræfterne mellem sonden og prøven (Sitterberg et al., 2010). Når cantilever løber langs prøveoverfladen, bevæger den sig op og ned på grund af overfladefunktionerne, og cantilever afbøjes i overensstemmelse hermed. Denne afbøjning kvantificeres normalt ved hjælp af en optisk sensor, hvor laserstrålen reflekteres på bagsiden af udkrageren på lysdetektoren (Sitterberg et al., 2010). AFM behøver ikke at fungere i et vakuum og kan fungere i omgivende luft eller under væske; derfor bruges det i stigende grad til at afbilde biologiske prøver såvel som nanopartikler (Liang et al., 2004a, b; Ruos et al., 2005, 2009). AFM har enestående opløsning i størrelsesordenen fraktioner af et nanometer og kan give et 3D-billede af liposomer sammen med detaljer om morfologi, størrelsesfordeling, homogenitet og stabilitet (Liang et al., 2004a, b; Ruos et al., 2005, 2007, 2009). Det er vigtigt, at AFM kan bruges til at karakterisere overflademodifikationer af liposomer og detektere ligander (f.eks. antistoffer og polymerer) konjugeret ved den liposomale membranoverflade (Bendas et al., 1999; Moutardier et al., 2003; Anabousi et al., 2005; Liang et al., 2005). For eksempel Bendas et al. 8-10 nm i diameter, hvilket repræsenterede koblingen af IgG-antistoffer til liposomoverfladen (Bendas et al., 1999). Resultaterne viste, at effektiviteten af teknikken var meget afhængig af den anvendte konjugationsmetode, hvor antistoffer konjugeret direkte til liposomaloverfladen var synlige med AFM (begrænset proteinmobilitet) sammenlignet med antistoffer bundet til PEG-kæder. Det var antydende, at PEG-kæderne forårsagede høj proteinmobilitet og derfor ikke kunne scannes (Bendas et al., 1999). Omvendt viste Anabousi et al., at inkorporering af pegylerede lipider i liposomerne inducerede en sterisk stabilisering med liposomer, der opretholder en sfærisk form (Anabousi et al., 2005). AFM-billeder af overfladen af ukonjugerede liposomer var glatte, og der kunne ikke observeres nogen strukturer, hvorimod konjugering af transferrin til overfladen af pegylerede liposomer blev visualiseret som små kugleformede strukturer (Anabousi et al., 2005). Tilsvarende fremstillede Moutardier et al Liposomer med polymere kerner (LSP), der bestod af lægemidler indlæst i polymere partikler, der dannede kernen i lipidvesikler (Moutardier et al., 2003). Billeder taget ved hjælp af AFM viste tilstedeværelsen af et polymernetværk på den udvendige overflade, hvilket antydede, at den kollagenpolymerkerne udstrålede ud og dannede et overfladelag på LSP (Moutardier et al., 2003). Ud over overfladestrukturelle detaljer kan AFM give information om de mekaniske og kemiske egenskaber af en prøveoverflade gennem kraftmålinger., 2007). For eksempel Mao et al. brugte denne teknik til at vurdere liposomernes elasticitet og klæbende egenskaber (Mao et al., 2004). En begrænsning af AFM er behovet for, at nanopartikler adsorberes på støtteflader, såsom glimmer eller siliciumskiver. Adsorptionen af liposomer på et fast substrat har potentialet til at ændre vesiklernes størrelse og form og forårsage deres udfladning. (Rusi et al., 2007). Derudover kan den periodiske kontakt af sonderingsspidsen trække liposomerne, når den bevæger sig over vesiklerne i en prøve (Jass et al., 2000). På trods af dette er AFM stadig et nyttigt værktøj til evaluering af liposomer.
konklusion
der er en bred vifte af billeddannelsesteknikker til rådighed til evaluering af liposomernes morfologi, hvor hver har sine egne fordele og ulemper. Lysmikroskopi kan give generelle detaljer om størrelsen og formen af større vesikler og homogeniteten af en prøve på en relativt hurtig måde. Omvendt er TEM den mest almindeligt anvendte teknik til at undersøge morfologien af liposomer meget mere detaljeret; potentialet for strukturelle ændringer for hver TEM-undertype på grund af farvning og/eller udsættelse for vakuumforhold skal imidlertid tages i betragtning ved fortolkningen af resultaterne. ESEM er mest nyttigt ved bestemmelse af liposomale ændringer som reaktion på miljøet, mens AFM fremstår som en nyttig metode i den morfologiske analyse af nanopartikler og giver maksimal opløsning af liposomaloverfladen. Både AFM og TEM er i stand til at afbilde ligander konjugeret til overfladen af liposomer og give supplerende information om overflademodifikationer. Samlet set er valget af teknik afhængig af, hvilke morfologiske egenskaber og detaljeringsgrad der kræves. Derudover er det vigtigt at forstå de potentielle virkninger af prøveforberedelsesmetoden for hver billeddannelsesteknik i udvælgelsesprocessen.
Forfatterbidrag
udarbejdelse af manuskript: A-LR og SH. Revision af artiklen kritisk for vigtigt intellektuelt indhold: SH, PD, JF, AP, AM, DS og AV.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
forfatterne ønsker at takke Pharmacy Research Trust for at yde økonomisk støtte til vores forskning.
Adler, K., og Schiemann, J. (1985). Karakterisering af liposomer ved scanning elektronmikroskopi og fryse-fraktur teknik. Micron Microsc. Acta 16, 109-113. doi: 10.1016/0739-6260(85)90039-5
CrossRef Fuld tekst / Google Scholar
Almgren, M., Edvard, K. og Karlsson, G. (2000). Cryo transmissionselektronmikroskopi af liposomer og beslægtede strukturer. Kolloider Surfer. En Fysik. Eng. ASP. 174, 3–21. doi: 10.1016 / S0927-7757 (00) 00516-1
CrossRef Fuld tekst/Google Scholar
Anabousi, S., Laue, M., Lehr, C. M., Bakovsky, U., og Ehrhardt, C. (2005). Vurdering af transferrin modifikation af liposomer ved atomkraftmikroskopi og transmissionselektronmikroskopi. EUR. J. Pharm. Biofarm. 60, 295–303. doi: 10.1016 / j. ejpb.2004.12.009
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Bagatolli, L. A. (2009). Membraner og fluorescensmikroskopi. Anmeldelser i fluorescens 2007. Ny York, NY: Springer, 33-51. doi: 10.1007 / 978-0-387-88722-7_2
CrossRef Fuld tekst | Google Scholar
Bakker, I. A., Storm, G. M. C. (1994). Liposomer til behandling af infektioner. J. Drug Target. 2, 363–371. doi: 10.3109/10611869408996811
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
Bendas, G. (2001). Immunoliposomer: en lovende tilgang til målretning mod kræftbehandling. BioDrugs 15, 215-224. doi: 10.2165/00063030-200115040-00002
CrossRef fuldtekst / Google Scholar
Bendas, G., Krause, A., Bakovsky, U., Vogel, J. og Rothe, U. (1999). Målbarhed af nye immunoliposomer fremstillet ved en ny antistofkonjugeringsteknik. Int. J. Pharm. 181, 79–93. doi: 10.1016/S0378-5173(99)00002-2
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
Bibi, S., Kaur, R., Henriksen-Lacey, M., McNeil, S. E., lattmann, E., et al. (2011). Mikroskopi billeddannelse af liposomer: fra dækglas til miljømæssige SEM. Int. J. Pharm. 417, 138–150. doi: 10.1016 / j. ijpharm.2010.12.021
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Bouvrais, H., Pott, T., Bagatolli, L. A., Ipsen, J. H. og Meleard, P. (2010). Virkningen af membranforankrede fluorescerende prober på de mekaniske egenskaber af lipid dobbeltlag. Biochim. Biofys. Acta 1798, 1333-1337. doi: 10.1016 / j. bbamem.2010.03.026
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
Cullis, P. R., Chonn, A. og Semple, S. C. (1998). Interaktioner mellem liposomer og lipidbaserede bæresystemer med blodproteiner: forhold til clearingsadfærd in vivo. Adv. Drug Deliv. Åb 32, 3-17. doi: 10.1016/S0169-409h(97)00128-2
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
Ding, B. S., Ding, T., Shuvaev, V. V., Muro, S. og Musykantov, V. R. (2006). Avancerede lægemiddelafgivelsessystemer, der er målrettet mod det vaskulære endotel. Mol. Interv. 6, 98–112. doi: 10.1124 / mi.6.2.7
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Henry, C. R. (2005). Morfologi af understøttede nanopartikler. Prog. Surf. Sci. 80, 92–116. doi: 10.1016 / j. progsurf.2005.09.004
CrossRef Fuld tekst / Google Scholar
Hua, S. (2013). Målretningssteder for betændelse: intercellulært adhæsionsmolekyle-1 som et mål for nye inflammatoriske terapier. Front. Pharmacol. 4:127. doi: 10.3389 / fphar.2013.00127
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Hua, S., Marks, E., Schneider, J. J. og Keely, S. (2015). Fremskridt i orale nano-afgivelsessystemer til kolon målrettet lægemiddelafgivelse i inflammatorisk tarmsygdom: selektiv målretning mod syge versus sundt væv. Nanomedicin 11, 1117-1132. doi: 10.1016 / j. nano.2015.02.018
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Hua, S., og Vu, S. Y. (2013). Anvendelsen af lipidbaserede nanocarriers til målrettede smertebehandlinger. Front. Pharmacol. 4:143. doi: 10.3389 / fphar.2013.00143
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Ishida, T., Harashima, H. og Kivada, H. (2001). Interaktioner mellem liposomer og celler in vitro og in vivo: opsonins and receptors. Curr. Drug Metab. 2, 397–409. doi: 10.2174/1389200013338306
PubMed Abstract | CrossRef Full Text | Google Scholar
Jass, J., Tjarnhage, T., and Puu, G. (2000). From liposomes to supported, planar bilayer structures on hydrophilic and hydrophobic surfaces: an atomic force microscopy study. Biophys. J. 79, 3153–3163. doi: 10.1016/S0006-3495(00)76549-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Klymchenko, A. S., Oncul, S., Didier, P., Schaub, E., Bagatolli, L., Duportail, G., et al. (2009). Visualisering af lipiddomæner i gigantiske unilamellære vesikler ved hjælp af en miljøfølsom membranprobe baseret på 3-hydroksyflavon. Biochim. Biofys. Acta 1788, 495-499. doi: 10.1016 / j. bbamem.2008.10.019
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
Kuntsche, J., Horst, J. C. og Bunjes, H. (2011). Kryogen transmissionselektronmikroskopi (cryo-TEM) til undersøgelse af morfologien af kolloide lægemiddelafgivelsessystemer. Int. J. Pharm. 417, 120–137. doi: 10.1016 / j. ijpharm.2011.02.001
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Le Bihan, O., Bonnafous, P., Marak, L., Bickel, T., Trepout, S., Mornet, S., et al. (2009). Cryo-elektron tomografi af nanopartikel transmigration til liposom. J. Struct. Biol. 168, 419–425. doi: 10.1016 / j. jsb.2009.07.006
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Liang, K., Mao, G. og Ng, K. Y. (2004a). Mekaniske egenskaber og stabilitetsmåling af kolesterolholdigt liposom på glimmer ved atomkraftmikroskopi. J. Kolloid Grænseflade Sci. 278, 53–62.
PubMed abstrakt / Google Scholar
Liang, H., Mao, G., og Ng, K. Y. (2005). Effekt af kædelængder af PEO-PPO-PEO på lille unilamellar liposommorfologi og stabilitet: en AFM-undersøgelse. J. Kolloid Grænseflade Sci. 285, 360–372. doi: 10.1016 / j. jcis.2004.11.042
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Liang, K., Mao, G. og Simon Ng, K. Y. (2004b). Sondering små unilamellar EggPC vesikler på glimmer overflade ved atomic force mikroskopi. Kolloider Surfer. B Biointerfaces 34, 41-51.
PubMed abstrakt / Google Scholar
Mao, G., Liang, K. Y. S. (2004). Encyclopedia of nanovidenskab og nanoteknologi. Marcel Dekker.
Google Scholar
Mastrobattista, E., Koning, G. A. og Storm, G. (1999). Immunoliposomer til målrettet levering af antitumormedicin. Adv. Drug Deliv. Åb 40, 103-127. doi: 10.1016 / S0169-409h (99)00043-5
CrossRef fuldtekst | Google Scholar
Mertins, O., og Dimova, R. (2013). Indsigt i interaktionerne mellem chitosan og phospholipidvesikler. Del II: membranstivning og poredannelse. Langmuir 29, 14552-14559. doi: 10.1021 / la4032199
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Metselaar, J. M. Og Storm, G. (2005). Liposomer til behandling af inflammatoriske lidelser. Ekspert Opin. Drug Deliv. 2, 465–476. doi: 10.1517/17425247.2.3.465
PubMed abstrakt | CrossRef Fuld tekst | Google Scholar
Mohammed, A. R., veston, N., Coombes, A. G., Fitsgerald, M. og Perrie, Y. (2004). Liposomformulering af dårligt vandopløselige lægemidler: optimering af lægemiddelbelastning og ESEM-analyse af stabilitet. Int. J. Pharm. 285, 23–34. doi: 10.1016 / j. ijpharm.2004.07.010
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Moutardier, V., Tosini, F., Vlieghe, P., Cara, L., Delpero, J. R. og Clerc, T. (2003). Kolloidale anticancer lægemidler biotilgængelighed i oral administration modeller. Int. J. Pharm. 260, 23–38. doi: 10.1016 / S0378-5173(03)00231 –
PubMed abstrakt | CrossRef fuldtekst | Google Scholar
Murphy, D. B. Og Davidson, M. V. (2012A). Konfokal Laser Scanning Mikroskopi. Grundlæggende om lysmikroskopi og elektronisk billeddannelse, 2.udgave. Hoboken, NJ: John vil & Sønner, 265-305. doi: 10.1002 / 9781118382905. ch13
CrossRef Fuld tekst/Google Scholar
Murphy, D. B. Og Davidson, M. V. (2012b). Fluorescensmikroskopi. Grundlæggende om lysmikroskopi og elektronisk billeddannelse. Veinheim: John Viley & Sønner, 199-231. doi: 10.1002 / 9781118382905. ch11
CrossRef Fuld tekst / Google Scholar
Murphy, D. B. Og Davidson, M. V. (2012c). Grundlæggende om lysmikroskopi og elektronisk billeddannelse. Hoboken, NJ: John Viley & Sønner, 1-19. doi: 10.1002 / 9781118382905
CrossRef Fuld tekst/Google Scholar
Murphy, D. B. Og Davidson, M. V. (2012d). Polarisationsmikroskopi. Grundlæggende om lysmikroskopi og elektronisk billeddannelse. Hoboken, NJ: John Viley & Sønner, 153-171. doi: 10.1002 / 9781118382905. ch9
CrossRef fuldtekst/Google Scholar
Muscariello, L., Rosso, F., Marino, G., Giordano, A., Barbarisi, M., Cafiero, G., et al. (2005). En kritisk oversigt over ESEM-applikationer på det biologiske område. J. Cell. Physiol. 205, 328–334. doi: 10.1002 / jcp.20444
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Nallamothu, R., Træ, G. C., Pattillo, C. B., Scott, R. C., Kiani, M. F., Moore, B. M., et al. (2006). Et tumorvaskulatur målrettet liposomafgivelsessystem til combretastatin A4: design, karakterisering og in vitro evaluering. AAPS PharmSciTech 7: E32. doi: 10.1208 / pt070232
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Nirale, N. M., Vidhate, R. D. og Nagarsenker, ms (2009). Fluticasonpropionatliposomer til pulmonal levering. Indiske J. Pharm. Sci. 71, 709–711.
Google Scholar
Orlova, E. V., Sherman, M. B., Chiu, H., Smith, L. C. og Gotto, A. M. Jr. (1999). Three-dimensional structure of low density lipoproteins by electron cryomicroscopy. Proc. Natl. Acad. Sci. U.S.A. 96, 8420–8425. doi: 10.1073/pnas.96.15.8420
CrossRef Full Text | Google Scholar
Ruozi, B., Belletti, D., Tombesi, A., Tosi, G., Bondioli, L., Forni, F., et al. (2011). AFM, ESEM, TEM, and CLSM in liposomal characterization: a comparative study. Int. J. Nanomedicine 6, 557–563. doi: 10.2147/IJN.S14615
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruozi, B., Tosi, G., Forni, F., Fresta, M. Og Vandelli, M. A. (2005). Atomkraftmikroskopi og fotonkorrelationsspektroskopi: to teknikker til hurtig karakterisering af liposomer. EUR. J. Pharm. Sci. 25, 81–89. doi: 10.1016 / j. EJP ‘ er.2005.01.020
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Ruos, B., Tosi, G., Leo, E. og Vandelli, M. A. (2007). Anvendelse af atomkraftmikroskopi til at karakterisere liposomer som lægemiddel-og genbærere. Talanta 73, 12-22. doi: 10.1016 / j.talanta.2007.03.031
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Ruos, B., Tosi, G., Tonelli, M., Bondioli, L., Mucci, A., Forni, F., et al. (2009). AFM-faseafbildning af bløde hydratiserede prøver: et alsidigt værktøj til at gennemføre den kemisk-fysiske undersøgelse af liposomer. J. Liposomres. 19, 59-67. doi: 10.1080/08982100802584071
PubMed abstrakt | CrossRef fuldtekst/Google Scholar
savning, R. R. og Torchilin, V. P. (2012). Udfordringer i udviklingen af målrettet liposomal therapeutics. AAPS J. 14, 303-315. doi: 10.1208 / s12248-012-9330-0
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Senior, J. H. (1987). Skæbne og opførsel af liposomer in vivo: en gennemgang af kontrollerende faktorer. Crit. Pastor Ther. Lægemiddelbærer Syst. 3, 123–193.
PubMed abstrakt / Google Scholar
Sercombe, L., Veerati, T., Moheimani, F., S. Y., Sood, A. K. og Hua, S. (2015). Fremskridt og udfordringer ved liposomassisteret lægemiddelafgivelse. Front. Pharmacol. 6:286. doi: 10.3389 / fphar.2015.00286
CrossRef Full Text | Google Scholar
Severs, N. J. (2007). Freeze-fracture electron microscopy. Nat. Protoc. 2, 547–576. doi: 10.1038/nprot.2007.55
PubMed Abstract | CrossRef Full Text | Google Scholar
Sitterberg, J., Ozcetin, A., Ehrhardt, C., and Bakowsky, U. (2010). Utilising atomic force microscopy for the characterisation of nanoscale drug delivery systems. Eur. J. Pharm. Biopharm. 74, 2–13. doi: 10.1016/j.ejpb.2009.09.005
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
Torchilin, V. P. (1994). Immunoliposomer og pegylerede immunoliposomer: mulig anvendelse til målrettet levering af billeddannelsesmidler. Immunmetoder 4, 244-258. doi: 10.1006 / immu.1994.1027
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Van Antperpen, R., Og Gilkey, J. C. (1994). Kryo-elektronmikroskopi afslører human lipoproteinunderstruktur med lav densitet. J. Lipid Res. 35, 2223-2231.
PubMed Abstract | Google Scholar
Wang, X., Song, Y., Su, Y., Tian, Q., Li, B., Quan, J., et al. (2015). Are PEGylated liposomes better than conventional liposomes? A special case for vincristine. Drug Deliv. 29, 1–9. doi: 10.3109/10717544.2015.1027015
PubMed Abstract | CrossRef Full Text | Google Scholar
Weisman, S., Hirsch-Lerner, D., Barenholz, Y., and Talmon, Y. (2004). Nanostructure of cationic lipid-oligonucleotide complexes. Biophys. J. 87, 609–614. doi: 10.1529/biophysj.103.033480
PubMed abstrakt | CrossRef Fuld tekst/Google Scholar
Vilis, M. Og Forssen, E. (1998). Ligand-målrettede liposomer. Adv. Drug Deliv. Åb 29, 249-271. doi: 10.1016 / S0169-409h (97)00083-5
CrossRef fuldtekst | Google Scholar
Vahed, S., Salehi, R., Davaran, S. og Sharifi, S. (2017). Liposombaserede lægemiddelafgivelsessystemer i kræftceller. Mater. Sci. Eng. C Mater. Biol. Appl. 71, 1327–1341. doi: 10.1016 / j. msec.2016.11.073
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply