Halobetasol propionat salve
doseringsform: salve
medicinsk gennemgået af Drugs.com. sidst opdateret den 1. marts 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
Halobetasol propionat salve, 0,05% indeholder halobetasolpropionat, et syntetisk kortikosteroid til topisk dermatologisk brug. Kortikosteroiderne udgør en klasse af primært syntetiske steroider, der anvendes topisk som et antiinflammatorisk og antipruritisk middel.
kemisk halobetasolpropionat er 21-chlor-6-liter, 9-difluoro-11-liter, 17-dihydroksi-16-liter-methylpregna-1, 4-dien-3-20-Dion, 17-propionat, C25H31ClF2O5. Den har følgende strukturformel:
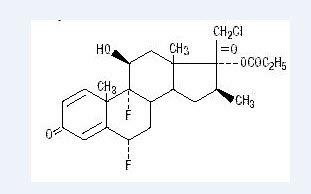
Halobetasolpropionat har molekylvægten på 485. Det er et hvidt krystallinsk pulver uopløseligt i vand.
hvert gram Halobetasolpropionatsalve indeholder 0.5 mg/g halobetasolpropionat i en base af aluminiumstearat, bivoks, pentaerythritolcoat, petrolatum, propylenglycol, sorbitanpropionat og stearylcitrat.
Halobetasol propionat salve – Klinisk Farmakologi
som andre topiske kortikosteroider har halobetasolpropionat antiinflammatoriske, antipruritiske og vasokonstriktive virkninger. Mekanismen for den antiinflammatoriske aktivitet af de topiske kortikosteroider er generelt uklar. Imidlertid antages kortikosteroider at virke ved induktion af phospholipase A2-hæmmende proteiner, samlet kaldet lipocortiner. Det postuleres, at disse proteiner styrer biosyntesen af potente mediatorer af inflammation, såsom prostaglandiner og leukotriener ved at hæmme frigivelsen af deres fælles forløber arachidonsyre. Arachidonsyre frigives fra membranphospholipider af phospholipase A2.
farmakokinetik
omfanget af perkutan absorption af topiske kortikosteroider bestemmes af mange faktorer, herunder køretøjet og integriteten af den epidermale barriere. Okklusive forbindinger med hydrocortison i op til 24 timer er ikke påvist at øge penetrationen; okklusion af hydrocortison i 96 timer forbedrer imidlertid penetrationen markant. Topiske kortikosteroider kan absorberes fra normal intakt hud. Betændelse og / eller andre sygdomsprocesser i huden kan øge perkutan absorption.
humane og dyreforsøg indikerer, at mindre end 6% af den påførte dosis halobetasolpropionat kommer ind i kredsløbet inden for 96 timer efter topisk administration af Halobetasolpropionatsalven.
undersøgelser udført med Halobetasolpropionatsalve indikerer, at det er i det superhøje styrkeområde sammenlignet med andre topiske kortikosteroider.
indikationer og anvendelse til Halobetasolpropionatsalve
Halobetasolpropionatsalve er en super-høj styrke kortikosteroid indikeret til lindring af de inflammatoriske og pruritiske manifestationer af kortikosteroid-responsive dermatoser. Behandling ud over to på hinanden følgende uger anbefales ikke, og den totale dosis bør ikke overstige 50 g/uge på grund af lægemidlets potentiale til at undertrykke hypothalamus-hypofyse-binyre (HPA) – aksen. Brug til børn under 12 år anbefales ikke.
som med andre stærkt aktive kortikosteroider, bør behandlingen seponeres, når kontrol er opnået. Hvis der ikke ses nogen forbedring inden for 2 uger, kan det være nødvendigt at revurdere diagnosen.
kontraindikationer
Halobetasol propionat salve er kontraindiceret hos de patienter med en historie med overfølsomhed over for nogen af præparatets komponenter.
forholdsregler
generelt
systemisk absorption af topiske kortikosteroider kan producere reversibel hypothalamus – hypofyse-binyre (HPA) – aksesuppression med potentiale for glukokortikosteroidinsufficiens efter seponering af behandlingen. Manifestationer af Cushings syndrom, hyperglykæmi og glukosuri kan også produceres hos nogle patienter ved systemisk absorption af topiske kortikosteroider under behandling.
patienter, der anvender et topisk steroid på et stort overfladeareal eller på områder under okklusion, skal evalueres periodisk for tegn på hPa-akseundertrykkelse. Dette kan gøres ved hjælp af ACTH stimulation, A. M. plasma cortisol, og urin fri-cortisol test. Patienter, der får super potente kortikosteroider, bør ikke behandles i mere end 2 uger ad gangen, og kun små områder bør behandles ad gangen på grund af den øgede risiko for hPa-suppression.
Halobetasol propionat salve produceret HPA akse undertrykkelse, når de anvendes i opdelte doser på 7 gram per dag i en uge hos patienter med psoriasis. Disse virkninger var reversible ved seponering af behandlingen.
Hvis hPa-akseundertrykkelse bemærkes, bør der gøres et forsøg på at trække lægemidlet tilbage, reducere applikationshyppigheden eller erstatte et mindre potent kortikosteroid. Genopretning af HPA-aksefunktionen er generelt hurtig ved seponering af topikale kortikosteroider. Sjældent kan der forekomme tegn og symptomer på glukokortikosteroidinsufficiens, der kræver supplerende systemiske kortikosteroider. For information om systemisk tilskud, se ordineringsoplysninger for disse produkter.
pædiatriske patienter kan være mere modtagelige for systemisk toksicitet fra ækvivalente doser på grund af deres større hudoverflade til kropsmasseforhold (se forholdsregler: pædiatrisk brug).
Hvis der opstår irritation, skal Halobetasolpropionatsalve seponeres, og passende behandling påbegyndes. Allergisk kontaktdermatitis med kortikosteroider diagnosticeres normalt ved at observere manglende helbredelse snarere end at bemærke en klinisk forværring som med de fleste topiske produkter, der ikke indeholder kortikosteroider. En sådan observation bør bekræftes med passende diagnostisk patch-test.
hvis der samtidig forekommer eller udvikles hudinfektioner, skal der anvendes et passende antifungalt eller antibakterielt middel. Hvis en gunstig reaktion ikke forekommer straks, skal brugen af Halobetasolpropionatsalve seponeres, indtil infektionen er blevet tilstrækkeligt kontrolleret.
Halobetasolpropionatsalve bør ikke anvendes til behandling af rosacea eller perioral dermatitis, og den bør ikke bruges i ansigtet, lysken eller i aksillerne.
Information til patienter
patienter, der bruger topiske kortikosteroider, skal modtage følgende oplysninger og instruktioner:
- medicinen skal bruges som anvist af lægen. Det er kun til ekstern brug. Undgå kontakt med øjnene.
- medicinen bør ikke anvendes til andre lidelser end den, som den blev ordineret til.
- det behandlede hudområde bør ikke bandages, på anden måde dækkes eller indpakkes, så det er okklusivt, medmindre lægen har instrueret det.
- patienter skal indberette tegn på lokale bivirkninger til deres læge.\
laboratorieundersøgelser
følgende tests kan være nyttige til evaluering af patienter til hPa-akseundertrykkelse: ACTH-stimuleringstest; A. M. plasma cortisol test; Urinfri cortisol test.
carcinogenese, mutagenese, nedsat fertilitet
Langtids dyreforsøg er ikke udført for at evaluere halobetasolpropionats karcinogene potentiale. Positive mutagenicitetseffekter blev observeret i to genotoksicitetsanalyser. Halobetasolpropionat var positivt i en mikronukleustest for kinesisk hamster og i en muselymfom-genmutationsanalyse in vitro.
studier med rotter efter oral administration ved dosisniveauer op til 50 mcg/kg / dag indikerede ingen forringelse af fertilitet eller generel reproduktionsevne.
i andre genotoksicitetstest blev halobetasolpropionat ikke fundet genotoksisk i Ames / Salmonella-analysen, i søsterkromatidudvekslingstesten i somatiske celler fra Den Kinesiske hamster, i kromosomafvigelsesundersøgelser af germinale og somatiske celler fra gnavere og i en pattedyrspottest til bestemmelse af punktmutationer.
graviditet
teratogene virkninger: graviditetskategori C
kortikosteroider har vist sig at være teratogene hos forsøgsdyr, når de administreres systemisk ved relativt lave doseringsniveauer. Nogle kortikosteroider har vist sig at være teratogene efter dermal påføring på forsøgsdyr.
Halobetasolpropionat har vist sig at være teratogent hos SPF-rotter og chinchilla-kaniner, når det gives systemisk under drægtighed i doser på 0,04 til 0,1 mg/kg hos rotter og 0,01 mg / kg hos kaniner. 13, 33 og 3 gange henholdsvis den humane topiske dosis af Halobetasolpropionatsalve. Halobetasolpropionat var embryotoksisk hos kaniner, men ikke hos rotter.der blev observeret ganespalte hos både rotter og kaniner. Omphalocele blev set hos rotter, men ikke hos kaniner.
der er ingen tilstrækkelige og velkontrollerede undersøgelser af det teratogene potentiale af halobetasolpropionat hos gravide kvinder. Halobetasol propionat salve bør kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret.
ammende mødre
systemisk administrerede kortikosteroider forekommer i modermælk og kan undertrykke vækst, forstyrre endogen kortikosteroidproduktion eller forårsage andre uheldige virkninger. Det vides ikke, om topisk administration af kortikosteroider kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Halobetasolpropionatsalve administreres til en ammende kvinde.
pædiatrisk anvendelse
sikkerhed og effektivitet af Halobetasolpropionatsalve hos pædiatriske patienter er ikke fastlagt, og anvendelse til pædiatriske patienter under 12 år anbefales ikke. På grund af et højere forhold mellem hudoverfladeareal og kropsmasse er pædiatriske patienter i større risiko end voksne for hPa-akseundertrykkelse og Cushings syndrom, når de behandles med topiske kortikosteroider. De har derfor også større risiko for binyreinsufficiens under eller efter seponering af behandlingen. Bivirkninger inklusive striae er rapporteret ved upassende brug af topikale kortikosteroider hos spædbørn og børn.
hPa-akseundertrykkelse, Cushings syndrom, lineær væksthæmning, forsinket vægtøgning og intrakraniel hypertension er rapporteret hos børn, der får topikale kortikosteroider. Manifestationer af binyrebarksuppression hos børn inkluderer lave plasmakortisolniveauer og fravær af respons på ACTH-stimulering. Manifestationer af intrakraniel hypertension inkluderer svulmende fontaneller, hovedpine og bilateralt papilledem.
geriatrisk anvendelse
af 850 patienter behandlet med Halobetasolpropionatsalve i kliniske studier var 21% 61 år og derover, og 6% var 71 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem disse patienter og yngre patienter; og anden rapporteret klinisk erfaring har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.
bivirkninger
i kontrollerede kliniske forsøg inkluderede de hyppigste bivirkninger, der blev rapporteret for Halobetasolpropionatsalve, stikkende eller brændende hos 1, 6% af patienterne. Mindre hyppigt rapporterede bivirkninger var pustulation, erytem, hudatrofi, leukoderma, acne, kløe, sekundær infektion, telangiektasi, urticaria, tør hud, miliaria, paræstesi og udslæt.
følgende yderligere lokale bivirkninger rapporteres sjældent med topikale kortikosteroider, og de kan forekomme hyppigere med kortikosteroider med høj styrke, såsom Halobetasolpropionatsalve. Disse reaktioner er anført i en omtrentlig faldende rækkefølge: folliculitis, hypertrichose, acneiform udbrud, hypopigmentering, perioral dermatitis, allergisk kontaktdermatitis, sekundær infektion, striae og miliaria.kontakt Teligent Pharma, Inc for at rapportere formodede bivirkninger. ved 1-856-697-1441 eller FDA ved 1-800-FDA-1088 eller anden verdenskrig.fda.gov / medur.
overdosering
topisk påført Halobetasolpropionatsalve kan absorberes i tilstrækkelige mængder til at producere systemiske virkninger (se forholdsregler)H
Halobetasolpropionatsalve Dosering og Administration
Påfør et tyndt lag Halobetasolpropionatsalve på den berørte hud en eller to gange dagligt, som anvist af din læge, og gnid forsigtigt og fuldstændigt ind.
Halobetasol propionat salve er en super-høj potens topisk kortikosteroid; derfor bør behandlingen begrænses til to uger, og mængder større end 50 g/uge bør ikke anvendes. Som med andre kortikosteroider bør behandlingen seponeres, når kontrol er opnået. Hvis der ikke ses nogen forbedring inden for 2 uger, kan det være nødvendigt at revurdere diagnosen.
Halobetasolpropionat salve bør ikke anvendes sammen med okklusive forbindinger.
hvordan leveres Halobetasol propionat salve
Halobetasol propionat salve, 0,05% leveres i følgende rørstørrelser:
50 g (NDC 63739-998-67)
opbevaring
Opbevar Halobetasolpropionatsalve mellem 15 liter C og 30 liter C (59 liter F og 86 liter F).
fremstillet af:
Teligent Pharma, Inc.
Buena, NJ 08310
distribueret af:
McKesson Corporation
dba Sky Packaging
4971 Southridge Blvd., Suite 101
Memphis, TN 38141
PI-073-00
C101430 Rev 02/2020
PAKKEETIKET.HOVEDDISPLAYPANEL 50 gram karton
NDC 63739-998-67
Halobetasolpropionat
salve, 0,05%
kun til topisk brug.
ikke til brug i øjnene.
Netto Vægt. 50 grams
Rx Only

| HALOBETASOL PROPIONATE Halobetasol Propionate Ointment |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – McKesson Corporation (140529962)
Registrant – Teligent Pharma, Inc. (011036910)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Teligent Pharma, Inc. | 011036910 | manufacture(63739-998) | |
Frequently asked questions
- Halobetasol vs. clobetasol – how do they compare?
- kan dette bruges til poison ivy?
- kan det bruges på hovedbunden?
mere om halobetasol topisk
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- lægemiddelinteraktioner
- Sammenlign alternativer
- prissætning & kuponer
- 25 anmeldelser
- stof klasse: topical steroids
Consumer resources
- Patient Information
- Halobetasol Topical application (Advanced Reading)
Professional resources
- Prescribing Information
- Halobetasol (FDA)
- Halobetasol Cream (FDA)
- Halobetasol Foam (FDA)
Other brands Ultravate, Lexette, Bryhali, Halonate
Related treatment guides
- Plaque Psoriasis
- Eczema
- Psoriasis
- Atopic Dermatitis
- Granuloma Annulare
- Dermatitis
Medical Disclaimer
Leave a Reply