Izom-összehúzódás

A gerinces állatok, háromféle izomszövetekben: csontváz, sima, meg a szív. A vázizom alkotja a test izomtömegének nagy részét, amely felelős a mozgásszervi aktivitásért. A simaizom az ereket, a gyomor-bél traktusokat, valamint a test más területeit képezi, amelyek tartós összehúzódásokat eredményeznek. A szívizom alkotja a szívet, amely vért pumpál. A vázizmokat és a szívizmokat csíkozott izomnak nevezik, mivel csíkos megjelenésük mikroszkóp alatt történik, ami a sávok és I sávok magasan szervezett váltakozó mintázatának köszönhető.

a reflexek kivételével az összes vázizom összehúzódása az agyból származó tudatos erőfeszítés eredményeként következik be. Az agy elektrokémiai jeleket küld az idegrendszeren keresztül a motoros neuronnak, amely több izomrostot innervál. Bizonyos reflexek esetén a kötési jel a gerincvelőből származhat a szürkeállomány visszacsatolási hurokján keresztül. Más cselekvések, mint például a mozgás, a légzés, a rágás, reflex aspektusúak számukra: a összehúzódások mind tudatosan, mind öntudatlanul kezdeményezhetők.
neuromuszkuláris csomópontszerkesztés

a neuromuszkuláris csomópont egy kémiai szinapszis, amelyet egy motoros neuron és egy izomrost közötti érintkezés képez. Ez az a hely, ahol a motoros neuron jelet továbbít egy izomrostnak, hogy izomösszehúzódást kezdeményezzen. Az események sorrendje, amely az izomrost depolarizációját eredményezi a neuromuszkuláris csomópontban, akkor kezdődik, amikor egy akciópotenciált kezdeményeznek egy motoros neuron sejttestében, amelyet azután sózási vezetéssel terjesztenek az axon mentén a neuromuszkuláris csomópont felé. Amint eléri a bouton terminált, az akciós potenciál Ca2+
ion beáramlást okoz a terminálba a feszültséggátos kalciumcsatornák útján. A Ca2+
beáramlása okozza a szinaptikus vezikulák, amely az acetilkolin neurotranszmitter, hogy biztosítékot a plazma membrán, felszabadító acetilkolin a szinaptikus hasadék között a motoros neuron terminál, valamint a neuromuszkuláris csomópont a harántcsíkolt izomrost. Az acetilkolin diffundál a szinapszisban, és kötődik és aktiválja a nikotinos acetilkolin receptorokat a neuromuszkuláris csomóponton. A nikotin receptor aktiválása megnyitja belső nátrium – / káliumcsatornáját, így a nátrium berohan, a kálium pedig kifolyik. Ennek eredményeként a sarcolemma megfordítja a polaritást, feszültsége gyorsan ugrik a-90mv nyugalmi membránpotenciálról +75mv-ra, amikor a nátrium belép. A membránpotenciál ezután hiperpolarizálódik, amikor a kálium kilép, majd visszaáll a nyugalmi membránpotenciálra. Ezt a gyors ingadozást a véglappotenciálnak nevezik a sarcolemma feszültséggátos ioncsatornáinak a véglemez mellett, amely a véglappotenciálra válaszul nyitva van. Nátrium – és káliumspecifikusak, és csak egyet engednek át. Ez az ionmozgási hullám megteremti az akciós potenciált, amely minden irányban elterjed a motor véglemezéről. Ha az akciós potenciál megáll, akkor az acetilkolin megszűnik a terminális boutonból. A szinaptikus hasadékban maradt acetilkolint vagy az aktív acetilkolin-észteráz lebontja, vagy a szinaptikus gomb újraabszorbeálja, és egyik sem marad a lebontott acetilkolin helyettesítésére.
gerjesztés-összehúzódás kapcsolásszerkesztés
gerjesztés-összehúzódás az a folyamat, amellyel az izomrostban lévő izomműködési potenciál a myofibrillák összehúzódását okozza. A vázizomban a gerjesztés-összehúzódás összekapcsolása a kulcsfontosságú fehérjék, a szarkoplazmatikus retikulum (SR) kalciumkibocsátó csatorna (ryanodine receptor, RyR) és a feszültséggátos L-típusú kalciumcsatornák (dihidropiridin receptorok, DHPRs) közvetlen összekapcsolására támaszkodik. A dhpr-k a sarcolemmán helyezkednek el (amely magában foglalja a felszíni sarcolemmát és a keresztirányú tubulusokat), míg a Ryrek az SR membránon keresztül helyezkednek el. A keresztirányú tubulus és a két, RyRs-t tartalmazó SR-régió szoros összekapcsolását triádként írják le, és túlnyomórészt ott történik a gerjesztés-összehúzódás összekapcsolása. A gerjesztés-összehúzódás akkor következik be, amikor a vázizomsejt depolarizációja izomműködési potenciált eredményez, amely a sejt felületén átterjed az izomrost t-tubulusok hálózatába, ezáltal depolarizálva az izomrost belső részét. A belső részek depolarizációja aktiválja a dihidropiridin receptorokat a terminális ciszternákban, amelyek a szomszédos szarkoplazmatikus retikulum ryanodin receptorainak közvetlen közelében vannak. Az aktivált dihidropiridin receptorok fizikailag kölcsönhatásba lépnek a ryanodin receptorokkal, hogy aktiválják őket lábfolyamatokkal (olyan konformációs változásokkal jár, amelyek alloszterikusan aktiválják a ryanodin receptorokat). Ahogy a ryanodin receptorok megnyílnak, a Ca2 +
felszabadul a szarkoplazmatikus retikulumból a helyi csomóponti térbe, és az ömlesztett citoplazmába diffundál, hogy kalcium szikrát okozzon. Megjegyezzük, hogy a szarkoplazmatikus retikulum nagy kalcium pufferelő képességgel rendelkezik, részben a calsequestrin nevű kalciumkötő fehérje miatt. A Közel szinkron aktiválása több ezer kalcium szikra által az akciós potenciál okoz sejtszintű növekedése a kalcium, ami a felfutás a kalcium átmeneti. A citoszolba kibocsátott Ca2+
az aktinszálakkal kötődik a troponin C-hez, hogy lehetővé tegye a keresztirányú kerékpározást, erőt és bizonyos helyzetekben mozgást. A sarco / endoplazmatikus retikulum kalcium-ATPáz (SERCA) aktívan pumpálja a Ca2+
– t a szarkoplazmatikus retikulumba. Mivel a Ca2+
visszahúzódik a nyugalmi szintre, az erő csökken, és fellazul.
Sliding filament theoreedit

div >
a csúszó izzószál elmélet leírja a folyamat által használt izmok szerződés. Ez egy ismétlődő események ciklusa, amely miatt egy vékony izzószál átcsúszik egy vastag izzószálon, és feszültséget okoz az izomban. Andrew Huxley és Rolf Niedergerke, valamint Hugh Huxley és Jean Hanson fejlesztette ki 1954-ben. Fiziológiailag ez a kontrakció nem egyenletes a sarcomere-n keresztül; a vastag szálak központi helyzete instabillá válik, és összehúzódás közben eltolódhat. A rugalmas fehérjék, például a titin hatása azonban feltételezhető, hogy egyenletes feszültséget tart fenn a sarcomere mentén, és a vastag izzószálat központi helyzetbe húzza.
Crossbridge cyclingEdit

Crossbridge kerékpározás sorozata molekuláris események alapját a csúszó végtelen elmélet. A kereszthíd egy myosin vetület, amely két myosin fejből áll, amelyek a vastag szálakból nyúlnak ki. Minden myosin fejnek két kötőhelye van: az egyik az ATP-hez, a másik az aktinhoz. Az ATP myosin fejhez való kötődése leválasztja a myosint az aktinról, ezáltal lehetővé téve a myosin kötődését egy másik aktin molekulához. Miután csatolták, az ATP-t a myosin hidrolizálja, amely a felszabadult energiát használja a “felhúzott helyzetbe” való belépéshez, ahol gyengén kötődik az aktin kötőhely egy részéhez. Az aktin kötőhely fennmaradó részét a tropomyosin blokkolja. Az ATP hidrolizálásával a felhúzott myosin fej most ADP + Pi-t tartalmaz. Két Ca2+
Ion kötődik a troponin C-hez az aktinszálakon. A troponin-Ca2+
komplex hatására a tropomiozin átcsúszik és feloldja az aktin kötőhely fennmaradó részét. A többi aktin kötőhely feloldása lehetővé teszi a két myosin fej bezárását, a myosin pedig erősen kötődik az aktinhoz. A myosin fej ezután felszabadítja a szervetlen foszfátot, és energiagörgetést kezdeményez, amely 2 pN erőt generál. Az áramütés az aktinszálat befelé mozgatja, ezáltal lerövidíti a sarcomere-t. A Myosin ezután felszabadítja az ADP-t, de továbbra is szorosan kötődik az aktinhoz. A power stroke végén az ADP felszabadul a myosin fejéből, így a myosin merev állapotban van az aktinhoz, amíg egy másik ATP nem kötődik a myosinhoz. Az ATP hiánya a hullamerevségre jellemző szigorú állapotot eredményezné. Amint egy másik ATP kötődik a myosinhoz, a myosin fej ismét leválik az aktinról, majd egy másik keresztirányú ciklus következik be.
A Crossbridge cycling mindaddig folytatható, amíg elegendő mennyiségű ATP és Ca2 +
van a citoplazmában. A crossbridge cycling megszüntetése akkor fordulhat elő, ha a Ca2+
– t aktívan pumpálják vissza a szarkoplazmatikus retikulumba. Ha a Ca2+
már nincs jelen a vékony szálon, a tropomiozin megváltoztatja a konformációt az előző állapotához, hogy ismét blokkolja a kötőhelyeket. A myosin megszűnik kötődni a vékony izzószálhoz, az izom ellazul. A Ca2 +
ionok elhagyják a troponin molekulát, hogy fenntartsák a Ca2 +
ion koncentrációt a szarkoplazmában. A Ca2+
ionok aktív pumpálása a szarkoplazmatikus retikulumba hiányosságot okoz a folyadékban a myofibrilek körül. Ez a Ca2+
ionok eltávolítását okozza a troponinból. Így a tropomiozin-troponin komplex ismét lefedi az aktinszálak kötőhelyeit, az összehúzódás megszűnik.
Fokozatosság harántcsíkolt izom contractionsEdit
Az erő harántcsíkolt izom-összehúzódások lehet nagyjából szét twitch, összegzése, illetve tetanusz. A twitch egy egyetlen összehúzódás és relaxációs ciklus által termelt cselekvési potenciál belül az izomrost is. A motoros ideg inger és a beidegzett izom későbbi összehúzódása közötti időt látens időszaknak nevezzük,amely általában körülbelül 10 ms-ot vesz igénybe, és az idegműködési potenciál terjedésének ideje, a kémiai átvitel ideje a neuromuszkuláris csomópontban, majd a gerjesztés-összehúzódás következő lépései.
Ha egy izomműködési potenciált az izomrángás teljes relaxációja előtt kell előállítani, akkor a következő twitch egyszerűen összegzi az előző twitch-et, ezáltal összegezve. Az összegzés kétféle módon érhető el: frekvencia összegzés és több szál összegzés. A frekvencia összegzésében a vázizom által kifejtett erőt az izomrostok cselekvési potenciáljának gyakoriságának változtatásával szabályozzák. Az akciópotenciálok nem érkeznek szinkronban az izmokhoz, összehúzódás során az izomrostok egy része bármikor tüzelni fog. Tipikus körülmények között, amikor az emberek olyan keményen gyakorolják az izmaikat, amennyire tudatosan képesek, az egyes izmokban lévő rostok nagyjából egyharmada egyszerre lángol, bár ezt az arányt különböző fiziológiai és pszichológiai tényezők befolyásolhatják (beleértve a Golgi ínszerveket és a Renshaw sejteket). Ez az “alacsony” összehúzódási szint egy védőmechanizmus, amely megakadályozza az ín elfordulását—az összes szál 95% – os összehúzódása által generált erő elegendő a test károsodásához. Több szálas összegzés esetén, ha a központi idegrendszer gyenge jelet küld az izom összehúzódásához, először a kisebb motoregységeket stimulálják, amelyek izgatottabbak, mint a nagyobbak. Ahogy a jel erőssége növekszik, a nagyobb motoregységek mellett több motoregység is izgatott, a legnagyobb motoregységekkel a kontraktilis szilárdság akár 50-szerese is lehet, mint a kisebbek. Ahogy egyre nagyobb motoregységek aktiválódnak, az izomösszehúzódás ereje fokozatosan erősebbé válik. A méret elve néven ismert koncepció lehetővé teszi, hogy a gyenge összehúzódás során az izomerő fokozódása kis lépésekben történjen, amelyek fokozatosan nagyobbak lesznek, ha nagyobb mennyiségű erőre van szükség.
végül, ha az izomaktivitási potenciálok gyakorisága növekszik úgy, hogy az izomösszehúzódás elérje csúcserejét és fennsíkjait ezen a szinten, akkor a összehúzódás tetanusz.
Hossz-feszültség kapcsolatszerkesztés

Hossz-feszültség kapcsolat az izometrikus összehúzódás erősségét az izom hosszához viszonyítja, amelynél a összehúzódás bekövetkezik. Az izmok a legnagyobb aktív feszültséggel működnek, ha közel állnak az ideális hosszhoz (gyakran pihenő hosszuk). Ha túlnyúlik vagy lerövidül (akár maga az izom, akár külső erő hatására), a maximális aktív feszültség csökken. Ez a csökkenés minimális a kis eltéréseknél, de a feszültség gyorsan csökken, mivel a hosszúság eltér az ideálistól. Az izomsejtekben (például a kitinben) és az extracelluláris mátrixban lévő rugalmas fehérjék jelenléte miatt, mivel az izom egy adott hosszúságon túl van nyújtva, teljesen passzív feszültség van, amely ellenzi a meghosszabbítást. Együtt kombinálva erős ellenállás van az aktív izom meghosszabbításával szemben, amely messze meghaladja az aktív feszültség csúcsát.
Erő-sebesség relationshipsEdit
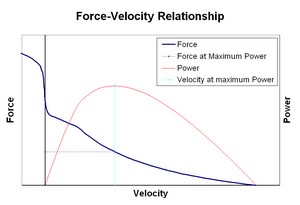
az erő-sebesség kapcsolat azt a sebességet érinti, amellyel az izom hosszát megváltoztatja (általában külső erők, például terhelés vagy más izmok szabályozzák) az általa generált erő mennyiségével. Az erő hiperbolikus módon csökken az izometrikus erőhöz képest, mivel a rövidülési sebesség növekszik, végül elérve a nullát valamilyen maximális sebességgel. A fordított igaz az izom megnyújtásakor-az erő az izometrikus maximum fölé emelkedik, amíg végül el nem éri az abszolút maximumot. Az aktív izomszövet ezen belső tulajdonsága szerepet játszik az ízületek aktív csillapításában, amelyeket egyidejűleg aktív ellentétes izmok működtetnek. Ilyen esetekben az erő-sebesség profil növeli a hosszabbító izom által termelt erőt a rövidítő izom rovására. Ez előnyben bármelyik izom visszatér a közös egyensúly hatékonyan növeli a csillapítás a közös. Ezenkívül a csillapítás ereje izomerővel nő. A motorrendszer így aktívan vezérelheti az ízületi csillapítást az ellentétes izomcsoportok egyidejű összehúzódásával (együttes összehúzódásával).
simaizom
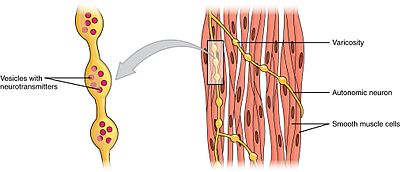
a simaizmok két alcsoportra oszthatók: egyegységre (egységes) és több egységre. Az egy egységnyi simaizomsejtek megtalálhatók a bélben és az erekben. Mivel ezeket a sejteket gap csomópontok kötik össze, syncytiumként képesek összehúzódni. Az egy egységnyi simaizomsejtek myogenikusan összehúzódnak, amelyet az autonóm idegrendszer modulálhat.
az egy egységnyi simaizomsejtektől eltérően a több egységnyi simaizomsejtek a szem izomzatában és a szőrtüszők alapjában találhatók. A több egységnyi simaizomsejtek összehúzódnak azáltal, hogy az autonóm idegrendszer idegei külön stimulálják őket. Így lehetővé teszik a finom kontrollt és a fokozatos válaszokat, hasonlóan a vázizomzat motoros egységeinek toborzásához.
Mechanizmusok simaizom contractionEdit
A kontraktilis tevékenység a simaizom sejtek is befolyásolja, több bemenet például a spontán elektromos aktivitás, idegi, hormonális bemenet, helyi változások kémiai összetétele, valamint a szakaszon. Ez ellentétben áll a vázizomsejtek kontraktilis aktivitásával, amely egyetlen idegi bemenetre támaszkodik. A simaizomsejtek bizonyos típusai spontán módon képesek saját akciós potenciáljukat generálni, amelyek általában pacemaker-potenciál vagy lassú hullámpotenciál után következnek be. Ezeket az akciós potenciált az extracelluláris Ca2+
beáramlása generálja, nem pedig Na+
. A vázizmokhoz hasonlóan a simaizomsejtekben a citoszolos Ca2+
ionok is szükségesek a keresztirányú kerékpározáshoz.
a simaizomsejtekben a cytosolic Ca2+
két forrása a kalciumcsatornákon keresztül belépő extracelluláris Ca2 +
és a szarkoplazmatikus retikulumból felszabaduló Ca2+
ionok. A cytosolic Ca2+
emelkedése több Ca2 +
kötődést eredményez a calmodulinhoz, amely ezután megköti és aktiválja a myosin fénylánc kinázt. A kalcium-kalmodulin-miozin fény-lánc kináz komplex phosphorylates miozin a 20 kilodalton (kDa) miozin könnyű láncok aminosav maradékanyag-szerin 19, kezdeményező megbetegedés, illetve aktiválása a miozin Atpáz. A vázizomsejtekkel ellentétben a simaizomsejtekben hiányzik a troponin, annak ellenére, hogy a vékony szálú tropomyosin fehérjét és más jelentős fehérjéket – a caldesmont és a calponint-tartalmazzák. Így sima izom összehúzódások által kezdeményezett, a Ca2+
-aktív foszforiláció a miozin inkább, mint a Ca2+
kötés az ultrahangot összetett, hogy szabályozza a miozin kötelező oldalak viselkednek, mint a csontváz, valamint a szív izmait.
Megszűnése crossbridge kerékpározás (majd elhagyta az izom zár-állam) akkor fordul elő, amikor miozin könnyű lánc foszfatáz eltávolítja a foszfát-csoportok a miozin fejek. A 20 kDa myosin fénylánc foszforilációja jól korrelál a simaizom rövidülési sebességével. Ebben az időszakban, van egy gyors tört az energiafelhasználás által mért oxigénfogyasztás. Pár percen belül a beavatás, a kalcium-szintje jelentősen csökken, a 20 kDa miozin könnyű láncok’ foszforiláció csökken az energia felhasználás csökkentése; azonban erő, a tonikot sima izom megmarad. Az izomösszehúzódás során az aktivált aktin és a foszforilált miozin között gyors ciklikus crossbridgerek alakulnak ki, amelyek erőt generálnak. Feltételezhető, hogy az erő fenntartása a lassan keringő és erőt fenntartó “reteszhidakból” ered. Úgy gondolják, hogy számos kináz, mint például a rho kináz, A DAPK3 és a protein kináz C részt vesz a kontrakció tartós fázisában, és a Ca2+
fluxus jelentős lehet.
Neuromodulációszerkesztés
bár a simaizom-összehúzódások myogének, összehúzódásuk sebességét és erősségét az autonóm idegrendszer modulálhatja. A paraszimpatikus idegrendszer postganglionos idegrostjai felszabadítják az acetilkolin neurotranszmitterét, amely a muszkarin acetilkolin receptorokhoz (machr-ekhez) kötődik a simaizomsejteken. Ezek a receptorok metabotróp vagy G-proteinhez kapcsolt receptorok, amelyek egy második hírvivő kaszkádot kezdeményeznek. Ezzel szemben a szimpatikus idegrendszer posztganglionos idegrostjai felszabadítják a neurotranszmittereket, az epinefrint és a norepinefrint, amelyek szintén metabotróp adrenerg receptorokhoz kötődnek. A simaizomra gyakorolt pontos hatások az aktivált receptor sajátosságaitól függenek—mind a paraszimpatikus bemenet, mind a szimpatikus bemenet lehet excitáló (kontraktilis) vagy gátló (pihentető).
Szív muscleEdit

két típusú szívizom sejtek: autorhythmic, valamint kontraktilis. Az autoritmikus sejtek nem összehúzódnak, hanem beállítják a kontrakció ütemét más szívizomsejtek számára, amelyeket az autonóm idegrendszer modulálhat. Ezzel szemben a kontraktilis izomsejtek (cardiomyocyták) alkotják a szívizom többségét, és képesek összehúzódni.
gerjesztés-összehúzódás kapcsolásszerkesztés
mind a csontváz, mind a szívizom gerjesztés-összehúzódás (E-C) kapcsolás, depolarizáció vezetési és Ca2+ felszabadulási folyamatok fordulnak elő. Azonban, bár az érintett fehérjék hasonlóak, szerkezetükben és szabályozásukban különböznek egymástól. A dihidropiridin receptorokat (DHPRs) különböző gének kódolják, a ryanodine receptorok (RyRs) pedig különálló izoformák. Különben is, DHPR kapcsolattartás RyR1 (fő RyR izoforma a harántcsíkolt izom) szabályozza Ca2+ kiadja a harántcsíkolt izom, míg az L-típusú kalcium-csatorna (DHPR a szív myocytes), valamint a RyR2 (fő RyR izoforma a szívizom) nem fizikailag összekapcsolva a szívizom, de szembe egymással egy junctional csatlakozó.
a vázizomzattól eltérően a szívizomban az E-C kapcsolódás elsősorban a kalcium által indukált kalcium felszabadulásnak nevezett mechanizmustól függ, amely a T-tubulus és a szarkoplazmatikus retikulum közötti csomóponti struktúrán alapul. A Junctophilin-2 (JPH2) elengedhetetlen ennek a szerkezetnek a fenntartásához, valamint a T-tubulus integritásához. Egy másik fehérje, receptor kiegészítő protein 5 (REEP5), a junctional SR normál morfológiájának megőrzésére szolgál. a csomópontok összekapcsolásának hibái a két fehérje hiányosságaiból eredhetnek. A kalcium által indukált kalcium felszabadulás folyamata során a RyR2s-t egy kalcium-trigger aktiválja, amelyet a Ca2+ áramlása okoz az L-típusú kalciumcsatornákon keresztül. Ezt követően a szívizom inkább diadal (vagy dyad) struktúrákat mutat, mint triádokat.
a Gerjesztő-összehúzódás kapcsolatot a szívizom sejtek akkor fordul elő, amikor egy cselekvési potenciál által kezdeményezett pacemaker sejtek a sinoatrialis csomópont vagy pitvar-kamrai csomópont, illetve elvégezni, hogy minden sejt a szív keresztül gap csomópontok. Az akciós potenciál halad a felszíni membrán a T-tubulusok (az utóbbiak nem minden szív-cella típusok), illetve a depolarisation okoz extracelluláris Ca2+
adja meg a cella keresztül L-típusú kalcium-csatorna, esetleg nátrium-kalcium-exchanger (NCX) során a korai része a platófázisban. Bár ez a Ca2 + beáramlás csak az aktiváláshoz szükséges Ca2+ körülbelül 10% – át teszi ki, viszonylag nagyobb, mint a vázizomé. Ez a Ca2+
beáramlás az intracelluláris Ca2 +
Kis Helyi növekedését okozza. Az intracelluláris Ca2+
növekedését a ryr2 detektálja a szarkoplazmatikus retikulum membránjában, amely pozitív visszacsatolási fiziológiai válaszban Ca2+
– ot szabadít fel. Ezt a pozitív visszacsatolást kalcium által indukált kalcium felszabadulásnak nevezik, és kalciumszikrákhoz (Ca2+
sparks) vezet. A ~30 000 Ca2+
sparks térbeli és időbeli összegzése a citoplazmatikus kalciumkoncentráció sejtszintű növekedését eredményezi. A sejtmembránon és a szarkoplazmatikus retikulumon keresztül történő kalciumáramlást követően a citoszolos kalcium növekedését a kalcium pufferek mérséklik, amelyek az intracelluláris kalcium nagy részét kötik össze. Ennek eredményeként a teljes kalcium nagy növekedése a szabad Ca2+
viszonylag kis emelkedéséhez vezet.
A citoplazmatikus kalcium kötődik Ultrahangot C, mozog a tropomyosin komplex le az aktin kötés helyén, amely lehetővé teszi, hogy a miozin fej kötődik az aktin végtelen. Ettől a ponttól kezdve a kontraktilis mechanizmus lényegében ugyanaz, mint a vázizom (fent). Röviden, ATP hidrolízissel, a myosin fej húzza az aktinszálat a sarcomere középpontja felé.

a Következő systole, intracelluláris kalcium veszik fel a sarco/leggyakoribb típusa Atpáz (SERCA) szivattyú vissza a sarcoplasmic retikulum készen áll a következő ciklus kezdődik. A kalciumot a sejtből elsősorban a nátrium-kalcium hőcserélő (NCX) és kisebb mértékben a plazmamembrán kalcium-ATPáz adja ki. Néhány kalciumot a mitokondriumok is felvesznek. Egy enzim, a foszfolamban fékként szolgál a SERCA számára. Alacsony pulzusszám mellett a foszfolamban aktív és lelassítja az ATPáz aktivitását, így a Ca2+
– nak nem kell teljesen elhagynia a sejtet. Magas pulzusszám esetén a foszfolamánt foszforilálják és deaktiválják, így a legtöbb Ca2+
– t a citoplazmából visszaviszik a szarkoplazmatikus retikulumba. A kalcium pufferek ismét mérsékelték a Ca2+
koncentráció csökkenését, ami lehetővé teszi a szabad Ca2+
koncentráció viszonylag kis csökkenését a teljes kalcium nagy változására adott válaszként. A csökkenő Ca2+
koncentráció lehetővé teszi a troponin komplex elválasztását az aktin izzószálból, ezáltal véget vetve a összehúzódásnak. A szív ellazul, lehetővé téve, hogy a kamrák vérrel töltsék fel a szívciklust.
Leave a Reply