4.4:의 특성을 공유 결합
전기 음성 및 채권극
지만 우리는 우리 정의 공유결합 결합으로 전자의 공유,전자에서는 공유결합하지 않은 항상 동일하게 공유에 의해 두 개의 접착 원자를 함유하고 있습니다. 지 않는 한 본드로 연결하는 두 개의 원자들의 요소로서,H2,항상 있을 것입니다 하나의 원자는 매력 전자는 채권에 더욱 강하게 다른 것보다는 원자로,HCl,그림\(\PageIndex{1}\). 전자의 균등 한 공유를 갖는 공유 결합(그림\(\PageIndex{1a}\))을 비극성 공유 결합이라고합니다. 그림\(\PageIndex{1b}\)에서와 같이 전자의 불평등 한 공유를 갖는 공유 결합을 극성 공유 결합이라고합니다.

그림\(\PageIndex{1}\)극성 대 비극성 공유 결합. (a)공유 결합 내의 전자는 두 수소 원자에 의해 동등하게 공유된다. 이것은 비극성 공유 결합입니다. (b)염소 원자는 수소 원자가하는 것보다 결합 내의 전자를 끌어 당겨 전자 분포의 불균형을 초래한다. 이것은 극 공유 결합입니다.
극성 결합에서 전자 밀도의 분포는 불균일하다. 그것은 전자를 다른 것보다 더 끌어 당기는 원자 주위에서 더 크다. 예를 들어,염화수소 분자의 H–Cl 결합에있는 전자는 수소 원자 근처보다 염소 원자 근처에서 더 많은 시간을 보낸다. 참고는 회색 영역을 주위 Cl 그림\(\PageIndex{1b}\)은 것 보다 훨씬 더 큰 그것은 주위 H.
이러한 불균형 전자 밀도에서 결과에서 축적한 부분 부정적인 요금(로 지정되어 있 δ−)한쪽의 채권(Cl)및 그 부분 긍정적인 비용(지정 δ+)다른 측면에서의 채권(H). 이것은 그림\(\PageIndex{2a}\)에서 볼 수 있습니다. 극성 공유 결합에서 전하의 분리는 그림\(\PageIndex{2b}\)의 화살표로 표시되는 전기 쌍극자(두 극)를 초래합니다. 화살표의+꼬리는 결합의 δ+끝을 나타내는 반면 화살표의 방향은 δ−끝을 향하게된다.
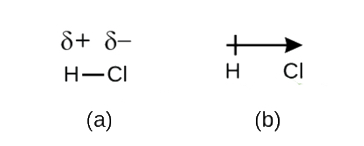
그\(\PageIndex{2}\):(a)불평등의 공유를 결합 한 쌍의 전자 사이 H Cl 지도를 긍정적 인 부분에서 무료 H 원자 및 부분에 부정적인 요금을 Cl. 기호 δ+및 δ-H-Cl 결합의 극성을 나타냅니다. 쌍극자는 꼬리에 십자가가있는 화살표로 표시됩니다. 십자가는 δ+끝 근처에 있고 화살촉은 δ–와 일치합니다.
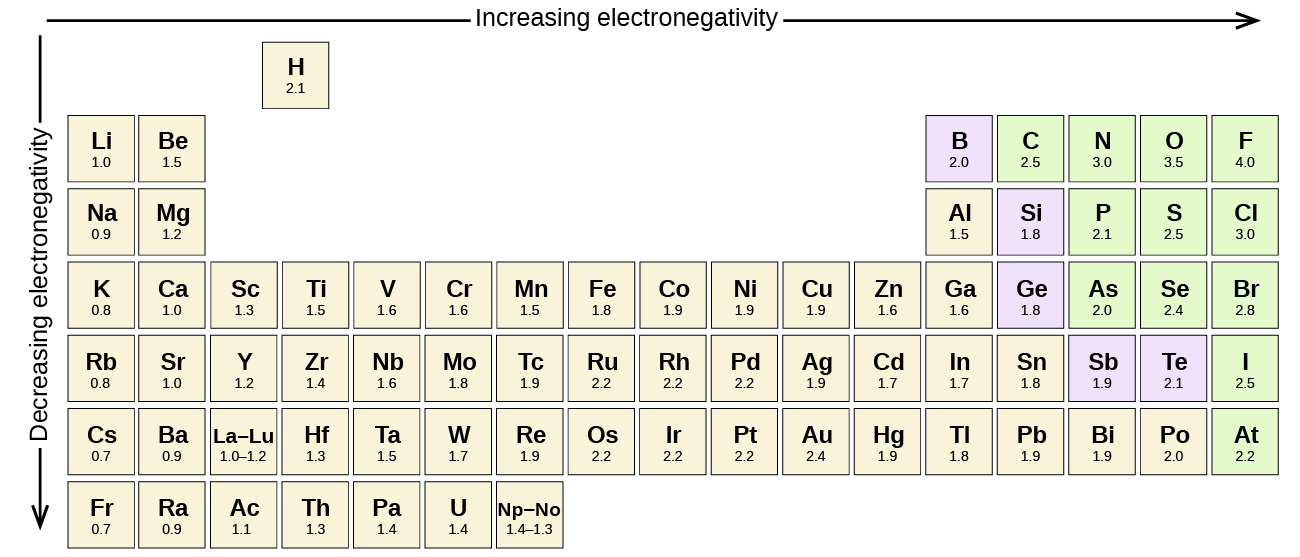
어떤 공유결합 원자 사이의 다른 요소는 북극곰이 채권지만,의 분위기 극성에 따라 크게 다릅니다. 다른 요소들 사이의 일부 결합은 최소한 극성이지만 다른 요소는 강하게 극성입니다. 이온 결합은 전자가 공유되기보다는 전달되는 극성의 궁극적 인 것으로 간주 될 수 있습니다. 을 판단하는 상대 극성의 공유결합,화학자를 사용하여 전기 음성하는 상대의 측정 방법을 강력하게 원자를 끌 전자 할 때 그것을 형태로 공유결합니다. 전자 음성도를 평가하기위한 다양한 수치 척도가 있습니다. 그림\(\PageIndex{3}\)는 가장 인기있는 것 중 하나 인 폴링 스케일을 보여줍니다.
자세히 보기: Linus pauling 박사
틀림없이 가장 영향력 있는 화학자는 20 세기,linus pauling 박사(1901-94)은 사람을 두 개별(즉,공유되지 않)노벨 상품입니다. 1930 년대에 폴링이 사용되는 새로운 수학적 이론들을 담아서 어떤 기본 원리의 화학적 결합. 그의 1939 년 책 화학 결합의 본질은 지금까지 화학에서 출판 된 가장 중요한 책 중 하나입니다.
1935,폴링 관심을 설정하는 분자 생물학적,그리고 그는 수상했다 1954 년 노벨 화학상을 위해 자신의 작업에 단백질 구조입니다. (그는 매우 가까운을 발견하고 이중 나선 DNA 의 구조의 경우 제임스 왓슨과 제임스 크릭 발표 자신의 발견 그 구조에서 1953.)그는 나중에 핵무기 실험을 금지하려는 노력으로 1962 년 노벨 평화상을 수상했습니다.

Linus Pauling 은 20 세기의 가장 영향력있는 화학자 중 하나였습니다.
그의 말년에 Pauling 은 많은 양의 비타민 C 가 일반적인 감기를 포함하여 질병을 예방할 것이라고 확신하게되었습니다. 대부분의 임상 연구는 연결을 보여주지 못했지만 폴링은 매일 큰 용량을 계속 복용했습니다. 그는 평생을 평등 할 과학적 유산을 수립하는 데 소비 한 1994 년에 사망했습니다.
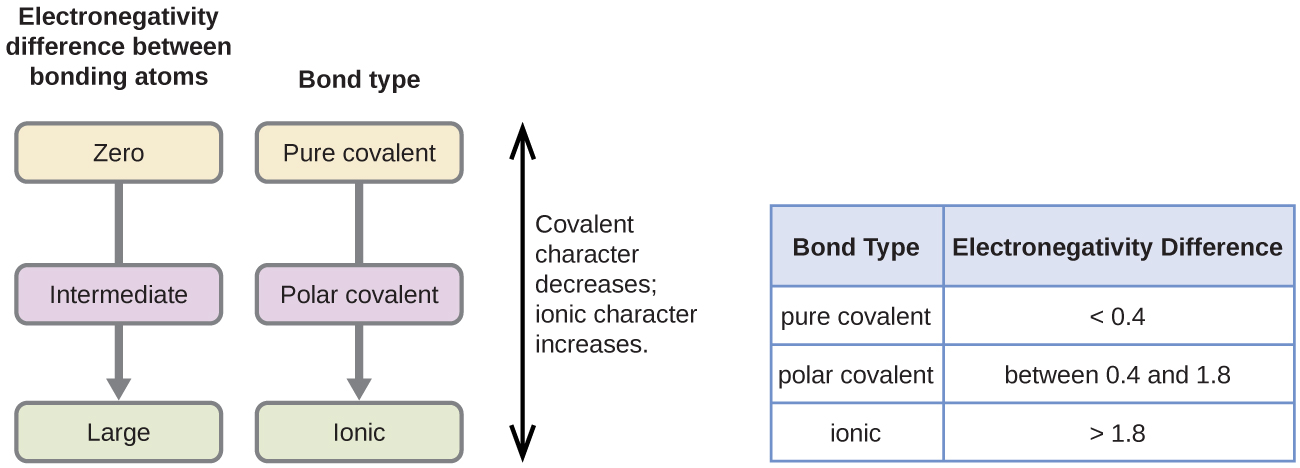
공유 결합의 극성은 결합을 만드는 두 원자의 electronegativities 의 차이를 결정함으로써 판단 할 수있다. Electronegativities 의 차이가 클수록 결합에서 전자 공유의 불균형이 커집니다. 단단하고 빠른 규칙은 없지만 전자 성의 차이가 약 0 보다 작은 경우 일반적인 규칙입니다.4,결합은 비극성으로 간주됩니다;차이가 0.4 보다 크면 결합은 극성으로 간주됩니다. 는 경우에는 차이 electronegativities 충분히 큰(일반적으로 보다 큰 약 1.8)결과물로 간주 이오니아보다는 공유결합. 물론 0 의 전자 음성 차이는 비극성 공유 결합을 나타냅니다.
예\(\PageIndex{1}\)
설명하 전기 음성 차이의 각 쌍의 원자와 결과 polarity(또는 채권 타입)으로 구성되어 있습니다.
- C H
- H and H
- Na 및 Cl
- O H
솔루션
- 탄소는 전기 음성 2.5 하는 동안,가치에 대한 수소 2.1. 그 차이는 0.4 이며,이는 다소 작습니다. 따라서 C-H 결합은 비극성으로 간주됩니다.
- 두 수소 원자는 동일한 전자 음성 값—2.1 을 갖는다. 차이는 0 이므로 결합은 비극성입니다.
- 나트륨의 전자 음성도는 0.9 인 반면 염소는 3.0 이다. 그 차이는 2.1 이며,이는 다소 높기 때문에 나트륨과 염소가 이온 성 화합물을 형성합니다.
- 수소의 경우 2.1 이고 산소의 경우 3.5 인 경우 전자 음성 차이는 1.4 입니다. 우리는 매우 극성의 결합을 기대할 것입니다. O 와 H 사이의 전자의 공유는 o 쪽으로 더 강하게 끌어 당겨지는 전자와 불평등하다.
운동\(\PageIndex{1}\)
설명하 전기 음성(KO)사이의 차이 각 쌍의 원자와 결과 polarity(또는 채권 타입)으로 구성되어 있습니다.
- C 및 O
- K 및 Br
- N 및 N
- Cs 및 F
답변 a:
EN 차이는 1.0 이므로 극성입니다. C 와 O 사이의 전자의 공유는 o 를 향해 더 강하게 끌어 당겨지는 전자와 불평등하다.
대답 b:
EN 차이는 1.8 보다 크므로 이온 성이다.
답변 c:
동일한 원자는 0EN 차이를 가지므로 비극성입니다.
답변 d:
EN 차이는 1.8 보다 크므로 이온 성입니다.
Leave a Reply