Muskelkontraksjon

hos virveldyr er det tre typer muskelvev: skjelett, Glatt og hjerte. Skjelettmuskulatur utgjør størstedelen av muskelmassen i kroppen og er ansvarlig for lokomotorisk aktivitet. Glatt muskel danner blodkar, mage-tarmkanalen og andre områder i kroppen som produserer vedvarende sammentrekninger. Hjerte muskel utgjør hjertet, som pumper blod. Skjelett-og hjerte muskler kalles striated muskel på grunn av deres stripete utseende under et mikroskop, noe som skyldes det svært organiserte vekslende mønsteret Av et band og jeg band.
Skjelettmusklerediger
 Organisering av skjelettmuskulatur
Organisering av skjelettmuskulaturUnntatt reflekser, oppstår alle skjelettmuskulaturkontraksjoner som følge av bevisst innsats som oppstår i hjernen. Hjernen sender elektrokjemiske signaler gjennom nervesystemet til motorneuronen som innerverer flere muskelfibre. I tilfelle av noen reflekser, signalet til kontrakt kan stamme i ryggmargen gjennom en feedback loop med grå materie. Andre handlinger som bevegelse, pust og tygge har et refleksaspekt for dem: sammentrekningene kan initieres både bevisst eller ubevisst.
Nevromuskulær veikryssrediger

Struktur av nevromuskulær veikryss.et nevromuskulært veikryss er en kjemisk synaps dannet av kontakten mellom en motor neuron og en muskel fiber. Det er stedet der en motor neuron overfører et signal til en muskel fiber for å initiere muskelkontraksjon. Sekvensen av hendelser som resulterer i depolarisering av muskelfiberen ved det nevromuskulære krysset begynner når et handlingspotensial initieres i cellekroppen til en motorneuron, som deretter forplantes ved saltatorisk ledning langs sin akson mot det nevromuskulære krysset. Når den når terminalen bouton, forårsaker aksjonspotensialet En Ca2 +
ion-tilstrømning i terminalen ved hjelp av spenningsstyrte kalsiumkanaler. Ca2 +
– tilstrømningen fører til at synaptiske vesikler som inneholder nevrotransmitteren acetylkolin smelter sammen med plasmamembranen, og frigjør acetylkolin i det synaptiske spaltet mellom motorneuronterminalen og det nevromuskulære krysset mellom skjelettmuskelfiberen. Acetylkolin diffunderer over synapsen og binder seg til og aktiverer nikotinacetylkolinreseptorer på det nevromuskulære krysset. Aktivering av nikotinreseptoren åpner sin egen natrium – / kaliumkanal, noe som får natrium til å strømme inn og kalium til å sildre ut. Som et resultat reverserer sarcolemma polariteten og spenningen hopper raskt fra hvilemembranpotensialet på-90mV til så høyt som + 75mV når natrium kommer inn. Membranpotensialet blir da hyperpolarisert når kalium går ut og justeres deretter tilbake til hvilemembranpotensialet. Denne raske svingningen kalles endeplatepotensialet de spenningsstyrte ionkanalene til sarcolemma ved siden av endeplaten åpen som svar på endeplatepotensialet. De er natrium – og kaliumspesifikke og tillater bare en gjennom. Denne bølgen av ionbevegelser skaper handlingspotensialet som sprer seg fra motorens endeplate i alle retninger. Hvis handlingspotensialene slutter å ankomme, slutter acetylkolin å bli frigjort fra terminal bouton. Den gjenværende acetylkolin i den synaptiske spalten blir enten degradert av aktiv acetylkolinesterase eller reabsorbert av den synaptiske knotten, og ingen er igjen for å erstatte den degraderte acetylkolin.
Eksitasjon-kontraksjonskobling
eksitasjon-kontraksjonskobling er prosessen der et muskulært handlingspotensial i muskelfiberen fører til at myofibrillene trekker seg sammen. I skjelettmuskulatur er eksitasjons-kontraksjonskobling avhengig av en direkte kobling mellom nøkkelproteiner, sarkoplasmatisk retikulum (sr) kalsiumfrigjøringskanal (identifisert som ryanodinreseptoren, RyR) og spenningsstyrte l-type kalsiumkanaler (identifisert som dihydropyridinreseptorer, DHPRs). DHPRs er plassert på sarcolemma (som inkluderer overflaten sarcolemma og transversale tubuli), Mens RyRs ligger over sr-membranen. Den nære apposisjonen av et tverrgående rør og to SR-regioner som inneholder RyRs er beskrevet som en triade og er overveiende hvor eksitasjons-sammentrekningskobling finner sted. Eksitasjon-sammentrekningskobling oppstår når depolarisering av skjelettmuskelceller resulterer i et muskelaksjonspotensial, som sprer seg over celleoverflaten og inn i muskelfiberens nettverk Av T-tubuli, og derved depolariserer den indre delen av muskelfiberen. Depolarisering av de indre delene aktiverer dihydropyridinreseptorer i de terminale cisternae, som ligger i nærheten av ryanodinreseptorer i det tilstøtende sarkoplasmatiske retikulum. De aktiverte dihydropyridinreseptorene interagerer fysisk med ryanodinreseptorer for å aktivere dem via fotprosesser(involverer konformasjonsendringer som allosterisk aktiverer ryanodinreseptorene). Når ryanodinreseptorene åpnes, frigjøres Ca2+
fra sarkoplasmatisk retikulum til det lokale veikrysset og diffunderer inn i bulkcytoplasma for å forårsake kalsiumgnist. Merk at sarkoplasmatisk retikulum har en stor kalsiumbufferkapasitet delvis på grunn av et kalsiumbindende protein kalt calsequestrin. Nær synkron aktivering av tusenvis av kalsium gnister av aksjonspotensialet fører til en celle-bred økning i kalsium gir opphav til upstroke av kalsium forbigående. Ca2 +
utgitt i cytosol binder Seg Til Troponin C av aktinfilamenter, for å tillate crossbridge sykling, produsere kraft og, i noen situasjoner, bevegelse. Sarco / endoplasmatisk retikulum kalsium-atpase (SERCA) pumper Aktivt Ca2+
tilbake i sarkoplasmatisk retikulum. Som Ca2 +
avtar tilbake til hvile nivåer, kraften avtar og avslapning oppstår.
Glidende filamentteorieredit

den glidende filamentteorien beskriver en prosess som brukes av muskler til å kontrakt. Det er en syklus av repeterende hendelser som forårsaker en tynn filament å gli over en tykk filament og generere spenning i muskelen. Det ble uavhengig utviklet Av Andrew Huxley Og Rolf Niedergerke og Av Hugh Huxley Og Jean Hanson i 1954. Fysiologisk er denne sammentrekningen ikke ensartet over sarkomeren; den sentrale posisjonen til de tykke filamentene blir ustabil og kan skifte under sammentrekning. Imidlertid er virkningen av elastiske proteiner som titin hypotesert for å opprettholde jevn spenning over sarkomeren og trekke det tykke filamentet i en sentral posisjon.
Crossbridge cyclingEdit

Crossbridge sykling er en sekvens av molekylære hendelser som ligger til grunn for glidende filament teori. En crossbridge er en myosin projeksjon, bestående av to myosin hoder, som strekker seg fra de tykke filamenter. Hvert myosinhode har to bindingssteder: en for ATP og en annen for actin. Bindingen AV ATP til et myosinhode løsner myosin fra aktin, slik at myosin kan binde seg til et annet aktinmolekyl. NÅR det er festet, hydrolyseres ATP av myosin, som bruker den frigjorte energien til å bevege seg inn i «cocked posisjon» hvorved den binder svakt til en del av actinbindingsstedet. Resten av actinbindingsstedet blokkeres av tropomyosin. MED ATP hydrolysert inneholder det hakkede myosinhodet NÅ ADP + Pi. To Ca2 +
– ioner binder seg til troponin C på aktinfilamentene. Troponin-Ca2 +
– komplekset fører til at tropomyosin glir over og blokkerer resten av actinbindingsstedet. Avblokkering av resten av actinbindingsstedene gjør det mulig for de to myosinhodene å lukke og myosin å binde seg sterkt til actin. Myosinhodet frigjør deretter uorganisk fosfat og initierer et strømslag, som genererer en kraft på 2 pN. Strømslaget beveger aktinfilamentet innover, og derved forkorter sarkomeren. Myosin frigjør DERETTER ADP, men er fortsatt tett bundet til actin. PÅ slutten av strømslaget frigjøres ADP fra myosinhodet, slik at myosin festes til aktin i en streng tilstand til en ANNEN ATP binder seg til myosin. EN mangel PÅ ATP ville resultere i rigor tilstand karakteristisk for rigor mortis. NÅR EN ANNEN ATP binder seg til myosin, myosin hodet vil igjen løsne fra actin og en annen crossbridges syklus oppstår.
Crossbridge sykling er i stand til å fortsette så lenge det er tilstrekkelige mengder ATP og Ca2+
i cytoplasma. Oppsigelse av crossbridge sykling kan oppstå Når Ca2+
pumpes aktivt tilbake i sarcoplasmic retikulum. Når Ca2+
ikke lenger er tilstede på det tynne filamentet, endrer tropomyosin konformasjon tilbake til sin tidligere tilstand for å blokkere bindingsstedene igjen. Myosinet slutter å binde seg til det tynne filamentet, og muskelen slapper av. Ca2 +
– ionene forlater troponinmolekylet for å opprettholde ca2 +
ionkonsentrasjonen i sarkoplasma. Den aktive pumping Av Ca2 +
ioner inn i sarcoplasmic retikulum skaper en mangel i væsken rundt myofibrils. Dette fører til fjerning Av Ca2+
ioner fra troponin. Således dekker tropomyosin-troponin-komplekset igjen bindingsstedene på aktinfilamentene og sammentrekningen opphører.
Gradering av skjelettmuskelkontraksjonrediger
styrken av skjelettmuskelkontraksjoner kan grovt deles inn i trekning, summering og tetanus. En trekning er en enkelt sammentrekning og avslapping syklus produsert av et handlingspotensial i muskel fiber selv. Tiden mellom en stimulus til motornerven og den påfølgende sammentrekningen av den innerverte muskelen kalles latentperioden, som vanligvis tar omtrent 10 ms og er forårsaket av tiden det tar for nerveaksjonspotensial å forplante seg, tiden for kjemisk overføring ved nevromuskulær veikryss, deretter de påfølgende trinnene i eksitasjons-sammentrekningskobling.
Hvis et annet muskelaksjonspotensial skulle bli produsert før fullstendig avslapning av en muskeltrekning, vil neste trekning bare summere på forrige trekning, og dermed produsere en summering. Summering kan oppnås på to måter: frekvens summering og flere fiber summering. I frekvenssummeringen styres kraften som utøves av skjelettmuskulaturen ved å variere frekvensen ved hvilken handlingspotensialer sendes til muskelfibre. Handlingspotensialer kommer ikke til muskler synkront, og under en sammentrekning vil en brøkdel av fibrene i muskelen skyte til enhver tid. I en typisk situasjon, når mennesker utøver sine muskler så hardt som de er bevisst i stand, vil omtrent en tredjedel av fibrene i hver av disse musklene brann på en gang, selv om dette forholdet kan påvirkes av ulike fysiologiske og psykologiske faktorer (inkludert Golgi seneorganer og Renshaw-celler). Dette lave nivået av sammentrekning er en beskyttende mekanisme for å forhindre avulsjon av senen—kraften som genereres av en 95% sammentrekning av alle fibre er tilstrekkelig til å skade kroppen. I flere fiber summering, hvis sentralnervesystemet sender et svakt signal for å trekke sammen en muskel, stimuleres de mindre motorenhetene, som er mer spennende enn de større, først. Etter hvert som signalstyrken øker, blir flere motorenheter begeistret i tillegg til større, med de største motorenhetene som har så mye som 50 ganger kontraktilstyrken som de mindre. Etter hvert som flere og større motorenheter aktiveres, blir kraften av muskelkontraksjon gradvis sterkere. Et konsept kjent som størrelsesprinsippet, tillater en gradering av muskelkraft under svak sammentrekning å skje i små trinn, som deretter blir gradvis større når større mengder kraft kreves.
Til Slutt, Hvis frekvensen av muskelaksjonspotensialer øker slik at muskelkontraksjonen når sin toppkraft og platåer på dette nivået, er sammentrekningen en tetanus.
Lengde-spenning relasjonrediger

Muskellengde versus isometrisk kraft
Lengdespenningsforhold relaterer styrken av en isometrisk sammentrekning til lengden av muskelen der sammentrekningen oppstår. Muskler opererer med størst aktiv spenning når de er nær en ideell lengde(ofte hvilelengden). Når strukket eller forkortet utover dette (enten på grunn av virkningen av muskelen selv eller ved en ekstern kraft), reduseres den maksimale aktive spenningen som genereres. Denne reduksjonen er minimal for små avvik, men spenningen faller raskt ettersom lengden avviker lenger fra idealet. På grunn av tilstedeværelsen av elastiske proteiner i en muskelcelle (som titin) og ekstracellulær matriks, da muskelen strekkes utover en gitt lengde, er det en helt passiv spenning som motsetter forlengelse. Kombinert sammen er det en sterk motstand mot å forlenge en aktiv muskel langt utover toppen av aktiv spenning.
Force-velocity relationshipsed
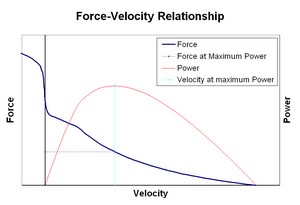
Kraft–hastighetsforhold relaterer hastigheten som en muskel endrer lengden (vanligvis regulert av eksterne krefter, for eksempel belastning eller andre muskler) til mengden kraft som den genererer. Kraften avtar på en hyperbolsk måte i forhold til den isometriske kraften når forkortingshastigheten øker, og når til slutt null ved en viss maksimal hastighet. Omvendt gjelder for når muskelen strekkes-kraften øker over isometrisk maksimum, til endelig når et absolutt maksimum. Denne iboende egenskapen til aktivt muskelvev spiller en rolle i aktiv demping av ledd som aktiveres av samtidig aktive motsatte muskler. I slike tilfeller øker krafthastighetsprofilen kraften som produseres av forlengelsesmuskelen på bekostning av forkortingsmuskelen. Denne favoriseringen av hvilken muskel som returnerer leddet til likevekt, øker effektivt dempingen av leddet. Videre øker styrken av dempingen med muskelkraft. Motorsystemet kan dermed aktivt kontrollere ledddemping via samtidig sammentrekning (ko-sammentrekning) av motsatte muskelgrupper.
Glatt muskulaturrediger
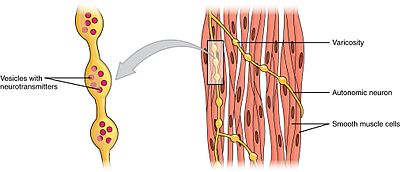
Hevelser som kalles varicosities som tilhører en autonom nevron innerverer glatte muskelceller.
Glatte muskler kan deles inn i to undergrupper: enkelt enhet (enhetlig) og multi-enhet. Single-enhet glatte muskelceller kan bli funnet i tarmen og blodkar. Fordi disse cellene er koblet sammen av gapskryss, er de i stand til å kontrakt som et syncytium. Enkelt-enhet glatte muskelceller kontrakt myogenisk, som kan moduleres av det autonome nervesystemet.
I Motsetning til single-unit glatte muskelceller finnes multi-unit glatte muskelceller i øyets muskel og i bunnen av hårsekkene. Multi-enhet glatte muskelceller kontrakt ved å være separat stimulert av nerver i det autonome nervesystemet. Som sådan tillater de fin kontroll og gradvise responser, akkurat som motorenhetsrekruttering i skjelettmuskulatur.
Mekanismer for glatt muskelkontraksjonrediger
, og Ikke Na +
. Som skjelettmuskler, cytosolic Ca2+
ioner er også nødvendig for crossbridge sykling i glatte muskelceller.
de to kildene for cytosolisk Ca2+
i glatte muskelceller er de ekstracellulære Ca2+
som kommer inn gjennom kalsiumkanaler og ca2 +
– ioner som frigjøres fra sarkoplasmatisk retikulum. Hevingen av cytosolisk Ca2 +
resulterer i Mer Ca2+
binding til calmodulin, som deretter binder og aktiverer myosin lettkjedekinase. Kalsium-calmodulin-myosin light-chain kinase complex fosforylerer myosin på 20 kilodalton (kDa) myosin lette kjeder på aminosyrerest-serin 19, initiere sammentrekning og aktivering av myosin ATPase. I motsetning til skjelettmuskelceller mangler glatte muskelceller troponin, selv om de inneholder det tynne filamentproteinet tropomyosin og andre bemerkelsesverdige proteiner – caldesmon og calponin. Dermed blir glatte muskelkontraksjoner initiert Av Ca2 + – aktivert fosforylering av myosin i stedet For Ca2 + – binding til troponinkomplekset som regulerer myosinbindingssteder på actin som i skjelett-og hjertemuskulatur.Avslutning av crossbridge-sykling (og forlater muskelen i låsestatus) oppstår når myosin – lettkjedefosfatase fjerner fosfatgruppene fra myosinhodene. Fosforylering av 20 kda myosin – lyskjedene korrelerer godt med forkortingshastigheten til glatt muskel. I løpet av denne perioden er det en rask utbrudd av energiutnyttelse målt ved oksygenforbruk. Innen noen få minutter etter initiering reduseres kalsiumnivået markant, fosforyleringen av 20 kda myosin-lette kjeder reduseres, og energiutnyttelsen minker; imidlertid opprettholdes kraften i tonisk glatt muskel. Under sammentrekning av muskel dannes raskt syklende kryssbroer mellom aktivert aktin og fosforylert myosin, som genererer kraft. Det antas at vedlikehold av kraft skyldes defosforylerte «låsebroer» som sakte sykler og opprettholder kraft. En rekke kinaser som rhokinase, dapk3 og proteinkinase C antas å delta i den vedvarende fasen av sammentrekning, Og Ca2+
flux kan være signifikant.
Neuromodulasjonrediger
selv om glatte muskelkontraksjoner er myogene, kan hastigheten og styrken av deres sammentrekninger moduleres av det autonome nervesystemet. Postganglioniske nervefibre i det parasympatiske nervesystemet frigjør nevrotransmitteren acetylkolin, som binder seg til muskarin-acetylkolinreseptorer (mAChRs) på glatte muskelceller. Disse reseptorene er metabotrope eller G-proteinkoblede reseptorer som initierer en andre messenger-kaskade. Omvendt frigjør postganglioniske nervefibre i det sympatiske nervesystemet nevrotransmitterne epinefrin og norepinefrin, som binder til adrenerge reseptorer som også er metabotrope. De nøyaktige effektene på glatt muskulatur avhenger av de spesifikke egenskapene til reseptoren aktivert—både parasympatisk inngang og sympatisk inngang kan enten være eksitatorisk (kontraktil) eller hemmende (avslappende).
hjertemuskelenrediger

. Autorytmiske celler trekker seg ikke sammen, men setter i stedet tempoet for sammentrekning for andre hjertemuskelceller, som kan moduleres av det autonome nervesystemet. I kontrast utgjør kontraktile muskelceller (kardiomyocytter) størstedelen av hjertemuskelen og er i stand til å kontrakt.
eksitasjon-kontraksjonskoblingrediger
i både skjelett-og hjertemuskulær eksitasjon-kontraksjonskobling (E-C) oppstår depolariseringsledning og Ca2+ frigjøringsprosesser. Men selv om de involverte proteinene er like, er de forskjellige i struktur og regulering. Dihydropyridinreseptorene (DHPRs) er kodet av forskjellige gener, og ryanodinreseptorene (ryrs) er forskjellige isoformer. DHPR-kontakt med RyR1 (hoved RyR-isoform i skjelettmuskulatur) for å regulere Ca2+ – frigjøring i skjelettmuskulatur, Mens L-type kalsiumkanal (DHPR på hjerte-myocytter) og RyR2 (hoved RyR-isoform i hjertemuskulatur) ikke er fysisk koblet i hjertemuskulatur, men ansikt med hverandre ved en veikryssende kobling.
I Motsetning til skjelettmuskulatur, Antas E-c-kobling i hjertemuskulatur primært å avhenge av en mekanisme som kalles kalsiumindusert kalsiumfrigivelse, som er basert på kryssstrukturen mellom T-tubule og sarkoplasmatisk retikulum. Junctophilin – 2 (JPH2) er viktig for å opprettholde denne strukturen, så vel som integriteten Til T-tubule. Et annet protein, receptor accessory protein 5 (REEP5), funksjoner for å holde normal morfologi av junctional sr. Defekter av junctional kopling kan skyldes mangler av en av de to proteinene. Under prosessen med kalsiumindusert kalsiumfrigivelse aktiveres RyR2s av en kalsiumutløser, som forårsakes av strømmen Av Ca2 + gjennom L-type kalsiumkanaler. Etter dette har hjertemuskelen en tendens til å vise diad (eller dyad) strukturer, i stedet for triader.
eksitasjon-kontraksjonskobling i hjertemuskelceller oppstår når et aksjonspotensial initieres av pacemakerceller i sinusknuten eller Atrioventrikulærknuten og føres til alle celler i hjertet via spaltekryss. Aksjonspotensialet beveger seg langs overflatemembranen inn I T-tubuli (sistnevnte er ikke sett i alle hjertecelletyper), og depolariseringen fører til at ekstracellulær Ca2+
kommer inn i cellen via L-type kalsiumkanaler og muligens NATRIUMKALSIUMVEKSLER (NCX) i den tidlige delen av platåfasen. Selv om Denne Ca2+ tilstrømningen bare teller for ca 10% Av Ca2+ som trengs for aktivering, er den relativt større enn skjelettmuskulaturens. Denne Ca2+
tilstrømningen fører til en liten lokal økning i intracellulær Ca2+
. Økningen av intracellulær Ca2 +
oppdages Av RyR2 i membranen til sarkoplasmatisk retikulum, som frigjør Ca2+
i en positiv tilbakemelding fysiologisk respons. Denne positive tilbakemeldingen er kjent som kalsiumindusert kalsiumfrigivelse og gir opphav til kalsiumgnister (Ca2 +
gnister). Den romlige og tidsmessige summasjonen av ~30,000 Ca2 +
gnister gir en cellebred økning i cytoplasmatisk kalsiumkonsentrasjon. Økningen i cytosolisk kalsium etter strømmen av kalsium gjennom cellemembranen og sarkoplasmatisk retikulum modereres av kalsiumbuffere, som binder en stor andel intracellulært kalsium. Som et resultat fører en stor økning i totalt kalsium til en relativt liten økning i fri Ca2+
.
det cytoplasmatiske kalsium binder Seg Til Troponin C, og beveger tropomyosinkomplekset utenfor actinbindingsstedet slik at myosinhodet kan binde seg til aktinfilamentet. Fra dette punktet er kontraktilmekanismen i det vesentlige den samme som for skjelettmuskulatur (over). Kort sagt, VED HJELP AV ATP-hydrolyse, trekker myosinhodet aktinfilamentet mot sentrum av sarkomeren.
 nøkkelproteiner involvert i hjerte kalsium sykling og eksitasjon-sammentrekning kopling
nøkkelproteiner involvert i hjerte kalsium sykling og eksitasjon-sammentrekning koplinginn i sarcoplasmic retikulum klar for neste syklus å begynne. Kalsium utløses også fra cellen hovedsakelig av natriumkalsiumb-veksleren (NCX) og i mindre grad en plasmamembrankalsiumatpase. Noen kalsium er også tatt opp av mitokondriene. Et enzym, phosfolamban, fungerer som en bremse FOR SERCA. Ved lave hjertefrekvenser er fosfolamban aktiv og senker Aktiviteten Til Atpasen slik At Ca2+
ikke trenger å forlate cellen helt. Ved høye hjertefrekvenser fosfolamban fosforyleres og deaktiveres dermed tar De Fleste Ca2+
fra cytoplasma tilbake i sarkoplasmatisk retikulum. Igjen, kalsiumbuffere moderat dette fallet I Ca2 +
konsentrasjon, tillater en relativt liten reduksjon i fri Ca2 +
konsentrasjon som svar på en stor endring i total kalsium. Den fallende Ca2 +
– konsentrasjonen gjør at troponinkomplekset kan dissosiere fra aktinfilamentet og dermed avslutte sammentrekning. Hjertet slapper av, slik at ventriklene fylles med blod og begynner hjertesyklusen igjen.
Leave a Reply