Spiercontractie

bij gewervelde dieren zijn er drie soorten spierweefsel: skeletachtig, glad en cardiaal. Skeletspier vormt de meerderheid van de spiermassa in het lichaam en is verantwoordelijk voor bewegingsactiviteit. Gladde spieren vormen bloedvaten, maag-darmkanaal en andere gebieden in het lichaam die aanhoudende contracties produceren. Hartspier vormt het hart, dat bloed pompt. Skeletspieren en hartspieren worden dwarsgestreepte spieren genoemd vanwege hun gestreepte uiterlijk onder een microscoop, wat te wijten is aan het sterk georganiseerde afwisselende patroon van A-en I-banden.
Skeletmuscleedit

Met uitzondering van reflexen treden alle skeletspiercontracties op als gevolg van bewuste inspanning vanuit de hersenen. De hersenen sturen elektrochemische signalen door het zenuwstelsel naar het motorneuron dat verschillende spiervezels innervates. In het geval van sommige reflexen, kan het signaal samentrekken ontstaan in het ruggenmerg door middel van een terugkoppelingslus met de grijze stof. Andere handelingen zoals voortbeweging, ademhaling en kauwen hebben een reflexaspect: de weeën kunnen zowel bewust als onbewust worden geïnitieerd.
neuromusculaire junctiedit

een neuromusculaire verbinding is een chemische synaps die wordt gevormd door het contact tussen een motorische neuron en een spiervezel. Het is de plaats waar een motorneuron een signaal naar een spiervezel verzendt om spiercontractie te initiëren. De opeenvolging van gebeurtenissen die in de depolarisatie van de spiervezel bij de neuromusculaire kruising resulteert begint wanneer een actiepotentiaal in het cellichaam van een motorneuron wordt geïnitieerd, dat dan door zouthoudende geleiding langs zijn axon naar de neuromusculaire kruising wordt gepropageerd. Zodra het de terminale bouton bereikt, veroorzaakt het actiepotentiaal een Ca2 +
– Ion-instroom in de terminal via de spanningsgesloten calciumkanalen. De Ca2 +
instroom zorgt ervoor dat synaptische blaasjes die de neurotransmitter acetylcholine bevatten fuseren met het plasmamembraan, waardoor acetylcholine vrijkomt in de synaptische spleet tussen de motorische Neuron terminal en de neuromusculaire verbinding van de skeletspiervezel. Acetylcholine diffuus over de synaps en bindt aan en activeert nicotineacetylcholinereceptoren op de neuromusculaire junctie. De activering van de nicotinereceptor opent zijn intrinsieke natrium/kaliumkanaal, waardoor natrium snel binnenkomt en kalium eruit druppelt. Als gevolg hiervan keert de sarcolemma de polariteit om en springt de spanning snel van het rustmembraan potentieel van-90mV naar zo hoog als +75mV als natrium binnenkomt. Het membraanpotentieel wordt dan hyperpolarized wanneer het kalium uitgangen en dan terug aan het rustende membraanpotentieel wordt aangepast. Deze snelle fluctuatie wordt het eindplaatpotentiaal genoemd de spanningsgesloten ionenkanalen van het sarcolemma naast de eindplaat open als reactie op de eindplaatpotentiaal. Ze zijn natrium – en kaliumspecifiek en laten er maar één door. Deze golf van ionenbewegingen creëert het actiepotentiaal dat zich vanuit de motoreindplaat in alle richtingen verspreidt. Als er geen actiepotentialen meer komen, wordt acetylcholine niet meer vrijgelaten uit de terminal bouton. De resterende acetylcholine in de synaptische spleet wordt ofwel afgebroken door actieve acetylcholine-esterase of opnieuw geabsorbeerd door de synaptische knop en er blijft Geen over om de gedegradeerde acetylcholine te vervangen.
excitatie-contractiekoppeling
excitatie–contractiekoppeling is het proces waarbij een spieractiepotentiaal in de spiervezel ervoor zorgt dat de myofibrillen samentrekken. In skeletspieren is de excitatie–contractie koppeling gebaseerd op een directe koppeling tussen de belangrijkste eiwitten, het sarcoplasmatische reticulum (SR) calcium release kanaal (geïdentificeerd als de ryanodine receptor, RyR) en voltage-gated L-type calcium kanalen (geïdentificeerd als dihydropyridine receptoren, DHPRs). DHPRs bevinden zich op de sarcolemma (die het oppervlak sarcolemma en de transversale tubuli omvat), terwijl de RyRs verblijven over de SR membraan. De nauwe apposition van een transversale tubulus en twee Sr regio ‘ s die RyRs bevatten wordt beschreven als een triade en is voornamelijk waar excitatie–contractie koppeling plaatsvindt. Excitatie-contractie koppeling treedt op wanneer depolarisatie van skeletspiercel resulteert in een spier actie potentieel, die zich verspreidt over het celoppervlak en in het netwerk van de spiervezel van t-tubuli, waardoor depolarisatie van het binnenste gedeelte van de spiervezel. Depolarisatie van de binnenste delen activeert dihydropyridinereceptoren in de terminale cisternae, die in de nabijheid van ryanodinereceptoren in het aangrenzende sarcoplasmatische reticulum zijn. De geactiveerde dihydropyridinereceptoren interageren fysiek met ryanodinereceptoren om ze te activeren via voetprocessen (met conformationele veranderingen die de ryanodinereceptoren allosterisch activeren). Wanneer de ryanodine-receptoren zich openen, komt Ca2+
uit het sarcoplasmatisch reticulum vrij in de lokale junctieruimte en verspreidt het zich in het bulkcytoplasma om een calciumvonk te veroorzaken. Merk op dat het sarcoplasmatische reticulum een grote calciumbuffercapaciteit heeft, gedeeltelijk als gevolg van een calciumbindend eiwit genaamd calsequestrine. De bijna synchrone activering van duizenden calciumvonken door het actiepotentiaal veroorzaakt een celbrede verhoging van calcium die aanleiding geeft tot de opgaande slag van de calcium voorbijgaande. De Ca2 +
die in het cytosol wordt vrijgegeven bindt aan troponine C door de actine-filamenten, om kruisboogcycling toe te staan, die kracht en, in sommige situaties, beweging produceren. Het Sarco / endoplasmatisch reticulum calciumatpase (SERCA) pompt actief Ca2+
terug in het sarcoplasmatisch reticulum. Als Ca2 +
Terug daalt naar rustniveaus, neemt de kracht af en treedt ontspanning op.
Sliding filament theoryEdit

De glijdfilamenttheorie beschrijft een proces dat door spieren wordt gebruikt om samen te trekken. Het is een cyclus van repetitieve gebeurtenissen die ervoor zorgen dat een dunne gloeidraad over een dikke gloeidraad glijdt en spanning in de spier genereert. Het werd onafhankelijk ontwikkeld door Andrew Huxley en Rolf Niedergerke en door Hugh Huxley en Jean Hanson in 1954. Fysiologisch is deze samentrekking niet uniform over het sarcomeer; de centrale positie van de dikke filamenten wordt onstabiel en kan verschuiven tijdens de samentrekking. Nochtans worden de acties van elastische proteã nen zoals titin verondersteld om eenvormige spanning over sarcomere te handhaven en de dikke gloeidraad in een centrale positie te trekken.
Crossbridge cyclingEdit

Crossbridge cycling is een reeks moleculaire gebeurtenissen die ten grondslag ligt aan de glijdfilament theorie. Een kruisboog is een myosin projectie, bestaande uit twee myosin hoofden, die zich uitstrekt van de dikke filamenten. Elk myosin hoofd heeft twee bindende plaatsen: één voor ATP en een andere voor actin. De band van ATP aan een myosin hoofd maakt myosin van actin los, daardoor toestaand myosin om aan een andere actin molecuul te binden. Eenmaal in bijlage, wordt ATP gehydrolyseerd door myosin, die de vrijgegeven energie gebruikt om zich in de “gespannen positie” te bewegen waarbij het zwak aan een deel van de actin bindende plaats bindt. De rest van de actinebindingsplaats wordt geblokkeerd door tropomyosine. Met de ATP gehydrolyseerd, de gebogen myosin hoofd bevat nu ADP + Pi. Twee Ca2 +
ionen binden aan troponine C op de actine filamenten. Het troponine-Ca2 +
complex zorgt ervoor dat tropomyosine overglijdt en de rest van de actinebindingsplaats deblokkeert. Het deblokkeren van de rest van de actin bandplaatsen staat de twee myosin hoofden toe om te sluiten en myosin om sterk aan actin te binden. Het myosinhoofd geeft dan het anorganische fosfaat vrij en stelt een machtsslag in werking, die een kracht van 2 pN produceert. De krachtslag beweegt het actine filament naar binnen, waardoor het sarcomeer wordt verkort. Myosine geeft dan ADP vrij, maar blijft nog steeds strak gebonden aan actin. Aan het eind van de machtsslag, wordt ADP vrijgegeven van het myosin hoofd, het verlaten van myosin in bijlage aan actin in een rigor staat totdat een andere ATP aan myosin bindt. Een gebrek aan ATP zou resulteren in de rigor state karakteristiek van rigor mortis. Zodra een andere ATP aan myosin bindt, zal het myosin-hoofd opnieuw van actin losmaken en komt een andere kruisbrugscyclus voor.
Crossbridge cycling kan doorgaan zolang er voldoende hoeveelheden ATP en Ca2+
in het cytoplasma aanwezig zijn. Het beëindigen van kruisboogcycli kan optreden wanneer Ca2+
actief wordt teruggepompt in het sarcoplasmatische reticulum. Wanneer Ca2 +
niet meer aanwezig is op de dunne gloeidraad, verandert de tropomyosine weer in zijn vorige toestand om de bindingsplaatsen weer te blokkeren. De myosine stopt met binden aan de dunne gloeidraad, en de spier ontspant. De Ca2 +
– ionen verlaten het troponinemolecuul om de Ca2+
– ionconcentratie in het sarcoplasma te handhaven. Het actief pompen van Ca2+
– ionen in het sarcoplasmatisch reticulum leidt tot een tekort in de vloeistof rond de myofibrillen. Dit veroorzaakt de verwijdering van Ca2 +
– ionen uit het troponine. Aldus, behandelt het tropomyosin-troponinecomplex opnieuw de verbindingsplaatsen op de actin gloeidraden en houdt de samentrekking op.
Gradatie van de skeletspieren contractionsEdit
de kracht van De samentrekkingen van de skeletspieren kunnen grofweg worden onderverdeeld in de twitch, sommatie, en tetanus. Een twitch is een enkele samentrekking en ontspanning cyclus geproduceerd door een actiepotentiaal binnen de spiervezel zelf. De tijd tussen een stimulus aan de motorische zenuw en de daaropvolgende samentrekking van de innervated spier wordt de latente periode genoemd, die meestal ongeveer 10 ms duurt en wordt veroorzaakt door de tijd die nodig is voor zenuwactiepotentiaal om zich voort te planten, de tijd voor chemische transmissie bij de neuromusculaire junctie, vervolgens de volgende stappen in excitatie-contractie koppeling.
indien een andere spieractiepotentiaal moet worden geproduceerd voordat een spiertrekking volledig is ontspannen, dan zal de volgende trekking gewoon optellen op de vorige trekking, waardoor een optelling ontstaat. Sommatie kan op twee manieren worden bereikt: frequentie sommatie en meervoudige vezel sommatie. In frequentie-optelling wordt de kracht die door de skeletspier wordt uitgeoefend, gecontroleerd door de frequentie te variëren waarbij actiepotentialen naar spiervezels worden gestuurd. Actiepotentialen komen niet synchroon bij spieren aan, en tijdens een samentrekking zal een fractie van de vezels in de spier op een bepaald moment afvuren. In een typische omstandigheid, wanneer mensen oefenen hun spieren zo hard als ze bewust in staat zijn, ongeveer een derde van de vezels in elk van die spieren zal vuren in een keer, hoewel deze verhouding kan worden beïnvloed door verschillende fysiologische en psychologische factoren (met inbegrip van Golgi pees organen en Renshaw cellen). Dit’ lage ‘ niveau van contractie is een beschermend mechanisme om Avulsie van de pees te voorkomen—de kracht die wordt gegenereerd door een 95% contractie van alle vezels is voldoende om het lichaam te beschadigen. In veelvoudige vezel sommatie, als het centrale zenuwstelsel een zwak signaal stuurt om een spier samen te trekken, worden de kleinere motoreneenheden, die prikkelbaarder zijn dan de grotere, eerst gestimuleerd. Naarmate de sterkte van het signaal toeneemt, worden meer motoreenheden opgewonden naast grotere, waarbij de grootste motoreenheden wel 50 keer de contractiele sterkte hebben als de kleinere. Naarmate meer en grotere motoreenheden worden geactiveerd, wordt de kracht van spiercontractie steeds sterker. Een concept dat bekend staat als het grootteprincipe, staat voor een gradatie van spierkracht tijdens zwakke samentrekking toe om in kleine stappen voor te komen, die dan progressief groter worden wanneer grotere hoeveelheden kracht worden vereist.
ten slotte, als de frequentie van de spieractiepotentialen zodanig toeneemt dat de spiercontractie zijn piekkracht en plateaus op dit niveau bereikt, dan is de contractie een tetanus.
Length-tension relationshipEdit

Length-tension relationship relateert de sterkte van een isometrische contractie aan de lengte van de spier waarbij de contractie optreedt. Spieren werken met de grootste actieve spanning wanneer dicht bij een ideale lengte (vaak hun rustlengte). Wanneer deze wordt uitgerekt of ingekort (door de werking van de spier zelf of door een externe kracht), neemt de maximale actieve spanning die wordt gegenereerd af. Deze daling is minimaal voor kleine afwijkingen, maar de spanning daalt snel als de lengte verder van het ideaal afwijkt. Wegens de aanwezigheid van elastische proteã NEN binnen een spiercel (zoals titin) en extracellulaire matrijs, aangezien de spier voorbij een bepaalde lengte wordt uitgerekt, is er een volledig passieve spanning, die zich tegen het verlengen verzet. Gecombineerd samen, is er een sterke weerstand tegen het verlengen van een actieve spier ver voorbij de piek van actieve spanning.
kracht-snelheidverhouding
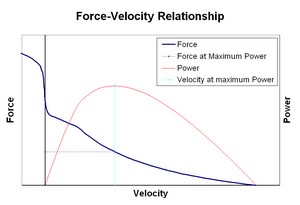
verband tussen kracht en snelheid De snelheid waarmee een spier van lengte verandert (gewoonlijk geregeld door externe krachten, zoals belasting of andere spieren) en de hoeveelheid kracht die hij genereert. De kracht neemt op hyperbolische wijze af ten opzichte van de isometrische kracht naarmate de verkortingssnelheid toeneemt, en bereikt uiteindelijk nul bij een bepaalde maximumsnelheid. Het omgekeerde geldt voor wanneer de spier wordt uitgerekt-de kracht stijgt boven het isometrisch maximum, totdat uiteindelijk het absolute maximum wordt bereikt. Deze intrinsieke eigenschap van actief spierweefsel speelt een rol in de actieve demping van gewrichten die worden aangedreven door gelijktijdig-actieve tegengestelde spieren. In dergelijke gevallen verbetert het krachtsnelheidsprofiel de kracht die door de verlengende spier wordt geproduceerd ten koste van de verkorte spier. Dit voordeel van welke spier het gewricht terug naar evenwicht verhoogt effectief de demping van het gewricht. Bovendien neemt de sterkte van de demping toe met spierkracht. Het motorsysteem kan zo actief de gewrichtsdemping regelen via de gelijktijdige samentrekking (co-samentrekking) van tegengestelde spiergroepen.
Smooth muscleEdit
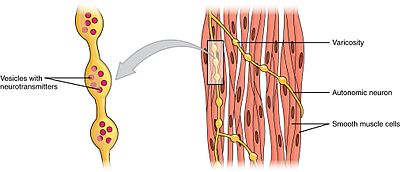
gladde spieren kunnen worden onderverdeeld in twee subgroepen: single-unit (unitary) en multi-unit. Enkele-eenheid gladde spiercellen kunnen worden gevonden in de darmen en bloedvaten. Omdat deze cellen met elkaar verbonden zijn door gap junctions, kunnen ze samentrekken als syncytium. Enkele-eenheid gladde spiercellen contract myogenically, die kan worden gemoduleerd door het autonome zenuwstelsel.
In tegenstelling tot gladde spiercellen met één eenheid, worden gladde spiercellen met meerdere eenheden aangetroffen in de oogspier en in de basis van de haarfollikels. Multi-unit gladde spiercellen samentrekken door afzonderlijk te worden gestimuleerd door zenuwen van het autonome zenuwstelsel. Als zodanig zorgen ze voor fijne controle en geleidelijke reacties, net als de werving van motorische eenheden in skeletspieren.
Mechanismen van de gladde spieren contractionEdit
De contractiele activiteit van de gladde spiercellen wordt beïnvloed door meerdere ingangen zoals spontane elektrische activiteit, neurale en hormonale ingangen, lokale veranderingen in de chemische samenstelling, en stretch. Dit is in tegenstelling tot de contractiele activiteit van skeletspiercellen, die op één enkele neurale input berust. Sommige soorten gladde spiercellen zijn in staat om hun eigen actiepotentiaal spontaan te genereren, die meestal optreden na een pacemakerpotentiaal of een langzame golfpotentiaal. Deze actiepotentialen worden gegenereerd door de instroom van extracellulair Ca2+
, en niet Na+
. Net als skeletspieren zijn cytosolische Ca2+
– ionen ook nodig voor kruisboogcycli in gladde spiercellen.
de twee bronnen voor cytosolisch Ca2+
in gladde spiercellen zijn de extracellulaire Ca2+
die via calciumkanalen binnenkomt en de Ca2+
ionen die vrijkomen uit het sarcoplasmatisch reticulum. De verhoging van cytosolisch Ca2+
resulteert in meer binding van Ca2+
aan calmoduline, dat vervolgens myosine lichtketenkinase bindt en activeert. De calcium-calmodulin-myosin licht-keten kinase complexe fosforylates myosine op de 20 kilodalton (kDa) myosin lichte kettingen op aminozuurresidu-serine 19, initiërend samentrekking en activerend de myosin ATPase. In tegenstelling tot skeletspiercellen missen gladde spiercellen troponine, hoewel ze het dunne filamentproteïne tropomyosine en andere opmerkelijke eiwitten bevatten – caldesmon en calponine. Zo worden de samentrekkingen van de gladde spieren geïnitieerd door de Ca2+
-geactiveerde fosforylatie van myosine in plaats van door de binding van Ca2+
aan het troponinecomplex dat de bindingsplaatsen van myosine op actin reguleert, zoals in skeletspieren en hartspieren.
beëindiging van de kruisboogcyclus (en het verlaten van de spier in vergrendelingstoestand) treedt op wanneer myosine light chain phosphatase de fosfaatgroepen uit de myosine hoofden verwijdert. Phosphorylation van de 20 kDa myosin lichte kettingen correleert goed met de verkorting snelheid van gladde spier. Gedurende deze periode is er een snelle uitbarsting van energiegebruik zoals gemeten door zuurstofverbruik. Binnen een paar minuten na initiatie, neemt het calciumniveau duidelijk af, neemt de phosphorylation van de 20 kDa myosin lichte kettingen af en neemt het energiegebruik af; nochtans, wordt de kracht in tonic gladde spier gehandhaafd. Tijdens samentrekking van spier, vormen snel het cirkelen kruisbruggen tussen geactiveerd actin en phosphorylated myosine, die kracht produceren. Er wordt verondersteld dat het behoud van kracht het gevolg is van gedefosforyleerde “latch-bridges” die langzaam cyclus en kracht handhaven. Een aantal kinasen zoals rho kinase, DAPK3 en proteïnekinase C wordt verondersteld deel te nemen aan de aanhoudende fase van contractie, en Ca2+
flux kan significant zijn.
NeuromodulationEdit
hoewel samentrekkingen van gladde spieren myogeen zijn, kunnen de snelheid en sterkte van hun samentrekkingen worden gemoduleerd door het autonome zenuwstelsel. Postganglionische zenuwvezels van het parasympathische zenuwstelsel geven de neurotransmitter acetylcholine vrij, die zich bindt aan muscarine acetylcholine receptoren (mAChRs) op gladde spiercellen. Deze receptoren zijn metabotropic, Of g-eiwit gekoppelde receptoren die een tweede cascade van de boodschapper in werking stellen. Omgekeerd, geven de postganglionic zenuwvezels van het sympathische zenuwstelsel de neurotransmitters epinefrine en norepinefrine vrij, die aan adrenergic receptoren binden die ook metabotropic zijn. De exacte effecten op het gladde spierweefsel hangen af van de specifieke kenmerken van de geactiveerde receptor—zowel parasympathische als sympathische input kunnen prikkelend (contractiel) of remmend (ontspannend) zijn.
cardiale muscleEdit

Er zijn twee soorten hartspiercellen: autoritthmic en contractiel. Autoritmische cellen trekken niet samen, maar stellen in plaats daarvan het tempo van samentrekking in voor andere hartspiercellen, die kunnen worden gemoduleerd door het autonome zenuwstelsel. In tegenstelling, contractiele spiercellen (cardiomyocyten) vormen de meerderheid van de hartspier en kunnen samentrekken.
excitatie-contractiekoppelingedit
in zowel skeletale als hartspier vinden excitatie-contractie (E-C) – koppeling, depolarisatiegeleiding en Ca2+ – vrijgaveprocessen plaats. Nochtans, hoewel de betrokken proteã nen gelijkaardig zijn, zijn zij verschillend in structuur en regelgeving. De dihydropyridinereceptoren (DHPRs) worden gecodeerd door verschillende genen, en de ryanodinereceptoren (RyRs) zijn verschillende isovormen. Bovendien, DHPR contacten met RyR1 (belangrijkste RyR isoform in skeletspier) om Ca2+ release in skeletspier te regelen, terwijl de l-type calcium kanaal (DHPR op cardiale myocyten) en RyR2 (belangrijkste RyR isoform in hartspier) zijn niet fysiek gekoppeld in de hartspier, maar gezicht met elkaar door een junctional koppeling.
In tegenstelling tot skeletspieren wordt aangenomen dat E-C-koppeling in de hartspier voornamelijk afhangt van een mechanisme dat calcium-geïnduceerde calciumafgifte wordt genoemd, dat gebaseerd is op de verbindingsstructuur tussen T-tubulus en sarcoplasmatisch reticulum. Junctophilin-2 (JPH2) is essentieel om deze structuur te behouden, evenals de integriteit van t-tubule. Een andere proteã ne, receptor bijkomende proteã ne 5 (REEP5), functioneert om de normale morfologie van junctional sr te houden. defecten van junctional koppeling kunnen uit tekorten van één van de twee proteã nen voortvloeien. Tijdens het proces van calcium-geïnduceerde calcium release, RyR2s worden geactiveerd door een calcium trigger, die wordt veroorzaakt door de stroom van Ca2+ door de l-type calciumkanalen. Hierna neigt de hartspier om DIAD (of dyad) structuren, eerder dan triads tentoon te stellen.
excitatie-contractie koppeling in hartspiercellen treedt op wanneer een actiepotentiaal wordt geïnitieerd door pacemaker cellen in de sinoatriale knoop of atrioventriculaire knoop en uitgevoerd naar alle cellen in het hart via gap junctions. Het actiepotentiaal verplaatst zich langs het oppervlaktemembraan naar t-tubuli (deze laatste worden niet bij alle cardiale celtypen gezien) en de depolarisatie zorgt ervoor dat extracellulair Ca2+
De cel binnendringt via L-type calciumkanalen en mogelijk natrium-calciumwisselaar (NCX) tijdens het vroege deel van de plateaufase. Hoewel deze Ca2+ instroom slechts voor ongeveer 10% van de Ca2 + die nodig is voor activering meetelt, is deze relatief groter dan die van skeletspieren. Deze Ca2+
instroom veroorzaakt een kleine lokale toename van intracellulair Ca2 +
. De toename van intracellulair Ca2+
wordt gedetecteerd door RyR2 in het membraan van het sarcoplasmatisch reticulum, dat Ca2+
afgeeft in een positieve feedback fysiologische respons. Deze positieve feedback staat bekend als calcium-geïnduceerde calcium release en geeft aanleiding tot calcium vonken (Ca2+
vonken). De ruimtelijke en temporele som van ~ 30.000 Ca2+
vonken geeft een celbrede toename van cytoplasmatische calciumconcentratie. De verhoging van cytosolic calcium na de stroom van calcium door het celmembraan en sarcoplasmic reticulum wordt gematigd door calciumbuffers, die een groot deel van intracellular calcium binden. Als gevolg hiervan leidt een grote toename van het totale calcium tot een relatief kleine toename van het vrije Ca2+
.
het cytoplasmatische calcium bindt aan troponine C, waardoor het tropomyosinecomplex van de actinebindingsplaats wordt verwijderd, waardoor de myosinekop aan de actinegloeidraad kan binden. Vanaf dit punt is het contractiele mechanisme in wezen hetzelfde als voor skeletspieren (hierboven). Kort, gebruikend ATP hydrolyse, trekt het myosinhoofd de actin gloeidraad naar het centrum van sarcomere.

na systole wordt intracellulair calcium opgenomen door de Sarco/endoplasmatisch reticulum ATPase (SERCA) pomp terug in de sarcoplasmatisch reticulum klaar voor de volgende cyclus. Calcium wordt ook voornamelijk uit de cel verwijderd door de natrium-calciumwisselaar (NCX) en, in mindere mate, door een plasmamembraan calciumatpase. Sommige calcium wordt ook opgenomen door de mitochondriën. Een enzym, fosfolamban, dient als rem voor SERCA. Bij lage hartslag is fosfolamban actief en vertraagt het de activiteit van de ATPase, zodat Ca2+
de cel niet volledig hoeft te verlaten. Bij hoge hartslag wordt fosfolamban gefosforyleerd en gedeactiveerd, waardoor het grootste deel van Ca2+
uit het cytoplasma wordt teruggevoerd naar het sarcoplasmatisch reticulum. Nogmaals, calciumbuffers matigen deze daling van de Ca2+
concentratie, waardoor een relatief kleine daling van de vrije Ca2+
concentratie mogelijk is als reactie op een grote verandering in totaal calcium. Door de dalende Ca2 +
– concentratie kan het troponinecomplex loskomen van het actinefilament, waardoor de contractie wordt beëindigd. Het hart ontspant, waardoor de ventrikels te vullen met bloed en beginnen de hartcyclus opnieuw.
Leave a Reply