organisk kemi II

eksperimentelt observeres det imidlertid, at der er en signifikant barriere for rotation omkring C2-C3-bindingen, og at hele molekylet er plan. Derudover er C2-C3-bindingen 148 pm lang, kortere end en typisk carbon-carbon enkeltbinding (ca.154 pm), dog længere end en typisk dobbeltbinding (ca. 134 pm).
Molekylær orbitalteori tegner sig for disse observationer med begrebet delokaliserede pi-bindinger. På dette billede kombineres de fire 2P atomorbitaler matematisk for at danne fire pi molekylære orbitaler med stigende energi. To af disse – bindings – pi – orbitalerne-har lavere energi end de p-atomorbitaler, hvorfra de dannes, mens to-de antibindende pi* – orbitaler-har højere energi.

den laveste energimolekylære orbital, pi1, har kun konstruktiv interaktion og nul noder. Højere i energi, men stadig lavere end de isolerede p – orbitaler, har pi2-orbitalen en knude, men to konstruktive interaktioner-således er det stadig en bindings orbital samlet. Når man ser på de to antibonding orbitaler, har pi3* to noder og en konstruktiv interaktion, mens pi4* har tre noder og nul konstruktive interaktioner.
Ved aufbau-princippet placeres de fire elektroner fra de isolerede 2pse atomorbitaler i bindingen pi1 og pi2 MO ‘ er. Fordi pi1 inkluderer konstruktiv interaktion mellem C2 og C3, er der en grad i 1,3-butadienmolekylet af pi-bindingsinteraktion mellem disse to carbonatomer, som tegner sig for dens kortere længde og rotationsbarrieren. Valensbindingsbilledet af 1,3-butadien viser de to pi-bindinger som isoleret fra hinanden, hvor hvert par pi-elektroner ‘sidder fast’ i sin egen pi-binding. Imidlertid forudsiger molekylær orbitalteori (nøjagtigt), at de fire pi-elektroner til en vis grad er delokaliseret eller ‘spredt ud’ over hele pi-systemet.

1,3-butadien er det enkleste eksempel på et system af konjugerede pi-bindinger. For at blive betragtet som konjugeret skal to eller flere pi – bindinger kun adskilles med en enkelt binding-med andre ord kan der ikke være et mellemliggende sp3-hybridiseret kulstof, fordi dette ville nedbryde det overlappende system af parallelle p-orbitaler. I forbindelsen nedenfor konjugeres for eksempel C1-C2-og C3-C4-dobbeltbindingerne, mens C6-C7-dobbeltbindingen isoleres fra de to andre pi-bindinger ved hjælp af sp3-hybridiseret C5.

et meget vigtigt koncept at huske på er, at der er en iboende termodynamisk stabilitet forbundet med konjugation. Denne stabilitet kan måles eksperimentelt ved at sammenligne hydrogeneringsvarmen af to forskellige Diener. (Hydrogenering er en reaktionstype, som vi vil lære meget mere om i kapitel 15: i det væsentlige er det processen med at tilføje et hydrogenmolekyle – to protoner og to elektroner – til en p-binding). Når de to konjugerede dobbeltbindinger af 1,3-pentadien ‘hydrogeneres’ til fremstilling af pentan, frigives omkring 225 kJ pr. 250 kJ / mol frigivet, når de to isolerede dobbeltbindinger i 1,4-pentadien hydrogeneres og danner også pentan.
dannelsen af syntetiske polymerer fra Diener, såsom 1,3-butadien og isopren, diskuteres i afsnit 18.5. Syntetiske polymerer er store molekyler, der består af mindre gentagne enheder. Du er sandsynligvis noget bekendt med en række af disse polymerer; for eksempel polyethylen, polypropylen, polystyren og poly(vinylchlorid).

figur 13.6: Energidiagram til hydrogenering af 1,3-butadien (ikke til skala).
da hydrogeneringen af 1,3-butadien frigiver mindre end den forudsagte mængde energi, skal energiindholdet i 1,3-butadien være lavere, end vi måske havde forventet. Med andre ord er 1,3-butadien mere stabil end dens formel antyder.
den konjugerede Dien er lavere i energi: med andre ord er den mere stabil. Generelt er konjugerede pi-obligationer mere stabile end isolerede pi-obligationer.
Her er et energidiagram, der sammenligner forskellige typer bindinger med deres hydrogeneringsvarme (pr.mol) for at vise relativ stabilitet af hvert molekyle (1 kcal = 4,18 kJ). Pi-binding), jo mere stabil er strukturen.)
stabiliseringen af diener ved konjugation er mindre dramatisk end den aromatiske stabilisering af bensene. Ikke desto mindre kan lignende resonans og molekylære orbitalbeskrivelser af konjugation skrives.
syntese af diener
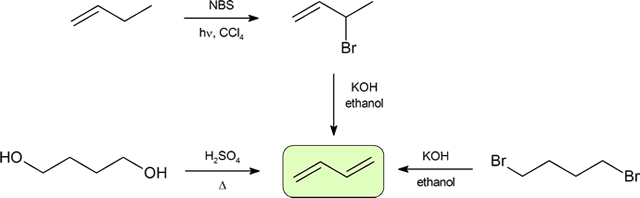
de to hyppigste måder at syntetisere konjugerede Diener på er dehydrering af alkoholer og dehydrohalogenering af organohalider, som blev introduceret til fremstilling af alkener (afsnit 9.9). Følgende skema illustrerer nogle af ruterne til fremstilling af en konjugeret Dien.
konjugerede pi-systemer kan involvere ilt-og nitrogenatomer såvel som kulstof. I metabolismen af fedtmolekyler involverer nogle af nøglereaktionerne alkener, der er konjugeret til carbonylgrupper.

MO teori er meget nyttig til at forklare, hvorfor organiske molekyler, der indeholder udvidede systemer af konjugerede pi-bindinger, ofte har karakteristiske farver. beta-caroten, forbindelsen ansvarlig for den orange farve af gulerødder, har et udvidet system med 11 konjugerede pi-bindinger.

øvelser
øvelse 2.9: Identificer alle konjugerede og isolerede dobbeltbindinger i nedenstående strukturer. For hvert konjugeret pi-system skal du angive antallet af overlappende p-orbitaler, og hvor mange pi-elektroner der deles mellem dem.
øvelse 2.10: Identificer alle isolerede og konjugerede pi-bindinger i lycopen, den rødfarvede forbindelse i tomater. Hvor mange pi-elektroner er indeholdt i det konjugerede pi-system?

Leave a Reply