Phosphofructokinase (PFK)
indhold
- 1 Introduktion
- 2 rolle i glykolyse
- 3 mekanisme og regulering af Phosphofructokinase
- 4 regulering
- 5 konformationsændringer i en dimerisk enhed af PFK
- 6 de største konformationsændringer i en dimerisk enhed af PFK
- 6 underenhed af PFK.
- 7 site-Directed Mutagenesis
- 8 sygdom
- 9 3D strukturer af PFK
introduktion
Phosphofructokinase-1 (PFK-1) er et glykolytisk middel, der katalyserer overførslen af en phosphorylgruppe fra til til udbytte og . Se Glykolyse. Mg2+ er også vigtig i denne reaktion (). Phosphofructokinase-2 (PFK-2) Virker på de samme substrater for at give ADP og . . PFK-reaktion er stærkt eksergonisk (irreversibel) under fysiologiske forhold og er derfor en af den glykolytiske vejs hastighedsbestemmende trin. Dens aktivitet styres af koncentrationerne af et usædvanligt stort antal metabolitter, herunder ATP, ADP, AMP, PEP og fructose-2,6-bisphosphat.
er en tetramer af identiske 320-rest-underenheder. Det er et allosterisk middel, der beskrives ved hjælp af symmetrimodellen for allosterisme, hvorved der er en samordnet overgang fra dens højaktivitet r-tilstand til dens Lavaktivitet T-tilstand. Røntgenstrukturer af både R-og T-tilstande er blevet rapporteret. Bindingen af et molekyle af dets substrat F6P, der binder til R-tilstandsen med høj affinitet, men til T-tilstandsen med lav affinitet, får PFK til at optage R-tilstanden, hvilket igen øger bindingsaffiniteten af F6P for yderligere F6P (en homotropisk virkning). Aktivatorer, såsom ADP og AMP binder til såkaldte allosteriske steder, bindingssteder, der adskiller sig fra det aktive sted, hvor de ligeledes letter dannelsen af R-tilstanden og dermed aktiverer f.eks. På samme måde binder inhibitorer såsom PEP til allosteriske steder (som i tilfælde af PFK overlapper det aktiverende allosteriske sted), hvor de fremmer dannelsen af T-tilstanden og derved hæmmer f.eks. to af de aktive steder er placeret ved grænsefladen af med de aktive stedgrænseflader i magenta med substraterne i cyan. To mere aktive steder er ved grænsefladen mellem underenheder B (grøn) og C (lyserød). Et nærbillede af af underenhed D (gul) viser, at aminosyrer fra begge underenheder A (lyseblå) og D (Gul) bidrager til bindingen af F6P. to af de allosteriske steder er placeret ved grænsefladen af og to ved grænsefladen af underenheder C og D. igen er grænsefladerne magenta med den allosteriske ligand i cyan. Et nærbillede af af underenhed a viser bidrag fra begge underenheder til binding af ADP. De konformationsændringer i at gå mellem R-og T-tilstandene i PFK er illustreret nedenfor.
atomkoordinaterne for R-tilstand PFK blev opnået fra 4pfk; dem til T-tilstand PFK blev opnået fra Philip Evans, MRC Laboratory of Molecular Biology, Cambridge, UK, men er nu tilgængelige som 6pfk.
rolle i glykolyse
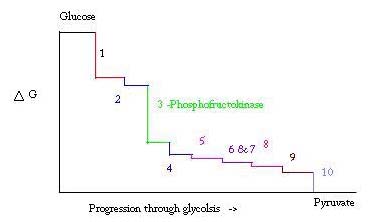
glykolyse er processen til fremstilling og nedbrydning af glukose til fremstilling af pyrodruesyre, som anvendes i anaerob respiration eller som en af udgangsreaktanterne i citronsyrecyklussen. Tre punkter i glykolyseprocessen forekommer med en stor negativ fri energi og er derfor irreversible. Disse tre punkter er geksokinase, phosphofructokinase og pyruvatkinase; af disse tre PFK betragtes som det vigtigste regulatoriske punkt for glykolyse i muskler med en larg= -25,9 kJ/mol.
mekanisme og regulering af Phosphofructokinase
Phosphofructokinase binder både Mg2+-ATP og fructose-6-phosphat (F6P) til fremstilling af fructose-1,6-bisphosphat og Mg2+-ADP. Selvom billedet med begge disse produkter ikke er bestemt, har bundet til det været. Der er tre ligandbindingssteder pr. To udgør det aktive sted, der binder F6P og ATP, mens det tredje er et allosterisk bindingssted. Nogle foreslåede rester involveret på det aktive sted inkluderer . PFK findes i to konformationstilstande, begge og som er i ligevægt. ATP binder både aktive og allosteriske steder i begge konformationer. Mens ATP binder det aktive sted lige godt, binder det fortrinsvis det allosteriske sted i T-tilstanden denne præferencebinding forårsager et skift fra ligevægt mellem de to tilstande til en større mængde T-tilstand , hvilket nedsætter affiniteten for F6P. binder også til allosterisk sted for at øge forholdet mellem r-tilstandsfosfofructokinase. Sammen med ADP,AMP og F2 hæmmer 6P ATP ‘ s regulerende rolle. PFK ‘ S Km for ATP er .020mM og .032mm.
regulering
glykolyse er en væsentlig metabolisk proces for overlevelse. Derfor skal det i sin aktivering og undertrykkelse være stærkt reguleret. Tre punkter i glykolyseprocessen forekommer med en stor negativ fri energi og er derfor irreversible. Disse tre punkter er geksokinase, phosphofructokinase og pyruvat kinase. Disse tre reaktioner er kandidater til at være de vigtigste reguleringspunkter på grund af deres høje negative frie energier. Af de tre betragtes PFK som det vigtigste reguleringspunkt for glykolyse (#3 på billedet nedenfor) i muskel med en larg= -25,9 kJ/mol, fordi det er et engageret trin. Når PFK konverterer F6P til F1,6P, vil reaktionen ikke let vendes på grund af den høje mængde energi, der skal overvindes for at gå baglæns. . Denne energibarriere giver mening, da pyruvatkinase katalyserer den endelige reaktion (#10), og geksokinase (#1) overhovedet ikke er involveret i glykolyse, når processen påbegyndes fra glykogen.
PFK er reguleret af ATP, AMP og ADP. Mens ATP binder på det aktive sted lige godt i både R-og T-tilstande, binder det fortrinsvis det allosteriske sted i T-tilstanden denne præferencebinding forårsager et skift fra ligevægt mellem de to tilstande til en større mængde T-tilstand, hvilket nedsætter affiniteten for F6P. allosterisk aktivator ADP binder også til det allosteriske sted for at øge forholdet mellem r-tilstandsfosfofructokinase. Som det fremgår af nedenstående graf, er plottene for aktiviteten af PFK sigmoidale. Det viser endvidere, at der er tale om et samarbejde. Den oprindelige binding af substratet er vanskelig, men når det først er bundet og tvinger tilstandsændringen fra T -> R, binder de andre substrater meget lettere. Grafen viser også, at tilføjelse af ATP bevæger plottet til højre (dvs.mindsker affiniteten for F6P), mens tilføjelse af AMP flytter den til venstre.
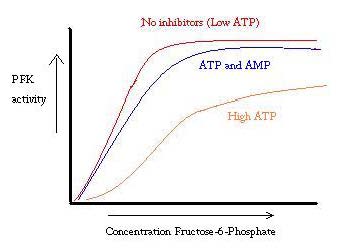
reguleringssystemet passer godt sammen med PFK ‘ s funktion. Når PFK er aktiv, produceres ATP nedstrøms fra det, da yderligere produkter nedbrydes mere fuldstændigt. Når ATP-niveauerne således er lave, og der skal gøres mere, øges aktiviteten af PFK, fordi ADP vil være i høj koncentration. Det modsatte gælder også, fordi høj ATP-koncentration hæmmer proteinaktivitet. Og alligevel kan denne forklaring ikke helt redegøre for reguleringen af PFK, fordi niveauerne af ATP ikke varierer meget nok mellem aktive og hvilende muskler. Et andet middel til allosterisk regulering skal findes.
PFK S Km for ATP er .020mM og .032mM.
denne Kinemage-øvelse består af to kinemage-scener, der illustrerer nogle af de allosterisk inducerede konformationsændringer, der forekommer i PFK fra Bacillus stearothermophilus.
konformationsændringer i en dimerisk enhed af PFK
denne kinemage viser de to underenheder af tetramer, hvis grænseflade indeholder to aktive steder. (KineMage understøttes i øjeblikket ikke) den første visning, 1: PFK dimer, viser de to underenheder i deres R-tilstandskonformation som repræsenteret af deres Ca-rygrad med underenhed 1 i lyserød farvetone og underenhed 2 i lyserød. To sidekæder i hver underenhed er vist, dem af Glu 161 (rød) og Arg 162(cyan), som er en del af F6P-bindingsstedet i T-og R-tilstandene, srespectivt (se nedenfor). En F6P (hotpink) og en ADP (grøn; “ADP-aktiv”) er bundet på det aktive sted for hver underenhed. En yderligere ADP (gul; “ADP-allo”) er bundet i et separat såkaldt allosterisk sted for hver underenhed. ADP ‘ erne har hver en tilknyttet Mg2+, som her er repræsenteret af en kugle i samme farve som den ADP, som den binder til.
Klik på knappen” animer ” for at skifte dimer mellem dens r-og T-tilstande. I T-tilstand er underenhed 1 bluetint, og underenhed 2 er skyblue. Sidekæderne af Glu 161 og Arg 162 i begge underenheder er røde og cyan som før (kun Ca-og Cb-atomerne i Arg 162-sidekæden i underenhed 1 observeres i Røntgenstrukturen i T-tilstanden; de af underenhed 2 observeres alle). “PGC”), en ikke-fysiologisk analog af det glycolytiske mellemliggende phosphoenolpyruvat (PEP). Bemærk, at bindingsstedet for PGC i T-tilstand overlapper det allosteriske bindingssted for ADP i R-tilstand (“ADP-allo”), og at deres binding derfor udelukker hinanden. T-statens aktive steder, som ikke indeholder F6P, er markeret med” ghost”F6Ps (grå;” F6P site”), som har de samme positioner som F6Ps i R-tilstand.
den anden visning, 2: Allo/Act Sites, er et nærbillede af den øverste del af den første visning, der viser både det aktive sted og det allosteriske sted i denne region. Bemærk, at det aktive sted er placeret ved grænsefladen mellem to underenheder, og at det allosteriske sted interagerer direkte med det aktive sted på den tilstødende underenhed. Sammenlign konformationerne R-tilstand og T-tilstand ved at vise begge på en gang eller klikke på “animere”. Kan du identificere Mg2+ ion forbundet med hver af ADP ‘ erne bundet til R-tilstanden? Hvilke ADP-atomer koordinerer disse Mg2 + ioner?
phosphatgruppen af PGC binder til det allosteriske sted i T-tilstand i næsten samme position, som beta-phosphatgruppen af “ADP-allo” binder til R-tilstandsallosteriske sted; begge phosphatgrupper binder til sidekæderne af de samme tre rester (2 arg og 1 Lys; ikke vist).
i R-tilstand med høj aktivitet danner den positivt ladede sidekæde af Arg 162 en hydrogenbundet saltbro med den negativt ladede 6-phosphatgruppe af F6P (hvide stiplede linjer), en interaktion, der formodentlig stabiliserer R-tilstanden i forhold til T-tilstanden og derfor delvis er ansvarlig for F6PS homotropiske virkning.
De største konformationsændringer i en underenhed af PFK.
denne KINEMAGE viser disse segmenter nær det allosteriske sted (rester 53-60 er ikke vist her). Som i KINEMAGE 1 er polypeptidet repræsenteret ved dets Ca-kæde med R-tilstandsunderenheder 1 og 2 i rødfarve og lyserød og T-tilstandsunderenheder 1 og 2 i bluetint og skyblue. (KineMage understøttes i øjeblikket ikke)KINEMAGE 2 kommer op i betragtning 1: Det allosteriske sted, i R-tilstand, der viser fosfatgruppen af F6P (hotpink) bundet i det aktive sted i en hydrogenbundet saltbro (stiplede hvide linjer) med sidekæden af Arg 162 (cyan). En ADP (gul; “ADP-allo”) indtager det tilstødende allosteriske sted. Klik en gang på “animer” for at skifte til T-tilstand. Dette erstatter ADP i R-tilstand allosterisk sted med inhibitor og PEP analog PGC (guld). F6P indtager ikke længere det aktive sted, men dets position i R-tilstand er angivet med “ghost” F6P (grå; set ved at klikke på “F6P site”).
Hvad sker der med det centrale polypeptid spiralformede segment (rester 149-164) i r til T-overgangen? Hvad gør dette med de relative positioner for den negativt ladede Glu 161 og den positivt ladede Arg 162? Klik på”F6P site”. Hvilken indflydelse ville fraværet af den positive ladning af Arg 162 have på bindingen af F6P? Forklarer dette, i det mindste delvist, hvorfor T state PFK har lav affinitet for F6P? Gå til visning 2: Closeup, for et nærbillede af F6P-sidechain interaktioner. Centrer molekylerne ved at vælge “pickcenter” i menuen “Værktøjer” og klikke på atomet, du gerne vil være i midten. Skub skyderen” Forstør ” for at forstørre visningen.
Stedstyret mutagenese
på et tidspunkt blev den negative ladning af Glu 161 antaget at have en negativ effekt på F6P-binding i T-tilstand. Denne ide er ikke blevet understøttet af stedstyrede mutageneseforsøg. Flere mutante PFC ‘ er er blevet lavet, herunder R162A, E161A og R162A/E161A. R162A-mutationen forårsagede et 30 gange fald i F6P-binding. E161a-mutationen havde imidlertid ringe effekt på PEP ‘ s evne til at hæmme F6P-binding.
sygdom
arvelige erythrocytter PFK-mangel er forbundet med myopati og hæmolyse (Tarui sygdom).
3D-strukturer af PFK
Phosphofructokinase 3D-strukturer
Leave a Reply