Skurcz mięśni

>
u kręgowców wyróżnia się trzy rodzaje tkanek mięśniowych: szkieletową, gładką i sercową. Mięśnie szkieletowe stanowią większość masy mięśniowej w organizmie i odpowiadają za aktywność ruchową. Mięśnie gładkie tworzą naczynia krwionośne, przewód pokarmowy i inne obszary ciała, które wytwarzają trwałe skurcze. Mięsień sercowy tworzą serce, które pompuje krew. Mięśnie szkieletowe i sercowe nazywane są mięśniami prążkowanymi ze względu na ich Prążkowany wygląd pod mikroskopem, co jest spowodowane wysoce zorganizowanym naprzemiennym wzorem pasm a i I.
mięśnie szkieletowe

z wyjątkiem odruchów, wszystkie skurcze mięśni szkieletowych występują w wyniku świadomego wysiłku pochodzącego z mózgu. Mózg wysyła sygnały elektrochemiczne przez układ nerwowy do neuronu ruchowego, który unerwia kilka włókien mięśniowych. W przypadku niektórych odruchów sygnał do skurczu może pochodzić z rdzenia kręgowego poprzez pętlę sprzężenia zwrotnego z istotą szarą. Inne działania, takie jak poruszanie się, oddychanie i żucie, mają dla nich odruchowy aspekt: skurcze mogą być inicjowane zarówno świadomie, jak i nieświadomie.
połączenie nerwowo-Mięśnioweedit

połączenie nerwowo-mięśniowe to Synapsa chemiczna utworzona przez kontakt neuronu ruchowego z włóknem mięśniowym. Jest to miejsce, w którym neuron ruchowy przesyła sygnał do włókna mięśniowego, aby zainicjować skurcz mięśni. Sekwencja zdarzeń, które skutkują depolaryzacją włókna mięśniowego w złączu nerwowo-mięśniowym, rozpoczyna się, gdy potencjał czynnościowy jest inicjowany w ciele komórkowym neuronu ruchowego, który jest następnie propagowany przez przewodnictwo solne wzdłuż jego aksonu w kierunku złącza nerwowo-mięśniowego. Gdy dotrze do końcowego butonu, potencjał czynnościowy powoduje napływ jonów Ca2 +
do terminalu za pomocą ogrodzonych napięciem kanałów wapniowych. Napływ Ca2 +
powoduje, że pęcherzyki synaptyczne zawierające neuroprzekaźnik acetylocholinę łączą się z błoną osocza, uwalniając acetylocholinę do szczeliny synaptycznej między terminalem neuronu ruchowego a węzłem nerwowo-mięśniowym włókna mięśni szkieletowych. Acetylocholina dyfunduje przez synapsę i wiąże się z nikotynowymi receptorami acetylocholiny i aktywuje je na złączu nerwowo-mięśniowym. Aktywacja receptora nikotynowego otwiera jego wewnętrzny kanał sodowo-potasowy, powodując napływ sodu i odpływ potasu. W rezultacie sarcolemma odwraca polaryzację, a jego napięcie szybko przeskakuje z potencjału membrany spoczynkowej – 90mV do tak wysokiego, jak +75mV w momencie wejścia sodu. Potencjał błonowy staje się hiperpolaryzowany, gdy potas wychodzi, a następnie jest regulowany z powrotem do potencjału błonowego spoczynkowego. Ta gwałtowna fluktuacja nazywana jest potencjałem płytki końcowej napięciowo bramkowane kanały jonowe sarcolemmy obok płytki końcowej otwarte w odpowiedzi na potencjał płytki końcowej. Są one specyficzne dla sodu i potasu i umożliwiają tylko jedno przejście. Ta fala ruchów jonów tworzy potencjał działania, który rozprzestrzenia się z płyty końcowej silnika we wszystkich kierunkach. Jeśli potencjały działania przestają przybywać, acetylocholina przestaje być uwalniana z końcowego butonu. Pozostała acetylocholina w rozszczepieniu synaptycznym jest albo rozkładana przez aktywną esterazę acetylocholiny, albo ponownie wchłaniana przez gałkę synaptyczną i żadna z nich nie zastąpi zdegradowanej acetylocholiny.
sprzężenie pobudzająco-skurczoweedit
sprzężenie pobudzająco–skurczowe to proces, w którym potencjał czynnościowy mięśni we włóknach mięśniowych powoduje kurczenie się miofibryli. W mięśniach szkieletowych sprzęganie pobudzająco–skurczowe polega na bezpośrednim sprzężeniu między kluczowymi białkami, kanałem uwalniającym wapń z retikulum sarkoplazmatycznego (SR) (zidentyfikowanym jako receptor ryanodine, RyR) i bramkowanymi napięciem kanałami wapniowymi typu L (zidentyfikowanymi jako receptory dihydropirydyny, DHPRs). DHPRs znajdują się na sarcolemmie (która obejmuje sarcolemmę powierzchniową i kanaliki poprzeczne), podczas gdy RyRs znajdują się w całej błonie SR. Bliskie przyleganie kanalika poprzecznego i dwóch regionów SR zawierających RyRs jest opisane jako Triada i jest głównie tam, gdzie zachodzi sprzężenie wzbudzenie–skurcz. Połączenie pobudzenia-skurczu występuje, gdy depolaryzacja komórek mięśni szkieletowych powoduje potencjał działania mięśni, który rozprzestrzenia się na powierzchni komórki i do sieci włókien mięśniowych kanalików T, depolaryzując w ten sposób wewnętrzną część włókna mięśniowego. Depolaryzacja wewnętrznych części aktywuje receptory dihydropirydyny w końcowych cysternach, które znajdują się w pobliżu receptorów ryanodiny w sąsiednim retikulum sarkoplazmatycznym. Aktywowane receptory dihydropirydyny fizycznie oddziałują z receptorami ryanodine, aby aktywować je poprzez procesy stóp (obejmujące zmiany konformacyjne, które allosterycznie aktywują receptory ryanodine). Gdy receptory ryanodine otwierają się, Ca2+jest uwalniany z retikulum sarkoplazmatycznego do lokalnej przestrzeni łączeniowej i dyfunduje do cytoplazmy luzem, powodując iskrę wapniową. Zauważ, że retikulum sarkoplazmatyczne ma dużą zdolność buforowania wapnia częściowo z powodu białka wiążącego wapń zwanego calsequestrin. Prawie synchroniczna aktywacja tysięcy iskier wapnia przez potencjał czynnościowy powoduje wzrost wapnia w całej komórce, powodując wzrost przemijania wapnia. Ca2 +
uwalniany do cytozolu wiąże się z troponiną C przez włókna aktyny, aby umożliwić cykl krzyżowy, wytwarzając siłę i, w niektórych sytuacjach, ruch. Siatka wapniowo-Atpazowa Sarco / endoplasmic reticulum (serce) aktywnie pompuje Ca2+
z powrotem do siateczki sarkoplazmatycznej. Gdy Ca2+
spada z powrotem do poziomu spoczynkowego, Siła spada i następuje relaksacja.
teoria włókien Ślizgowychedit

teoria włókien ślizgowych opisuje proces używany przez mięśnie do kurczenia się. Jest to cykl powtarzających się zdarzeń, które powodują, że cienkie włókno przesuwa się po grubym włóknie i generuje napięcie w mięśniu. Został opracowany niezależnie przez Andrew Huxleya i Rolfa Niedergerke oraz przez Hugh Huxleya i Jeana Hansona w 1954 roku. Fizjologicznie skurcz ten nie jest jednolity w całym sarcomere; centralne położenie grubych włókien staje się niestabilne i może się zmieniać podczas skurczu. Jednakże zakłada się, że działanie elastycznych białek, takich jak titin, ma na celu utrzymanie równomiernego napięcia w całym sarkomerze i przyciągnięcie grubego włókna do centralnej pozycji.
crossbridge cyclingEdit

crossbridge cycling jest sekwencją zdarzeń molekularnych, które leżą u podstaw teorii włókien ślizgowych. Mostek poprzeczny to rzut miozyny, składający się z dwóch głowic miozyny, który rozciąga się od grubych włókien. Każda głowa miozyny ma dwa miejsca wiązania: jeden dla ATP i drugi dla aktyny. Wiązanie ATP z główką miozyny oddziela miozynę od aktyny, umożliwiając Wiązanie miozyny z inną cząsteczką aktyny. Po przyłączeniu ATP jest hydrolizowany przez miozynę, która wykorzystuje uwolnioną energię do poruszania się w „pozycji cocked”, przy czym wiąże się słabo z częścią miejsca wiązania aktyny. Pozostałą część miejsca wiązania aktyny blokuje tropomiozyna. Przy hydrolizie ATP, zakotwiczona Głowa miozyny zawiera teraz ADP + Pi . Dwa jony Ca2+
wiążą się z troponiną C na włóknach aktyny. Kompleks troponin-Ca2 +
powoduje przesuwanie się tropomiozyny i odblokowywanie pozostałej części miejsca wiązania aktyny. Odblokowanie pozostałych miejsc wiązania aktyny umożliwia zamknięcie dwóch głowic miozyny i silne wiązanie miozyny z aktyną. Głowica miozyny następnie uwalnia nieorganiczny fosforan i inicjuje skok mocy, który generuje siłę 2 pN. Skok mocy przesuwa żarnik aktyny do wewnątrz, skracając w ten sposób sarkomere. Miozyna następnie uwalnia ADP, ale nadal pozostaje ściśle związana z aktyną. Pod koniec udaru, ADP jest uwalniany z głowy miozyny, pozostawiając miozynę przyłączoną do aktyny w stanie sztywności, dopóki inny ATP nie wiąże się z miozyną. Brak ATP spowodowałby stan rigor charakterystyczny dla Rigor mortis. Gdy kolejny ATP wiąże się z miozyną, Głowica miozyny ponownie odłączy się od aktyny i nastąpi kolejny cykl krzyżowy.
Kolarstwo krzyżowe jest w stanie kontynuować tak długo, jak długo w cytoplazmie znajdują się wystarczające ilości ATP i Ca2+. Zakończenie cyklu krzyżowego może wystąpić, gdy Ca2+
jest aktywnie pompowany z powrotem do retikulum sarkoplazmatycznego. Gdy Ca2 +
nie jest już obecny na cienkim włóknie, tropomiozyna zmienia konformację z powrotem do swojego poprzedniego stanu, aby ponownie zablokować miejsca wiązania. Miozyna przestaje wiązać się z cienkim włóknem, a mięśnie rozluźniają się. Jony Ca2+
opuszczają cząsteczkę troponiny w celu utrzymania stężenia jonów Ca2+
w sarkoplazmie. Aktywne pompowanie jonów Ca2 +
do retikulum sarkoplazmatycznego powoduje niedobór płynu wokół miofibryli. Powoduje to usunięcie jonów Ca2 +
z troponiny. W ten sposób kompleks tropomiozyny-troponiny ponownie obejmuje miejsca wiązania włókien aktyny i ustaje skurcz.
Stopniowanie skurczów mięśni szkieletowych
siłę skurczów mięśni szkieletowych można zasadniczo podzielić na skurcze, sumowanie i tężec. Drganie to pojedynczy cykl skurczu i relaksacji wytwarzany przez potencjał działania w samym włóknie mięśniowym. Czas między bodźcem do nerwu ruchowego a kolejnym skurczem unerwionego mięśnia nazywa się okresem utajonym, który zwykle trwa około 10 ms i jest spowodowany czasem potrzebnym na propagację potencjału działania nerwu, czasem transmisji chemicznej w złączu nerwowo-mięśniowym, a następnie kolejnymi etapami sprzężenia pobudzająco-skurczowego.
Jeśli inny potencjał działania mięśni miałby zostać wytworzony przed całkowitym rozluźnieniem skurczu mięśni, to następny skurcz po prostu zsumuje się na poprzedni skurcz, tworząc w ten sposób sumację. Sumowanie można osiągnąć na dwa sposoby: sumowanie częstotliwości i sumowanie wielu włókien. W sumowaniu częstotliwości siła wywierana przez mięsień szkieletowy jest kontrolowana przez zmianę częstotliwości, z jaką potencjały działania są wysyłane do włókien mięśniowych. Potencjały działania nie docierają do mięśni synchronicznie, a podczas skurczu pewna część włókien w mięśniu będzie wypalana w danym momencie. W typowych okolicznościach, kiedy ludzie wywierają swoje mięśnie tak mocno, jak świadomie są w stanie, około jedna trzecia włókien w każdym z tych mięśni odpala się jednocześnie, chociaż na ten stosunek mogą wpływać różne czynniki fizjologiczne i psychologiczne (w tym narządy ścięgien Golgiego i komórki Renshawa). Ten „niski” poziom skurczu jest mechanizmem ochronnym zapobiegającym zerwaniu ścięgna—Siła generowana przez 95% skurcz wszystkich włókien jest wystarczająca do uszkodzenia ciała. W sumowaniu wielu włókien, jeśli centralny układ nerwowy wysyła słaby sygnał do skurczu mięśnia, mniejsze jednostki motoryczne, będąc bardziej pobudliwe niż większe, są stymulowane jako pierwsze. Wraz ze wzrostem siły sygnału, więcej jednostek silnikowych jest wzbudzanych oprócz większych, przy czym największe jednostki silnikowe mają aż 50 razy większą siłę skurczu niż mniejsze. Wraz z aktywacją coraz większych jednostek motorycznych siła skurczu mięśni staje się coraz silniejsza. Pojęcie znane jako zasada wielkości, pozwala na stopniowanie siły mięśniowej podczas słabego skurczu w małych krokach, które następnie stają się stopniowo większe, gdy wymagane są większe ilości siły.
wreszcie, jeśli częstotliwość potencjałów działania mięśni wzrasta tak, że skurcz mięśni osiąga swoją szczytową siłę i płaskość na tym poziomie, to skurcz jest tężcem.
relacja Długość-napięcie

zależność długość-napięcie odnosi się do siły skurczu izometrycznego do długości mięśnia, w którym następuje skurcz. Mięśnie działają z największym aktywnym napięciem, gdy są bliskie idealnej długości (często ich długości spoczynkowej). Po rozciągnięciu lub skróceniu poza to (czy to z powodu działania samego mięśnia, czy przez siłę zewnętrzną), maksymalne aktywne napięcie generowane zmniejsza się. Spadek ten jest minimalny dla małych odchyleń, ale napięcie spada szybko, gdy długość odbiega dalej od ideału. Ze względu na obecność elastycznych białek w komórce mięśniowej (takich jak titin) i macierzy pozakomórkowej, ponieważ mięsień jest rozciągnięty poza określoną długość, istnieje całkowicie pasywne napięcie, które sprzeciwia się wydłużaniu. W połączeniu ze sobą, istnieje silna odporność na wydłużenie aktywnego mięśni daleko poza szczyt aktywnego napięcia.
zależność Siła-prędkośćedytuj
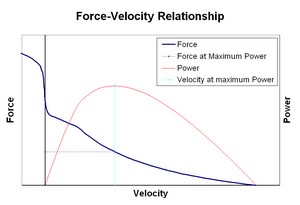
zależność siła–prędkość odnosi się do prędkości, z jaką mięsień zmienia swoją długość (Zwykle regulowaną przez siły zewnętrzne, takie jak obciążenie lub inne mięśnie) do ilości siły, którą generuje. Siła zmniejsza się w sposób hiperboliczny w stosunku do siły izometrycznej, gdy prędkość skracania wzrasta, ostatecznie osiągając zero przy pewnej maksymalnej prędkości. Odwrotność ma miejsce, gdy mięsień jest rozciągnięty – siła wzrasta powyżej maksimum izometrycznego, aż w końcu osiąga maksimum absolutne. Ta wewnętrzna właściwość aktywnej tkanki mięśniowej odgrywa rolę w aktywnym tłumieniu stawów, które są uruchamiane przez jednocześnie aktywne mięśnie przeciwstawne. W takich przypadkach profil siły-prędkości zwiększa siłę wytwarzaną przez mięsień wydłużający się kosztem mięśnia skracającego. To sprzyjanie jakiemuś mięśniowi przywraca staw do równowagi skutecznie zwiększa tłumienie stawu. Ponadto Siła tłumienia wzrasta wraz z siłą mięśni. Układ ruchowy może w ten sposób aktywnie kontrolować tłumienie stawów poprzez jednoczesne skurcz (współskurcz) przeciwstawnych grup mięśniowych.
mięśnie Gładkieedytuj
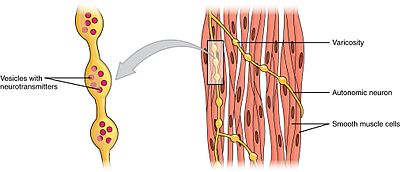
mięśnie gładkie można podzielić na dwie podgrupy: jednoczęściową (unitarną) i wieloczęściową. Pojedyncze komórki mięśni gładkich można znaleźć w jelitach i naczyniach krwionośnych. Ponieważ komórki te są połączone ze sobą złączami szczelinowymi, są w stanie kurczyć się jako syncytium. Pojedyncze komórki mięśni gładkich kurczą się miogennie, które mogą być modulowane przez autonomiczny układ nerwowy.
w przeciwieństwie do pojedynczych komórek mięśni gładkich, wieloczęściowe komórki mięśni gładkich znajdują się w mięśniach oka i w podstawie mieszków włosowych. Wieloczęściowe komórki mięśni gładkich kurczą się poprzez oddzielną stymulację nerwów autonomicznego układu nerwowego. Jako takie pozwalają na precyzyjną kontrolę i stopniowe reakcje, podobnie jak rekrutacja jednostek motorycznych w mięśniach szkieletowych.
mechanizmy skurczu mięśni gładkich
na skurczową aktywność komórek mięśni gładkich wpływa wiele wejść, takich jak spontaniczna aktywność elektryczna, wejścia neuronowe i hormonalne, lokalne zmiany w składzie chemicznym i rozciąganie. Jest to w przeciwieństwie do kurczliwej aktywności komórek mięśni szkieletowych, która opiera się na pojedynczym wejściu neuronowym. Niektóre typy komórek mięśni gładkich są w stanie spontanicznie generować własne potencjały działania, które zwykle występują po potencjale rozrusznika serca lub potencjale powolnej fali. Te potencjały działania są generowane przez napływ zewnątrzkomórkowego Ca2+
, a nie Na +
. Podobnie jak mięśnie szkieletowe, cytozolowe jony Ca2 +
są również wymagane do rowkowania krzyżowego w komórkach mięśni gładkich.
dwa źródła Cytozolicznego Ca2+
w komórkach mięśni gładkich to zewnątrzkomórkowy Ca2+
wchodzący przez kanały wapniowe i jony Ca2+
uwalniane z retikulum sarkoplazmatycznego. Zwiększenie stężenia Cytozolicznego Ca2+
powoduje większe Wiązanie Ca2+
z kalmoduliną, która następnie wiąże się i aktywuje kinazę łańcucha lekkiego miozyny. Kompleks kinazy łańcuchów lekkich wapń-kalmodulina-miozyna fosforyluje miozynę na łańcuchach lekkich 20 kilodalton (kDa) miozyny na pozostałościach aminokwasowych-serynę 19, inicjując skurcz i aktywując Atpazę miozyny. W przeciwieństwie do komórek mięśni szkieletowych, komórkom mięśni gładkich brakuje troponiny, mimo że zawierają one troponinę z cienkiego włókna oraz inne znaczące białka-kaldesmon i kalponinę. Tak więc, skurcze mięśni gładkich są inicjowane przez aktywowaną fosforylację miozyny Ca2+zamiast wiązania Ca2+z kompleksem troponiny, który reguluje miejsca wiązania miozyny na aktynie, jak w mięśniach szkieletowych i sercowych.
zakończenie cyklu krzyżowego (i pozostawienie mięśnia w stanie zatrzasku) następuje, gdy fosfataza lekkiego łańcucha miozyny usuwa grupy fosforanowe z głowic miozyny. Fosforylacja łańcuchów lekkich 20 kDa miozyny dobrze koreluje ze skracaniem prędkości mięśni gładkich. W tym okresie następuje gwałtowny wzrost zużycia energii mierzonego zużyciem tlenu. W ciągu kilku minut od rozpoczęcia poziom wapnia znacznie spada, fosforylacja łańcuchów lekkich miozyny o mocy 20 kDa zmniejsza się, a wykorzystanie energii zmniejsza się; jednak siła w tonicznym mięśniu gładkim jest utrzymywana. Podczas skurczu mięśni szybko powstają krzyżówki między aktywowaną aktyną a fosforylowaną miozyną, generując siłę. Istnieje hipoteza, że utrzymanie siły wynika z defosforylowanych „mostków zatrzaskowych”, które powoli cyklują i utrzymują siłę. Uważa się, że szereg kinaz, takich jak kinaza rho, DAPK3 i kinaza białkowa C, bierze udział w trwałej fazie skurczu, a strumień Ca2+
może być znaczący.
Neuromodulacjaedit
chociaż skurcze mięśni gładkich są miogenne, szybkość i siła ich skurczów może być modulowana przez autonomiczny układ nerwowy. Postganglionowe włókna nerwowe przywspółczulnego układu nerwowego uwalniają neuroprzekaźnik acetylocholinę, który wiąże się z muskarynowymi receptorami acetylocholiny (mAChRs) na komórkach mięśni gładkich. Receptory te są metabotropowe lub receptory sprzężone z białkiem G, które inicjują kaskadę drugiego Posłańca. Odwrotnie, postganglionowe włókna nerwowe współczulnego układu nerwowego uwalniają neuroprzekaźniki epinefryny i norepinefryny, które wiążą się z receptorami adrenergicznymi, które są również metabotropowe. Dokładny wpływ na mięsień gładki zależy od specyficznych cech aktywowanego receptora – zarówno wejście przywspółczulne, jak i współczulne mogą być pobudzające (kurczliwe) lub hamujące (relaksujące).
mięsień sercowy

istnieją dwa typy komórek mięśnia sercowego: autorytmiczne i skurcz. Komórki autorytmiczne nie kurczą się, ale zamiast tego wyznaczają Tempo skurczu dla innych komórek mięśnia sercowego, które mogą być modulowane przez autonomiczny układ nerwowy. Natomiast kurczliwe komórki mięśniowe (kardiomiocyty) stanowią większość mięśnia sercowego i są w stanie się kurczyć.
sprzężenie pobudzająco-skurczoweedit
zarówno w mięśniach szkieletowych, jak i sercowych dochodzi do sprzężenia pobudzająco-skurczowego (E-C), przewodnictwa depolaryzacyjnego i procesów uwalniania Ca2+. Jednakże, chociaż zaangażowane białka są podobne, różnią się strukturą i regulacją. Receptory dihydropirydynowe (DHPRs) są kodowane przez różne geny, a receptory ryanodynowe (RyRs) są odrębnymi izoformami. Poza tym, kontakty DHPR z RyR1 (główną izoformą RyR w mięśniu szkieletowym) w celu regulacji uwalniania Ca2+ w mięśniu szkieletowym, podczas gdy kanał wapniowy typu L (DHPR na miocytach sercowych) i RyR2 (główną izoformą RyR w mięśniu sercowym) nie są fizycznie sprzężone w mięśniu sercowym, ale spotykają się ze sobą za pomocą sprzężenia łącznikowego.
w przeciwieństwie do mięśni szkieletowych, uważa się, że sprzęganie E-C w mięśniu sercowym zależy głównie od mechanizmu zwanego indukowanym wapniem uwalnianiem wapnia, który opiera się na strukturze łączącej między kanalikiem T a siateczką sarkoplazmatyczną. Junctophilin – 2 (JPH2) jest niezbędny do utrzymania tej struktury, a także integralności kanalika T. Inne białko, białko pomocnicze receptora 5 (REEP5), działa w celu utrzymania prawidłowej morfologii złączowego SR. defekty złączowego sprzężenia mogą wynikać z niedoborów jednego z dwóch białek. Podczas procesu indukowanego wapniem uwalniania wapnia, RyR2s są aktywowane przez wyzwalacz wapnia, który jest spowodowany przepływem Ca2+ przez kanały wapniowe typu L. Następnie mięsień sercowy ma tendencję do wykazywania struktur diad (lub dyad), a nie Triad.
sprzężenie pobudzająco-skurczowe w komórkach mięśnia sercowego występuje, gdy potencjał czynnościowy jest inicjowany przez komórki rozrusznika serca w węźle zatokowo-przedsionkowym lub węźle przedsionkowo-komorowym i prowadzony do wszystkich komórek serca przez węzły szczelinowe. Potencjał czynnościowy przemieszcza się wzdłuż błony powierzchniowej do kanalików T (te ostatnie nie są widoczne we wszystkich typach komórek serca), a depolaryzacja powoduje, że zewnątrzkomórkowy Ca2+
dostaje się do komórki przez kanały wapniowe typu L i prawdopodobnie wymiennik sodowo-wapniowy (NCX) we wczesnej części fazy plateau. Chociaż ten napływ Ca2+ liczy się tylko dla około 10% Ca2+ potrzebnego do aktywacji, jest stosunkowo większy niż w przypadku mięśni szkieletowych. Ten napływ Ca2+
powoduje niewielki lokalny wzrost wewnątrzkomórkowego Ca2+
. Wzrost wewnątrzkomórkowego Ca2+
jest wykrywany przez RyR2 w błonie retikulum sarkoplazmatycznego, który uwalnia Ca2+
w pozytywnej odpowiedzi fizjologicznej sprzężenia zwrotnego. To pozytywne sprzężenie zwrotne jest znane jako indukowane wapniem uwalnianie wapnia i powoduje powstawanie iskier wapnia (iskry Ca2+
). Przestrzenne i czasowe sumowanie ~ 30 000 Ca2+
sparks daje wzrost cytoplazmatycznego stężenia wapnia w całej komórce. Wzrost cytozolicznego wapnia po przepływie wapnia przez błonę komórkową i retikulum sarkoplazmatyczne jest moderowany przez bufory wapnia, które wiążą dużą część wewnątrzkomórkowego wapnia. W rezultacie duży wzrost całkowitego wapnia prowadzi do stosunkowo niewielkiego wzrostu wolnego Ca2 +
.
cytoplazmatyczny wapń wiąże się z troponiną C, przenosząc kompleks tropomiozyny z miejsca wiązania aktyny, umożliwiając główce miozyny Wiązanie się z włóknem aktyny. Od tego momentu mechanizm skurczowy jest zasadniczo taki sam jak w przypadku mięśni szkieletowych (powyżej). Krótko, stosując hydrolizę ATP, Głowa miozyny ciągnie włókno aktyny w kierunku środka sarkomeru.

po skurczu, wewnątrzkomórkowy wapń jest pobierany przez pompę ATPazy retikulum Sarco/endoplasmic (serce) z powrotem do retikulum sarkoplazmatycznego, gotowe do rozpoczęcia następnego cyklu. Wapń jest również wyrzucany z komórki głównie przez wymiennik sodowo-wapniowy (NCX) i, w mniejszym stopniu, membranową Atpazę wapniową osocza. Część wapnia jest również pobierana przez mitochondria. Enzym, fosfolamban, służy jako hamulec dla SERCA. Przy niskiej częstości akcji serca fosfolamban jest aktywny i spowalnia aktywność ATPazy, dzięki czemu Ca2+
nie musi całkowicie opuszczać komórki. Przy dużej częstości akcji serca fosfolamban ulega fosforylacji i dezaktywacji, W ten sposób pobierając większość Ca2+
z cytoplazmy z powrotem do retikulum sarkoplazmatycznego. Po raz kolejny, buforuje wapń umiarkowanie ten spadek stężenia Ca2+
, umożliwiając stosunkowo niewielki spadek stężenia wolnego Ca2+
w odpowiedzi na dużą zmianę całkowitego wapnia. Spadające stężenie Ca2 +
pozwala kompleksowi troponiny dysocjować z włókna aktyny, kończąc tym samym skurcz. Serce rozluźnia się, pozwalając komorom wypełnić się krwią i ponownie rozpocząć cykl sercowy.
Leave a Reply