15.3: Physical Properties of Carboxylic Acids
Learning Objectives
- Compare the boiling points of carboxylic acids with alcools of similar molar mass.Compare as solubilidades dos ácidos carboxílicos em água com as solubilidades de alcanos e álcoois comparáveis em água.muitos ácidos carboxílicos são líquidos incolor com odores desagradáveis. Os ácidos carboxílicos com 5 a 10 átomos de carbono todos têm odores “gordurosos” (explicando o odor do queijo Limburger). Estes ácidos também são produzidos pela ação de bactérias da pele no sebo humano (óleos da pele), que é responsável pelo odor de vestiários mal ventilados. Os ácidos com mais de 10 átomos de carbono são sólidos como cera, e seu odor diminui com o aumento da massa molar e consequente diminuição da volatilidade.os ácidos carboxílicos apresentam fortes ligações de hidrogénio entre moléculas. Por conseguinte, têm pontos de ebulição elevados em comparação com outras substâncias de massa molar comparável.
o grupo carboxilo envolve-se facilmente na ligação do hidrogénio com moléculas de água (figura \(\PageIndex{1}\)). Os ácidos com um a quatro átomos de carbono são completamente miscíveis com água. A solubilidade diminui à medida que o comprimento da cadeia de carbono aumenta porque as forças dipolares se tornam menos importantes e as forças de dispersão se tornam mais predominantes. O ácido hexanóico é pouco solúvel em água (cerca de 1,0 g/100 g de água). O ácido palmítico, com seu grande componente de hidrocarbonetos não-polares, é essencialmente insolúvel em água. Os ácidos carboxílicos geralmente são solúveis em solventes orgânicos como etanol, tolueno e éter dietílico.
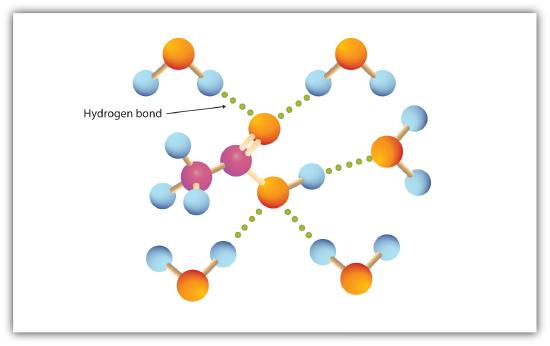
Figure \(\PageIndex{1}\): Ligação do hidrogénio entre uma molécula de ácido acético e moléculas de água. Ácidos carboxílicos de massa molar baixa são bastante solúveis em água. Table 15.4.1 lists some physical properties for selected carboxylic acids. Os primeiros seis são homólogos. Observe que os pontos de ebulição aumentam com o aumento da massa molar, mas os pontos de fusão não mostram nenhum padrão regular.
Table \(\PageIndex{1}\): Physical Constants of Carboxylic Acids Condensed Structural Formula Name of Acid Melting Point (°C) Boiling Point (°C) Solubility (g/100 g of Water) HCOOH formic acid 8 100 miscible CH3COOH acetic acid 17 118 miscible CH3CH2COOH propionic acid –22 141 miscible CH3(CH2)2COOH butyric acid –5 163 miscible CH3(CH2)3COOH valeric acid –35 187 5 CH3(CH2)4COOH caproic acid –3 205 1.1 C6H5COOH benzoic acid 122 249 0.29 Concept Review Exercises
- Which compound has the higher boiling point—butanoic acid (molar mass 88) or 2-pentanone (molar mass 86)? Explain.
- Would you expect butyric acid (butanoic acid) to be more or less soluble than 1-butanol in water? Explain.
Respostas
- ácido butírico por causa da ligação do hidrogênio (não há ligação intermolecular de hidrogênio em 2-pentanona.os ácidos carboxílicos têm pontos de ebulição elevados em comparação com outras substâncias de massa molar comparável. Os pontos de ebulição aumentam com a massa molar.ácidos carboxílicos com um a quatro átomos de carbono são completamente miscíveis com água. A solubilidade diminui com a massa molar.
exercícios
-
Qual composto tem o ponto de ebulição mais elevado-CH3CH2CH2OCH2CH3 ou CH3CH2CH2COOH? Explicar.
-
Qual composto tem o ponto de ebulição mais elevado-CH3CH2CH2CH2OH ou CH3CH2CH2COOH? Explicar.
-
Qual o composto mais solúvel em água-CH3COOH ou CH3CH2CH3? Explicar.
-
Qual o composto mais solúvel em água-CH3CH2COOH ou CH3CH2CH2CH2COOH? Explicar.
Respostas
-
CH3CH2CH2COOH por causa da ligação de hidrogênio (não Há intermoleculares ligação de hidrogênio com CH3CH2CH2OCH2CH3.)
-
CH3COOH because it engages in hydrogen bonding with water (There is no intermolecular hydrogen bonding with CH3CH2CH3.)
Leave a Reply