Muskelkontraktion

hos ryggradsdjur finns det tre typer av muskelvävnad: skelett, slät och hjärt. Skelettmuskel utgör majoriteten av muskelmassan i kroppen och är ansvarig för lokomotorisk aktivitet. Glatt muskel bildar blodkärl, mag-tarmkanalen och andra områden i kroppen som producerar långvariga sammandragningar. Hjärtmuskeln utgör hjärtat, som pumpar blod. Skelett-och hjärtmuskler kallas strimmig muskel på grund av deras randiga utseende under ett mikroskop, vilket beror på det mycket organiserade alternerande mönstret av ett band och i-band.
skelettmuskelredigera

exklusive reflexer uppträder alla skelettmuskulaturkontraktioner som ett resultat av medveten ansträngning med ursprung i hjärnan. Hjärnan skickar elektrokemiska signaler genom nervsystemet till motorneuronen som innerverar flera muskelfibrer. När det gäller vissa reflexer kan signalen att komma i kontakt härröra från ryggmärgen genom en återkopplingsslinga med den grå substansen. Andra åtgärder som rörelse, andning och tuggning har en reflexaspekt för dem: sammandragningarna kan initieras både medvetet eller omedvetet.
neuromuskulär junctionEdit

en neuromuskulär korsning är en kemisk synaps som bildas av kontakten mellan en motorneuron och en muskelfiber. Det är den plats där en motorneuron sänder en signal till en muskelfiber för att initiera muskelkontraktion. Sekvensen av händelser som resulterar i depolarisering av muskelfibrerna vid den neuromuskulära korsningen börjar när en åtgärdspotential initieras i cellkroppen hos en motorneuron, som sedan förökas genom saltatorisk ledning längs dess axon mot den neuromuskulära korsningen. När den når terminalen bouton orsakar åtgärdspotentialen en Ca2 +
joninflöde till terminalen genom de spänningsgrindade kalciumkanalerna. Ca2 +
inflödet orsakar synaptiska vesiklar som innehåller neurotransmittorn acetylkolin att smälta samman med plasmamembranet och frigöra acetylkolin i den synaptiska klyftan mellan motorneuronterminalen och den neuromuskulära korsningen av skelettmuskelfibern. Acetylkolin diffunderar över synapsen och binder till och aktiverar nikotinacetylkolinreceptorer på den neuromuskulära korsningen. Aktivering av nikotinreceptorn öppnar sin inneboende natrium / kaliumkanal, vilket får natrium att rusa in och kalium att sippra ut. Som ett resultat vänder sarcolemma polariteten och dess spänning hoppar snabbt från den vilande membranpotentialen på-90mV till så hög som +75mV som natrium kommer in. Membranpotentialen blir sedan hyperpolariserad när kalium går ut och justeras sedan tillbaka till vilande membranpotential. Denna snabba fluktuation kallas ändplattans potential de spänningsgrindade jonkanalerna i sarcolemma bredvid ändplattan öppnas som svar på ändplattans potential. De är natrium – och kaliumspecifika och tillåter bara en genom. Denna våg av jonrörelser skapar handlingspotentialen som sprider sig från motorändplattan i alla riktningar. Om åtgärdspotentialer slutar anlända upphör acetylkolin att släppas från terminalen bouton. Den återstående acetylkolin i den synaptiska klyftan bryts antingen ned av aktivt acetylkolinesteras eller återabsorberas av den synaptiska ratten och ingen lämnas för att ersätta den försämrade acetylkolin.
Excitation-contraction couplingEdit
Excitation–contraction koppling är den process genom vilken en muskulär aktionspotential i muskelfibern får myofibrillerna att dra ihop sig. I skelettmuskel är excitation–sammandragningskoppling beroende av en direkt koppling mellan nyckelproteiner, sarkoplasmatisk retikulum (SR) kalciumfrisättningskanal (identifierad som ryanodinreceptorn, RyR) och spännings gated l-typ kalciumkanaler (identifierad som dihydropyridinreceptorer, DHPRs). DHPRs är belägna på sarcolemma (som inkluderar ytan sarcolemma och de tvärgående tubulerna), medan Ryrsna ligger över SR-membranet. Den nära appositionen av en tvärgående tubule och två SR–regioner som innehåller RyRs beskrivs som en triad och är övervägande där excitation-kontraktionskoppling sker. Excitation-kontraktionskoppling uppstår när depolarisering av skelettmuskelcell resulterar i en muskelverkningspotential, som sprider sig över cellytan och in i muskelfiberns nätverk av T-tubuler och därigenom depolariserar den inre delen av muskelfibern. Depolarisering av de inre delarna aktiverar dihydropyridinreceptorer i terminalcisternae, som ligger i närheten av ryanodinreceptorer i det intilliggande sarkoplasmiska retikulumet. De aktiverade dihydropyridinreceptorerna interagerar fysiskt med ryanodinreceptorer för att aktivera dem via fotprocesser (involverar konformationella förändringar som allosteriskt aktiverar ryanodinreceptorerna). När ryanodinreceptorerna öppnas frigörs Ca2+
från sarkoplasmatisk retikulum i det lokala korsningsutrymmet och diffunderar in i bulkcytoplasman för att orsaka en kalciumgnista. Observera att sarkoplasmatisk retikulum har en stor kalciumbuffertkapacitet delvis på grund av ett kalciumbindande protein som kallas calsequestrin. Den nära synkrona aktiveringen av tusentals kalciumgnistor genom åtgärdspotentialen orsakar en cellomfattande ökning av kalcium som ger upphov till uppslaget av kalcium övergående. Ca2+
som släpps ut i cytosolen binder till Troponin C av aktinfilamenten, för att tillåta crossbridge-cykling, producera kraft och i vissa situationer rörelse. Sarco / endoplasmatisk retikulum kalcium-ATPas (SERCA) pumpar aktivt Ca2+
tillbaka in i sarkoplasmatisk retikulum. När Ca2 +
minskar tillbaka till vilande nivåer minskar kraften och avkoppling uppstår.
Sliding filament theoryEdit

den glidande filamentteorin beskriver en process som används av muskler för att komma i kontakt. Det är en cykel av repetitiva händelser som får en tunn filament att glida över en tjock filament och generera spänning i muskeln. Det utvecklades självständigt av Andrew Huxley och Rolf Niedergerke och av Hugh Huxley och Jean Hanson 1954. Fysiologiskt är denna sammandragning inte enhetlig över sarkomeren; de tjocka filamentens centrala läge blir instabil och kan skiftas under sammandragning. Åtgärderna av elastiska proteiner såsom titin antas emellertid för att upprätthålla enhetlig spänning över sarkomeren och dra det tjocka filamentet i ett centralt läge.
Crossbridge cyclingEdit

Crossbridge cycling är en sekvens av molekylära händelser som ligger till grund för den glidande filamentteorin. En crossbridge är en myosinprojektion, bestående av två myosinhuvuden, som sträcker sig från de tjocka filamenten. Varje myosinhuvud har två bindningsställen: en för ATP och en annan för aktin. Bindningen av ATP till ett myosinhuvud avlägsnar myosin från aktin, vilket gör att myosin kan binda till en annan aktinmolekyl. När ATP är fäst hydrolyseras av myosin, som använder den frigjorda energin för att flytta in i ”cocked position” varigenom den binder svagt till en del av aktinbindningsstället. Resten av aktinbindningsstället blockeras av tropomyosin. Med ATP hydrolyserad innehåller det spända myosinhuvudet nu ADP + Pi. Två Ca2 +
joner binder till troponin C på aktinfilamenten. Troponin-Ca2+
– komplexet får tropomyosin att glida över och avblockera resten av aktinbindningsstället. Genom att blockera resten av aktinbindningsställena kan de två myosinhuvudena stängas och myosin binder starkt till aktin. Myosinhuvudet frigör sedan det oorganiska fosfatet och initierar ett kraftslag, vilket genererar en kraft på 2 pN. Strömslaget flyttar aktinfilamentet inåt och förkortar därmed sarkomeren. Myosin släpper sedan ADP men är fortfarande tätt bunden till aktin. Vid slutet av effektslaget frigörs ADP från myosinhuvudet och lämnar myosin fäst vid aktin i ett strikt tillstånd tills en annan ATP binder till myosin. Brist på ATP skulle resultera i rigor state karakteristisk för rigor mortis. När en annan ATP binder till myosin, kommer myosinhuvudet igen att lossna från aktin och en annan crossbridges-cykel inträffar.
Crossbridge cykling kan fortsätta så länge det finns tillräckliga mängder ATP och Ca2+
i cytoplasman. Uppsägning av crossbridge-cykling kan inträffa när Ca2+
aktivt pumpas tillbaka in i sarkoplasmatisk retikulum. När Ca2+
inte längre finns på det tunna filamentet ändrar tropomyosin konformationen tillbaka till sitt tidigare tillstånd för att blockera bindningsställena igen. Myosin upphör att binda till det tunna filamentet, och muskeln slappnar av. Ca2+
– jonerna lämnar troponinmolekylen för att bibehålla Ca2 +
– jonkoncentrationen i sarkoplasman. Den aktiva pumpningen av Ca2 +
– joner i sarkoplasmatisk retikulum skapar en brist i vätskan runt myofibrillerna. Detta orsakar avlägsnande av Ca2+
joner från troponin. Således täcker tropomyosin-troponinkomplexet igen bindningsställena på aktinfilamenten och sammandragningen upphör.
gradering av skelettmuskelkontraktionredigera
styrkan i skelettmuskelkontraktioner kan i stort sett separeras i ryckning, summering och stelkramp. En ryckning är en enda sammandragnings-och avslappningscykel som produceras av en åtgärdspotential i själva muskelfibrerna. Tiden mellan en stimulans till motornerven och den efterföljande sammandragningen av den innerverade muskeln kallas den latenta perioden, som vanligtvis tar cirka 10 ms och orsakas av den tid det tar för nervverkningspotential att sprida sig, tiden för kemisk överföring vid den neuromuskulära korsningen, sedan de efterföljande stegen i excitation-sammandragningskoppling.
om en annan muskelhandlingspotential skulle produceras före fullständig avslappning av en muskelryckning, kommer nästa ryck helt enkelt att summera på föregående ryckning och därigenom producera en summering. Summering kan uppnås på två sätt: frekvenssummering och multipel fiber summering. I frekvenssummering styrs kraften som utövas av skelettmuskeln genom att variera frekvensen vid vilken åtgärdspotentialer skickas till muskelfibrer. Åtgärdspotentialer kommer inte fram till musklerna synkront, och under en sammandragning kommer en del av fibrerna i muskeln att skjuta vid varje given tidpunkt. I en typisk omständighet, när människor utövar sina muskler så hårt som de medvetet kan, kommer ungefär en tredjedel av fibrerna i var och en av dessa muskler att skjuta på en gång, även om detta förhållande kan påverkas av olika fysiologiska och psykologiska faktorer (inklusive Golgi-senorgan och Renshaw-celler). Denna ’låga’ nivå av sammandragning är en skyddsmekanism för att förhindra avulsion av senan—kraften som genereras av en 95% sammandragning av alla fibrer är tillräcklig för att skada kroppen. Vid multipel fiber summering, om centrala nervsystemet skickar en svag signal för att dra ihop en muskel, stimuleras de mindre motorenheterna, som är mer spännande än de större, först. När signalens styrka ökar är fler motorenheter upphetsade utöver större, med de största motorenheterna som har så mycket som 50 gånger den kontraktila styrkan som de mindre. När fler och större motorenheter aktiveras blir kraften i muskelkontraktion gradvis starkare. Ett koncept som kallas storleksprincipen möjliggör en gradering av muskelkraft under svag sammandragning i små steg, som sedan blir gradvis större när större mängder kraft krävs.slutligen, om frekvensen av muskelhandlingspotentialer ökar så att muskelkontraktionen når sin toppkraft och platåer på denna nivå, är sammandragningen en tetanus.
längd-spänningsrelationredigera

längd-spänningsförhållande relaterar styrkan hos en isometrisk sammandragning till längden på muskeln vid vilken sammandragningen sker. Musklerna arbetar med störst aktiv spänning när de är nära en idealisk längd (ofta vilolängd). När den sträcks eller förkortas utöver detta (vare sig på grund av själva muskelns verkan eller av en yttre kraft) minskar den maximala aktiva spänningen som genereras. Denna minskning är minimal för små avvikelser, men spänningen sjunker snabbt när längden avviker längre från idealet. På grund av närvaron av elastiska proteiner i en muskelcell (såsom titin) och extracellulär matris, eftersom muskeln sträcker sig bortom en given längd, finns det en helt passiv spänning som motsätter sig förlängning. Kombinerat tillsammans finns det ett starkt motstånd mot att förlänga en aktiv muskel långt bortom toppen av aktiv spänning.
Krafthastighetsrelationredigera
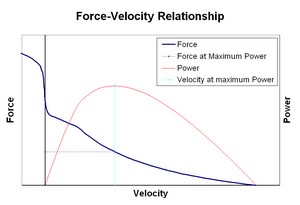
Krafthastighetsförhållande relaterar hastigheten vid vilken en muskel ändrar sin längd (vanligtvis reglerad av yttre krafter, såsom belastning eller andra muskler) till den mängd kraft som den genererar. Kraften minskar på ett hyperboliskt sätt i förhållande till den isometriska kraften när förkortningshastigheten ökar och så småningom når noll vid någon maximal hastighet. Det omvända gäller när muskeln sträcks-kraften ökar över isometrisk maximum tills den äntligen når ett absolut maximum. Denna inneboende egenskap hos aktiv muskelvävnad spelar en roll vid aktiv dämpning av leder som aktiveras av samtidigt aktiva motsatta muskler. I sådana fall ökar krafthastighetsprofilen kraften som produceras av förlängningsmuskeln på bekostnad av förkortningsmuskeln. Denna favör av vilken muskel som återför fogen till jämvikt ökar effektivt dämpningen av leden. Dessutom ökar styrkan hos dämpningen med muskelkraft. Motorsystemet kan således aktivt styra leddämpning via samtidig sammandragning (samkontraktion) av motsatta muskelgrupper.
Smooth muscleEdit
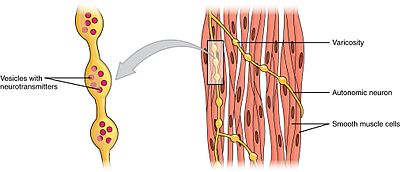
släta muskler kan delas in i två undergrupper: en enhet (enhetlig) och multienhet. Glatta muskelceller med en enhet finns i tarmen och blodkärlen. Eftersom dessa celler är kopplade samman av gapkorsningar, kan de komma i kontakt som ett syncytium. Glatta muskelceller med en enhet kontraherar myogeniskt, vilket kan moduleras av det autonoma nervsystemet.
Till skillnad från glatta muskelceller med en enhet finns glatta muskelceller med flera enheter i ögonmuskeln och i basen av hårsäckar. Glatta muskelceller med flera enheter dras samman genom att stimuleras separat av nerver i det autonoma nervsystemet. Som sådan tillåter de fin kontroll och gradvisa svar, ungefär som rekrytering av motorenheter i skelettmuskler.
mekanismer för glatt muskelkontraktionedit
den kontraktila aktiviteten hos glatta muskelceller påverkas av flera ingångar såsom spontan elektrisk aktivitet, neurala och hormonella ingångar, lokala förändringar i kemisk sammansättning och stretch. Detta står i kontrast till den kontraktila aktiviteten hos skelettmuskelceller, som bygger på en enda neural ingång. Vissa typer av glatta muskelceller kan generera sina egna handlingspotentialer spontant, som vanligtvis uppstår efter en pacemakerpotential eller en långsam vågpotential. Dessa åtgärdspotentialer genereras av tillströmningen av extracellulär Ca2 +
och inte Na+
. Liksom skelettmuskler krävs också cytosoliska Ca2+
– joner för crossbridge-cykling i glatta muskelceller.
de två källorna för cytosolisk Ca2 +
i glatta muskelceller är de extracellulära Ca2+
som kommer in genom kalciumkanaler och Ca2+
joner som frigörs från sarkoplasmatisk retikulum. Höjningen av cytosolisk Ca2+
resulterar i mer Ca2 +
bindning till kalmodulin, som sedan binder och aktiverar myosinljuskedjekinas. Kalciumkalmodulin-myosin lättkedjiga kinaskomplex fosforylerar myosin på 20 kilodalton (kDa) myosin lätta kedjor på aminosyrarest-serin 19, initierar sammandragning och aktiverar myosin ATPas. Till skillnad från skelettmuskelceller saknar glatta muskelceller troponin, även om de innehåller det tunna filamentproteinet tropomyosin och andra anmärkningsvärda proteiner – caldesmon och calponin. Sålunda initieras glatta muskelkontraktioner av Ca2+
– aktiverad fosforylering av myosin snarare än Ca2+
bindning till troponinkomplexet som reglerar myosinbindningsställen på aktin som i skelett-och hjärtmuskler.
avslutning av crossbridge-cykling (och lämnar muskeln i spärrtillstånd) inträffar när myosinljuskedjans fosfatas avlägsnar fosfatgrupperna från myosinhuvudena. Fosforylering av de 20 kDa myosin lätta kedjorna korrelerar väl med förkortningshastigheten hos glattmuskel. Under denna period sker en snabb explosion av energiutnyttjande mätt med syreförbrukning. Inom några minuter efter initiering minskar kalciumnivån markant, 20 kDa myosin light chains fosforylering minskar och energiutnyttjandet minskar; emellertid upprätthålls kraften i tonisk glatt muskel. Under sammandragning av muskler bildas snabbt cykelkorsbridor mellan aktiverat aktin och fosforylerat myosin, vilket genererar kraft. Det antas att upprätthållandet av kraft är resultatet av defosforylerade ”spärrbroar” som långsamt cyklar och upprätthåller kraft. Ett antal kinaser såsom rho-Kinas, DAPK3 och proteinkinas C antas delta i den ihållande sammandragningsfasen och Ca2+
– flöde kan vara signifikant.
NeuromodulationEdit
även om glattmuskelkontraktioner är myogena kan hastigheten och styrkan hos deras sammandragningar moduleras av det autonoma nervsystemet. Postganglioniska nervfibrer i det parasympatiska nervsystemet frigör neurotransmittorn acetylkolin, som binder till muskarinacetylkolinreceptorer (mAChRs) på glatta muskelceller. Dessa receptorer är metabotropa eller G-proteinkopplade receptorer som initierar en andra budbärarkaskad. Omvänt frigör postganglioniska nervfibrer i det sympatiska nervsystemet neurotransmittorerna epinefrin och norepinefrin, som binder till adrenerga receptorer som också är metabotropa. De exakta effekterna på den glatta muskeln beror på de specifika egenskaperna hos den aktiverade receptorn—både parasympatisk ingång och sympatisk ingång kan vara antingen excitatorisk (kontraktil) eller hämmande (avslappnande).
hjärtmuskelredigera

det finns två typer av hjärtmuskelceller: autorytmisk och kontraktil. Autorytmiska celler kontraherar inte, utan ställer istället in sammandragningstakten för andra hjärtmuskelceller, som kan moduleras av det autonoma nervsystemet. Däremot utgör kontraktila muskelceller (kardiomyocyter) majoriteten av hjärtmuskeln och kan komma i kontakt.
Excitation-contraction couplingEdit
i både skelett-och hjärtmuskel excitation-contraction (E-C) koppling, depolarisationsledning och Ca2+ frisättningsprocesser uppträder. Men även om de involverade proteinerna är likartade, är de distinkta i struktur och reglering. Dihydropyridinreceptorerna (DHPRs) kodas av olika gener, och ryanodinreceptorerna (RyRs) är distinkta isoformer. Dessutom kontakter DHPR med RyR1 (Huvud Ryr isoform i skelettmuskel) för att reglera Ca2+ frisättning i skelettmuskel, medan kalciumkanalen av L-typ (DHPR på hjärtmyocyter) och RyR2 (Huvud RyR isoform i hjärtmuskeln) inte är fysiskt kopplade i hjärtmuskeln utan möter varandra genom en korsningskoppling.
Till skillnad från skelettmuskel tros E-C-koppling i hjärtmuskeln främst bero på en mekanism som kallas kalciuminducerad kalciumfrisättning, som är baserad på den korsningsstruktur mellan t-tubule och sarkoplasmatisk retikulum. Junctophilin-2 (JPH2) är viktigt för att upprätthålla denna struktur, liksom integriteten hos T-tubulen. Ett annat protein, receptortillbehörsprotein 5 (REEP5), fungerar för att hålla den normala morfologin för junctional SR. defekter av junctional koppling kan bero på brister i något av de två proteinerna. Under processen med kalciuminducerad kalciumfrisättning aktiveras RyR2s av en kalciumutlösare, som åstadkommes genom flödet av Ca2+ genom kalciumkanalerna av L-typ. Efter detta tenderar hjärtmuskeln att uppvisa diAd (eller dyad) strukturer, snarare än triader.
Excitation-kontraktionskoppling i hjärtmuskelceller uppträder när en åtgärdspotential initieras av pacemakerceller i sinoatriell nod eller atrioventrikulär nod och utförs till alla celler i hjärtat via gapkorsningar. Åtgärdspotentialen färdas längs ytmembranet in i t-tubuler (de senare ses inte i alla hjärtcellstyper) och depolariseringen får extracellulär Ca2+
att komma in i cellen via kalciumkanaler av L-typ och eventuellt natrium-kalciumväxlare (NCX) under den tidiga delen av platåfasen. Även om denna Ca2+ – tillströmning endast räknas för cirka 10% av Ca2+ som behövs för aktivering, är den relativt större än skelettmuskulaturen. Denna Ca2+
tillströmning orsakar en liten lokal ökning av intracellulär Ca2 +
. Ökningen av intracellulär Ca2+
detekteras av RyR2 i membranet i sarkoplasmatisk retikulum, vilket frigör Ca2+
i ett positivt återkopplingsfysiologiskt svar. Denna positiva återkoppling kallas kalciuminducerad kalciumfrisättning och ger upphov till kalciumgnistor (Ca2+
gnistor). Den rumsliga och temporala summeringen av ~30 000 Ca2 +
gnistor ger en cellbredd ökning av cytoplasmatisk kalciumkoncentration. Ökningen av cytosoliskt kalcium efter flödet av kalcium genom cellmembranet och sarkoplasmatisk retikulum modereras av kalciumbuffertar, som binder en stor andel intracellulärt kalcium. Som ett resultat leder en stor ökning av totalt kalcium till en relativt liten ökning av fri Ca2+
.
det cytoplasmiska kalciumet binder till Troponin C, vilket flyttar tropomyosinkomplexet från aktinbindningsstället så att myosinhuvudet kan binda till aktinfilamentet. Från och med denna punkt är den kontraktila mekanismen väsentligen densamma som för skelettmuskel (ovan). Kortfattat, med hjälp av ATP-hydrolys, drar myosinhuvudet aktinfilamentet mot sarkomerens centrum.

efter systole tas intracellulärt kalcium upp av sarco/endoplasmatisk retikulum ATPas (SERCA) – pumpen tillbaka till sarkoplasmatisk retikulum redo för nästa cykel att börja. Kalcium matas också ut från cellen huvudsakligen av natriumkalciumväxlaren (NCX) och i mindre utsträckning ett plasmamembrankalciumatpas. Vissa kalcium tas också upp av mitokondrier. Ett enzym, fosfolamban, fungerar som en broms för SERCA. Vid låga hjärtfrekvenser är fosfolamban aktiv och saktar ATPas-aktiviteten så att Ca2+
inte behöver lämna cellen helt. Vid höga hjärtfrekvenser fosfolamban fosforyleras och deaktiveras, vilket tar de flesta Ca2+
från cytoplasman tillbaka till sarkoplasmatisk retikulum. Återigen dämpar kalciumbuffertar denna nedgång i Ca2+
– koncentrationen, vilket möjliggör en relativt liten minskning av fri Ca2 +
– koncentration som svar på en stor förändring av totalt kalcium. Den fallande Ca2 +
– koncentrationen tillåter troponinkomplexet att dissociera från aktinfilamentet och därigenom avsluta sammandragningen. Hjärtat slappnar av, så att ventriklarna kan fylla med blod och börja hjärtcykeln igen.
Leave a Reply