Viral Latency: ned, men ikke ud
når du forestiller dig vira, der gemmer sig fra dit immunsystem, kan du tænke på herpesvirus, der er ansvarlig for forkølelsessår og kønsherpes eller varicella-dyrevirus, der forårsager helvedesild. Disse vira kan vedvare i årtier i en dvaletilstand-lignende tilstand kendt som latens og undgå detektion af vores immunsystem (Kennedy et al., 2015). Latente vira kan undertiden vække og begynde at replikere igen, hvilket forårsager symptomer og spredning af infektion (Lieberman, 2016).
den humane immundefektvirus (HIV) er ligeledes en master escape-kunstner. Det danner et latent reservoir tidligt i infektion, hvilket gør det muligt for virussen at unddrage sig immunsystemet og overleve på lang sigt. Mennesker, der lever med HIV, tager daglige medicin kendt som antiretroviral kombinationsbehandling (eller ART) for at forhindre, at virussen replikerer. ART er imidlertid ikke en kur, da den ikke er målrettet mod vira, der allerede er latente. Disse lægemidler gives derfor i en persons levetid: at stoppe behandlingen, selv i et par uger, vil gøre det muligt for de latente vira at genaktivere og genoplive aktiv infektion. Mennesker med HIV kan forvente at have lange, sunde liv på grund af ART, men latente vira vil altid være til stede i deres krop.
at finde en kur mod HIV kræver at være i stand til at eliminere eller kontrollere det latente virale reservoir. Men nogle vigtige spørgsmål skal stadig løses for at nå dette mål. Hvordan, hvornår og hvor etablerer HIV latens? Hvad er størrelsen af det latente reservoir, og den bedste måde at måle det på? Hvad udløser latente vira til at genaktivere? Nu, i eLife, Miles Davenport, Brandon Keele og kolleger fra universitetet i ny Sydval og Frederick National Laboratory for Cancer Research – inklusive Mykola Pinkevych som første forfatter – rapporterer, hvornår det latente reservoir er etableret i en ikke-menneskelig primatmodel af HIV, og hvor meget af reservoiret der kan genaktiveres (Pinkevych et al., 2019).
i denne undersøgelse inficerede teamet rhesusmakakker med simian immunodeficiency virus (SIV), en forløbervirus, der er endemisk hos afrikanske aber og genetisk ligner HIV (Vilhelm og Burdo, 2009). På et tidspunkt i løbet af det 20.århundrede sprang SIV fra ikke-menneskelige primater til mennesker; denne transmissionshændelse på tværs af arter kombineret med hurtig udvikling tillod virussen effektivt at sprede sig hos mennesker og skabe den igangværende HIV-pandemi (Keele et al., 2006).
Pinkevych et al. begyndte med at inficere rhesusmakakker med en konstrueret SIV indeholdende over 10.000 unikke randomiserede sekvenser af DNA; når de er sekventeret, tillader disse ‘stregkoder’, at individuelle vira identificeres (Fennessey et al., 2017). Aberne blev derefter behandlet med antiretroviral behandling 4, 10 eller 27 dage efter infektion. Disse intervaller simulerer akut (4 dage), tidlig (10 dage) eller sen intervention (27 dage) med ART hos mennesker. Lægemidlerne blev givet i cirka et år, og virussen blev fuldstændigt undertrykt hos alle dyr. Behandlingen blev derefter stoppet, og den latente virus fik lov til at genaktivere. Ved hjælp af genetisk sekventering og matematisk modellering bestemte holdet størrelsen på det latente reservoir i SIV, og hvordan det ville genaktivere.
hos aberne blokerede behandlingen fire dage efter infektion ikke dannelsen af det latente reservoir, men reducerede dets størrelse med cirka 100 gange sammenlignet med senere ART-initiering. På samme måde har folk, der begynder ART inden for få dage efter at have erhvervet HIV, et ekstremt lille reservoir sammenlignet med dem, der starter behandling senere., 2015; Henrich et al., 2017). På trods af disse store forskelle i den samlede reservoirstørrelse, når ART blev stoppet, blev de latente vira genaktiveret med lignende hastigheder hos akutte, tidlige og senbehandlede dyr (figur 1). Pinkevych et al. derfor konkludere, at størstedelen af vira, der har potentiale til at genaktivere, etablerer latens tidligt efter infektion.
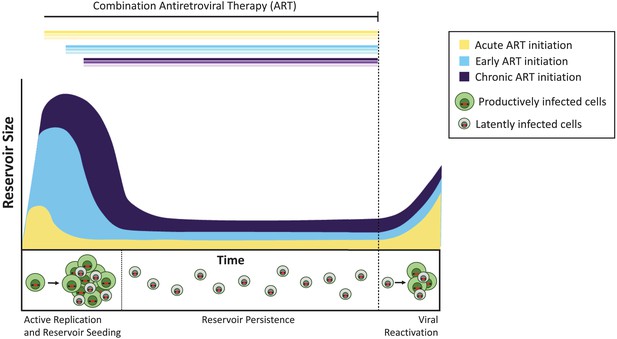
tidspunktet for antiretroviral terapi påvirker størrelsen af det latente reservoir.
uden behandling skaber celler inficeret med aktivt replikerende virus (produktivt inficerede celler; vist i grønt) infektiøse vira. Et mindretal af inficerede celler indeholder vira, der kan fortsætte på ubestemt tid som et latent reservoir (latent inficerede celler; vist i gråt), og disse vira kan potentielt genaktiveres på et senere tidspunkt. Behandling administreret i den akutte infektionsfase (det vil sige inden for dage eller uger efter primær infektion; gul kurve) resulterer i et mindre latent reservoir end når behandlingen påbegyndes tidligt (inden for seks måneder efter infektion, lyseblå) eller under kronisk infektion (mere end 6 måneder siden infektion, violet). Hvis behandlingen stoppes (stiplet linje), genaktiveres virussen fra disse reservoirer på lignende niveauer for at genoplive aktiv infektion og genfrø det latente reservoir.
for at undersøge, hvorfor tidspunktet for behandlingen ikke syntes at påvirke reaktiveringshastigheden, målte holdet niveauet af genetiske mutationer i de latente vira. Hvis vira akkumulerer mere skadelige mutationer, jo længere de aktivt replikerer i kroppen, Dette antyder, at dyr, der modtager forsinket ART, kunne bære en større andel latente vira, der er defekte og ikke kan vågne op igen. Holdet fandt imidlertid, at størstedelen af vira (mere end 80%) var genetisk intakte på tværs af alle dyr, uanset hvornår behandlingen startede. Dette er helt anderledes end hvad der sker med HIV-infektion hos mennesker, hvor de fleste af de latente vira indeholder store genetiske mutationer og sletninger, hvilket kun efterlader en lille brøkdel (mellem 2% og 11%), der er i stand til reaktivering (Ho et al., 2013; Bruner et al., 2019).
en nylig undersøgelse, der vurderede dynamikken i HIV-reservoiret hos mennesker på stabil ART, identificerede en anden uoverensstemmelse mellem denne SIV-model og HIV-latenstid hos mennesker. På trods af igangværende ART kan latent HIV undertiden spontant genaktiveres, og viraerne kan påvises i blodet i et kort stykke tid. Hos mennesker er disse virale ‘blips’ fylogenetisk forbundet med et viralt reservoir etableret ikke kun ved den første infektion, men på tværs af år med ubehandlet infektion (Jones et al., 2018). Årsagerne til disse forskelle er ikke godt forstået og repræsenterer vigtige områder for løbende forskning.
På trods af forskelle mellem ikke-humane primatmodeller og human HIV-infektion, arbejdet af Pinkevych et al. bekræfter, at viral latenstid er etableret ekstremt tidligt efter infektion. Disse resultater indikerer, at antiretroviral behandling skal påbegyndes så hurtigt som muligt for at kontrollere HIV-infektion og reducere latent reservoirstørrelse. Meget er stadig ukendt om, hvordan HIV-latenstid etableres og vedligeholdes, især under behandling; dog vil SIV-modeller forblive et vigtigt redskab til at forstå, hvordan man udrydder det latente reservoir.
Leave a Reply