forskel mellem enkelt dobbelt og tredobbelt bindinger
hovedforskel – enkelt vs Dobbelt vs tredobbelt bindinger
kemiske bindinger holder atomer i et molekyle sammen ved at etablere kræfter mellem elektronerne og kernerne i to atomer. Kemiske reaktioner styres ved at etablere eller bryde de kemiske bindinger. Der er forskellige typer bindinger, såsom kovalente, Ioniske, van Der Val osv. Egenskaberne af bindingerne varierer afhængigt af forskellige aspekter, såsom molekylets natur, fast type (krystallinsk eller amorf) osv. Kovalente bindinger dannes ved at dele to eller flere elektroner. Antallet af delt elektron mellem atomer bestemmer antallet af bindinger; om det er enkelt, dobbelt eller tredobbelt. Derfor er enkelt -, dobbelt-og tredobbeltbindinger kovalente bindinger. Den største forskel mellem enkelt dobbelt og tredobbelt binding er antallet af delte elektroner. Hvis det delte tal er et par elektroner, vil bindingen være en enkelt binding, mens hvis to atomer bundet af to par (fire elektroner), vil det danne en dobbeltbinding. Triple bindinger dannes ved at dele tre par (seks atomer) af elektroner. Disse delingselektroner er almindeligt kendt som valenselektroner. Denne artikel vil se på,
1. Hvad er en enkelt Bond?
– Definition, egenskaber, eksempler
2. Hvad er en Double Bond?
– Definition, egenskaber, eksempler
3. Hvad er en Triple Bond?
– Definition, egenskaber, eksempler
4. Hvad er forskellen mellem enkelt dobbelt og tredobbelt obligationer?
Hvad er en enkelt binding
en enkelt binding dannes ved deling af et par valenselektroner mellem to tilstødende atomer. En enkeltbinding er den enkleste form for en kovalent binding, hvor hvert atom tilvejebringer en valenselektron. Disse valenselektroner er placeret i den yderste skal af atomer. Her trækkes de negativt ladede delte elektroner af de positivt ladede kerner af atomer. Disse trækkræfter holder atomerne sammen. Dette arrangement er kendt som en enkelt binding. Molekylerne med enkeltbindinger er mindre reaktive i modsætning til molekylerne med flere bindinger. Desuden er de svagere end flere bindinger og har højere bindingslængder på grund af den lave trækkraft mellem atomer sammenlignet med flere bindinger. En enkelt binding betegnes med kun et enkelt bindestreg; eks: C C. alkaner såsom methan, ethan, propan er nogle eksempler på forbindelser med enkeltbindinger.
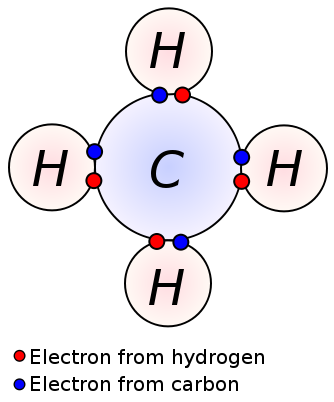
metan
Hvad er en dobbeltbinding
en dobbeltbinding dannes ved at dele to par valenselektroner placeret i den yderste bane af atomer. Forbindelser med dobbeltbindinger er meget reaktive end enkeltbundne forbindelser, men mindre reaktive end forbindelser med tredobbelte bindinger. Dobbeltbindinger betegnes med to parallelle bindestreger; eks: C=C. Nogle eksempler på forbindelser med dobbeltbindinger inkluderer alkener såsom ethylen, propen, carbonylforbindelser (C=O), asoforbindelser (N=N), iminer (C=N) og sulfoksider (S=o).
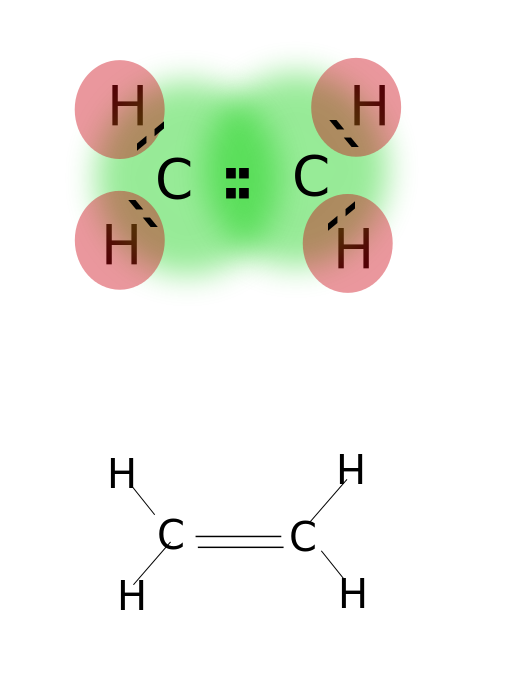
ethylen
Hvad er en tredobbelt binding
når to atomer deler tre par valenselektroner (seks valenselektroner), kaldes de etablerede bindinger tredobbelte bindinger. Triple bindinger er de stærkeste og mest reaktive kovalente bindinger. Sammenlignet med enkelt-og dobbeltbindinger har tredobbelte bindinger den laveste bindingslængde på grund af den højere trækkraft mellem to atomer. En tredobbelt binding er betegnet med tre parallelle bindestreger mellem to atomer; f.eks: C-kran C. Nogle eksempler på forbindelser med tredobbelte bindinger inkluderer nitrogengas (N-kran N), cyanidion (C-kran N), acetylen (CH-kran CH) og kulilte (C-kran O).
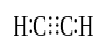
acetylen
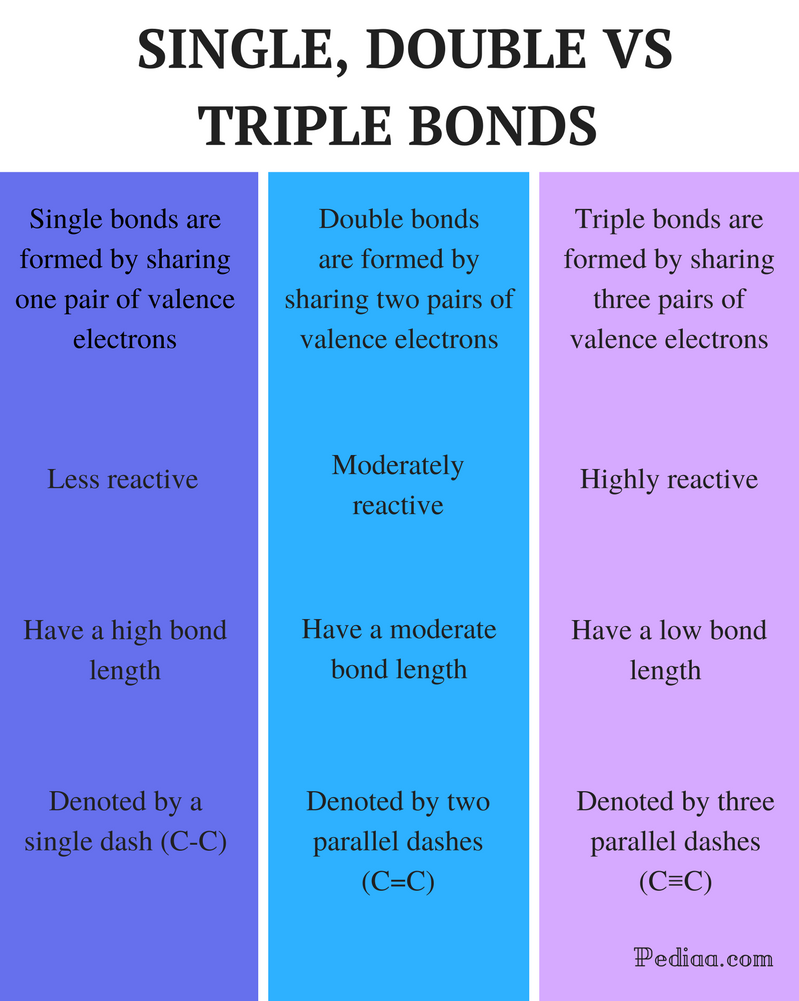
forskel mellem enkelt dobbelt og tredobbelt bindinger
Definition:
enkeltbinding: En enkelt binding dannes ved at dele et par valenselektroner.dobbeltbinding: en dobbeltbinding dannes ved at dele to par valenselektroner.
tredobbelt binding: en tredobbelt binding dannes ved at dele tre par valenselektroner.
reaktivitet:
enkeltbinding: enkeltbindinger er mindre reaktive.
dobbeltbinding: dobbeltbindinger er moderat reaktive.
Triple Bond: Triple Obligationer er meget reaktive.
Obligationslængde:
enkeltbinding: enkeltbindinger har en høj obligationslængde.
dobbeltbinding: dobbeltbindinger har en moderat obligationslængde.
Triple Bond: Triple obligationer har en lav bindingsstyrke.
betegnet med:
enkeltbinding: enkeltbindinger betegnes med et enkelt bindestreg (C-C).
dobbeltbinding: dobbeltbindinger betegnes med to parallelle bindestreger (C=C).
Triple Bond: Triple Obligationer er betegnet med tre parallelle bindestreger (C-kur C).
eksempler:
enkeltbinding: eksempler inkluderer alkaner såsom methan, ethan, propan, butan osv.
dobbeltbinding: eksempler inkluderer ethylen, propen, carbonylforbindelser (C=O), asoforbindelser (N=N), iminer (C=N) og sulfoksider (S=O).
Triple Bond: Eksempler inkluderer nitrogengas (N-kar-N), cyanidion (C-kar-N), acetylen (CH-kar-CH) og kulilte (C-kar-O).
![]()
Leave a Reply