A contração do músculo

Em animais vertebrados, existem três tipos de tecidos musculares: esquelético, liso e cardíaco. Músculo esquelético constitui a maioria da massa muscular no corpo e é responsável pela atividade locomotora. O músculo liso Forma vasos sanguíneos, tracto gastrointestinal, e outras áreas do corpo que produzem contrações prolongadas. Os músculos cardíacos formam o coração, que bombeia sangue. Músculos esqueléticos e cardíacos são chamados músculos estriados por causa de sua aparência listrada sob um microscópio, que é devido ao padrão altamente organizado alternando de bandas e bandas I.artigo principal: Músculo-esquelético

Excluindo reflexos, todos os músculos esqueléticos contrações ocorrem como resultado do esforço consciente de origem no cérebro. O cérebro envia sinais eletroquímicos através do sistema nervoso para o neurônio motor que inerva várias fibras musculares. No caso de alguns reflexos, o sinal para contrair pode ter origem na medula espinhal através de um ciclo de feedback com a matéria cinzenta. Outras ações como locomoção, respiração e mastigação têm um aspecto reflexo para eles: as contrações podem ser iniciadas consciente ou inconscientemente.
Neuromuscular junctionEdit

Uma junção neuromuscular é uma sinapse química formada pelo contato entre um neurônio motor e uma fibra muscular. É o local onde um neurônio motor transmite um sinal para uma fibra muscular para iniciar a contração muscular. A seqüência de eventos que resulta em despolarização da fibra muscular na junção neuromuscular começa quando um potencial de ação é iniciada no corpo celular de um neurônio motor, que é então propagado por saltatory de condução ao longo de seu axônio em direção à junção neuromuscular. Uma vez que ele atinge o terminal bouton, o potencial de ação causa um afluxo de íons Ca2+
no terminal por meio dos canais de cálcio dependentes de voltagem. O influxo Ca2 + causa vesículas sinápticas contendo o neurotransmissor acetilcolina para se fundir com a membrana plasmática, liberando acetilcolina na fenda sináptica entre o neurônio motor terminal e a junção neuromuscular da fibra muscular esquelética. A acetilcolina difunde-se através da sinapse e liga-se aos receptores nicotínicos da acetilcolina na junção neuromuscular. A activação do receptor nicotínico Abre o seu canal intrínseco de sódio/potássio, fazendo com que o sódio se apresse e o potássio se escureça. Como resultado, o sarcolemma reverte a polaridade e sua voltagem rapidamente salta do potencial de membrana de repouso de-90mV para tão alto quanto +75mV quando o sódio entra. O potencial de membrana torna-se então hiperpolarizado quando o potássio sai e é então ajustado de volta ao potencial de membrana em repouso. Esta flutuação rápida é chamada de potencial da placa final os canais iônicos de voltagem do sarcolemma ao lado da placa final aberta em resposta ao potencial da placa final. Eles são específicos de sódio e potássio e só permitem uma passagem. Esta onda de movimentos iônicos cria o potencial de ação que se espalha a partir da placa final do motor em todas as direções. Se o potencial de Acção parar de chegar, a acetilcolina deixa de ser libertada do terminal bouton. A acetilcolina remanescente na fenda sináptica é degradada pela esterase da acetilcolina activa ou reabsorvida pelo botão sináptico e nenhuma é deixada para substituir a acetilcolina degradada.Acoplamento excitação–contração é o processo pelo qual um potencial de ação muscular na fibra muscular faz com que os miofibrils se contraam. No músculo esquelético, sistema de excitação–contração de acoplamento depende de um acoplamento direto entre as principais proteínas do retículo sarcoplasmático (RS) de cálcio canal de lançamento (identificado como ryanodine receptor, RyR) e tensão-gated L-tipo de canais de cálcio (identificado como diidropiridínicos receptores, DHPRs). DHPRs estão localizados no sarcolemma (que inclui a superfície sarcolemma e os túbulos transversais), enquanto os RyRs residem através da membrana SR. A posição próxima de um túbulo transversal e de duas regiões SR contendo RyRs é descrita como uma tríade e é predominantemente onde ocorre Acoplamento excitação–contração. Acoplamento excitação-contração ocorre quando a despolarização da célula muscular esquelética resulta em um potencial de ação muscular, que se espalha através da superfície celular e na rede de fibra muscular de T-túbulos, assim despolarizando a porção interna da fibra muscular. A despolarização das porções internas ativa os receptores da dihidropiridina na cisterna terminal, que estão em estreita proximidade com os receptores da ryanodina no retículo sarcoplasmático adjacente. Os receptores activados da dihidropiridina interagem fisicamente com os receptores da ryanodina para os activar através de processos pedonais (envolvendo alterações conformacionais que alostericamente activam os receptores da ryanodina). À medida que os receptores da ryanodina se abrem, Ca2+
é liberado do retículo sarcoplasmático para o espaço juncional local e se difunde no citoplasma a granel para causar uma faísca de cálcio. Note que o retículo sarcoplásmico tem uma grande capacidade tampão de cálcio, parcialmente devido a uma proteína de ligação ao cálcio chamada calsequestrina. A ativação quase síncrona de milhares de faíscas de cálcio pelo potencial de ação causa um aumento celular no cálcio dando origem à elevação do cálcio transitório. The Ca2+
released into the cytosol binds to Troponin C by the actin filaments, to allow crossbridge cycling, producing force and, in some situations, motion. O reticulum reticulum calcium-ATPase (SERCA) sarco/endoplasmático bombeia activamente Ca2+
de volta para o retículo sarcoplasmático. Como Ca2+diminui para níveis de repouso, a força diminui e o relaxamento ocorre.
Sliding filament theoryEdit

O filamento deslizante teoria descreve um processo utilizado pelos músculos a contrair. É um ciclo de eventos repetitivos que fazem com que um filamento fino deslize sobre um filamento espesso e gere tensão no músculo. Foi desenvolvido independentemente por Andrew Huxley e Rolf Niedergerke e por Hugh Huxley e Jean Hanson em 1954. Fisiologicamente, esta contração não é uniforme em todo o sarcoma; a posição central dos filamentos espessos torna-se instável e pode mudar durante a contração. No entanto, as ações de proteínas elásticas como a Titina são hipotéticas para manter uma tensão uniforme através do sarcoma e puxar o filamento espesso para uma posição central.
Crossbridge cyclingEdit

Crossbridge andar de bicicleta é uma sequência de molecular eventos que fundamenta a correr filamento teoria. Uma ponte transversal é uma projeção de miosina, consistindo de duas cabeças de miosina, que se estende dos filamentos grossos. Cada cabeça de miosina tem dois locais de ligação: um para a ATP e outro para a actina. A ligação de ATP a uma cabeça de miosina separa a miosina da actina, permitindo assim que a miosina se ligue a outra molécula de actina. Uma vez ligado, o ATP é hidrolisado por miosina, que usa a energia liberada para mover-se para a “posição combinada”, em que se liga fracamente a uma parte do local de ligação actina. O restante do local de ligação da actina é bloqueado pela tropomiosina. Com o ATP hidrolisado, a cabeça de miosina encolhida agora contém ADP + Pi. Dois íons Ca2 + ligam-se à troponina C nos filamentos de actina. O complexo troponina-Ca2+causa tropomiosina deslizar e desbloquear o restante do local de ligação actina. Desbloquear o resto dos locais de ligação da actina permite que as duas cabeças de miosina fechem e a miosina se liguem fortemente à actina. A cabeça de miosina então libera o fosfato inorgânico e inicia um curso de energia, que gera uma força de 2 pN. O golpe de energia move o filamento de actina para dentro, encurtando assim o sarcoma. Myosin então libera ADP, mas ainda permanece firmemente ligado à actina. No final do golpe de poder, ADP é liberado da cabeça de miosina, deixando a miosina ligada à actina em um estado de rigor até que outro ATP se ligue à miosina. A falta de ATP resultaria no estado de rigor característico do rigor mortis. Uma vez que outro ATP se liga à miosina, a cabeça da miosina irá novamente separar-se da actina e ocorre outro ciclo de cristas cruzadas.o ciclismo Cruzado é capaz de continuar enquanto houver quantidades suficientes de ATP e Ca2+no citoplasma. A terminação do ciclismo cruzado pode ocorrer quando Ca2+
é ativamente bombeado de volta para o retículo sarcoplasmático. Quando Ca2+
Não está mais presente no filamento fino, a tropomiosina muda de conformação de volta ao seu estado anterior, de modo a bloquear os locais de ligação novamente. A miosina deixa de se ligar ao filamento fino e o músculo relaxa. Os íons Ca2 + deixam a molécula de troponina para manter a concentração de íons Ca2+no sarcoplasma. O bombeamento ativo de íons Ca2+no retículo sarcoplasmático cria uma deficiência no fluido em torno dos miofibrils. Isto causa a remoção de íons Ca2+da troponina. Assim, o complexo tropomiosina-troponina cobre novamente os locais de ligação nos filamentos de actina e cessa a contracção.
Gradação do músculo esquelético, contractionsEdit
A força das contrações do músculo esquelético pode ser amplamente separados em contração, de soma, e o tétano. Um tique é um único ciclo de contração e relaxamento produzido por um potencial de ação dentro da própria fibra muscular. O tempo entre um estímulo para o motor do nervo e a subseqüente contração do músculo inervado é chamado o período latente, o que normalmente leva cerca de 10 ms e é causado pelo tempo necessário para a ação do nervo potencial para se propagar, o tempo para a química de transmissão na junção neuromuscular, em seguida, os passos subsequentes de excitação-contração de acoplamento.
Se outro potencial de ação muscular fosse produzido antes do relaxamento completo de um tique muscular, então o próximo tique irá simplesmente somar-se ao tique anterior, produzindo assim uma soma. A soma pode ser alcançada de duas maneiras: soma de frequência e soma de fibras múltiplas. Na soma de frequência, a força exercida pelo músculo esquelético é controlada pela variação da frequência na qual potenciais de ação são enviados para as fibras musculares. Os potenciais de ação não chegam aos músculos sincronicamente, e, durante uma contração, alguma fração das fibras no músculo estará disparando a qualquer momento. Em uma circunstância típica, quando os seres humanos estão exercendo seus músculos tão duros quanto eles são conscientemente capazes, cerca de um terço das fibras em cada um desses músculos vai disparar de uma só vez, embora esta proporção pode ser afetada por vários fatores fisiológicos e psicológicos (incluindo órgãos de tendões Golgi e células de Renshaw). Este “baixo” nível de contração é um mecanismo de proteção para evitar avulsão do tendão—a força gerada por uma contração de 95% de todas as fibras é suficiente para danificar o corpo. Na soma de fibras múltiplas, se o sistema nervoso central envia um sinal fraco para contrair um músculo, as unidades motoras menores, sendo mais excitáveis do que as maiores, são estimulados primeiro. À medida que a força do sinal aumenta, mais unidades motoras são excitadas, além das maiores, com as maiores unidades motoras tendo até 50 vezes a força contráctil como as menores. À medida que mais e maiores unidades motoras são ativadas, a força de contração muscular torna-se progressivamente mais forte. Um conceito conhecido como princípio do tamanho, permite que uma gradação da força muscular durante a contração fraca ocorra em pequenas etapas, que então se tornam progressivamente maiores quando maiores quantidades de força são necessárias.finalmente, se a frequência dos potenciais de ação muscular aumenta de tal forma que a contração muscular atinge sua força máxima e planaltos a este nível, então a contração é um tétano.
length-tension relationshipEdit

Comprimento-tensão relacionamento relaciona-se com a força de uma contração isométrica para o comprimento do músculo em que a contração ocorre. Os músculos operam com maior tensão ativa quando perto de um comprimento ideal (muitas vezes o seu comprimento de descanso). Quando esticada ou encurtada além disso (seja devido à ação do próprio músculo ou por uma força externa), a tensão ativa máxima gerada diminui. Esta diminuição é mínima para pequenos desvios, mas a tensão cai rapidamente à medida que o comprimento se afasta mais do ideal. Devido à presença de proteínas elásticas dentro de uma célula muscular (como a Titina) e matriz extracelular, como o músculo é esticado além de um dado comprimento, há uma tensão inteiramente passiva, que se opõe ao alongamento. Juntos, há uma forte resistência ao alongamento de um músculo ativo muito além do Pico de tensão ativa.relação força-velocidade: relação direita do eixo vertical contracções concêntricas (o músculo é encurtado), à esquerda das contracções excêntricas do eixo (o músculo é alongado sob carga); poder desenvolvido pelo músculo em vermelho. Uma vez que a potência é igual a força vezes velocidade, o músculo não gera energia em qualquer força isométrica (devido à velocidade zero) ou velocidade máxima (devido à força zero). A velocidade de encurtamento ideal para geração de energia é de aproximadamente um terço da velocidade máxima de encurtamento.
relação força–velocidade relaciona a velocidade a que um músculo muda o seu comprimento (normalmente regulado por forças externas, como a carga ou outros músculos) com a quantidade de força que gera. A força diminui de forma hiperbólica em relação à força isométrica à medida que a velocidade de encurtamento aumenta, eventualmente atingindo zero a alguma velocidade máxima. O reverso é verdadeiro para quando o músculo é esticado-a força aumenta acima do máximo isométrico, até finalmente chegar a um máximo absoluto. Esta propriedade intrínseca do tecido muscular ativo desempenha um papel no amortecimento ativo das articulações que são atuadas por músculos opostos simultaneamente ativos. Em tais casos, o perfil força-velocidade aumenta a força produzida pelo alongamento do músculo à custa do encurtamento do músculo. Este favorecimento de qualquer músculo retorna a articulação ao equilíbrio efetivamente aumenta o amortecimento da articulação. Além disso, a força do amortecimento aumenta com a força muscular. O sistema motor pode, assim, controlar ativamente o amortecimento das articulações através da contração simultânea (Co-contração) de grupos musculares opostos.
Bom muscleEdit
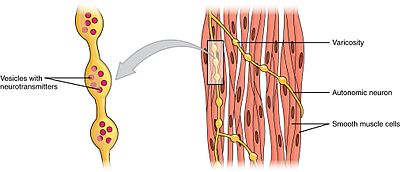
músculos lisos podem ser divididos em dois subgrupos: unidade única (unitária) e multi-unidade. As células musculares lisas unitárias podem ser encontradas no intestino e nos vasos sanguíneos. Como estas células estão ligadas entre si por junções de gap, elas são capazes de se contrair como um sincítio. As células do músculo liso unitárias contraiem miogenicamente, o que pode ser modulado pelo sistema nervoso autónomo.ao contrário das células do músculo liso unitárias, as células do músculo liso multi-unidade são encontradas no músculo do olho e na base dos folículos capilares. As células do músculo liso Multi-unidade contrai-se por serem estimuladas separadamente pelos nervos do sistema nervoso autónomo. Como tal, eles permitem um controle fino e Respostas graduais, muito parecido com o recrutamento de unidades motoras no músculo esquelético.
Mecanismos de músculo liso contractionEdit
A atividade contrátil das células musculares lisas é influenciada por vários factores, como a atividade elétrica espontânea, neurais e hormonais entradas, as alterações na composição química, e de estiramento. Isto está em contraste com a atividade contráctil das células do músculo esquelético, que depende de uma única entrada neural. Alguns tipos de células do músculo liso são capazes de gerar seus próprios potenciais de ação espontaneamente, que geralmente ocorrem após um potencial de pacemaker ou um potencial de onda lenta. Estes potenciais de ação são gerados pelo influxo de Ca2+
, e não Na+
. Como os músculos esqueléticos, iões citosólicos Ca2+
também são necessários para o ciclismo cruzado em células musculares lisas.
As duas fontes para a Ca2 citosólica + nas células do músculo liso são a entrada extracelular de Ca2+através dos canais de cálcio e os íons Ca2+que são libertados do retículo sarcoplasmático. A elevação da Ca2 +
citosólica resulta em mais Ca2+
ligando-se à calmodulina, que então se liga e activa a myosin light-chain kinase. O complexo fosforilato de cálcio-calmodulina-miosina de cadeia leve quinase myosina nas cadeias de luz de 20 kilodalton (kDa) myosina no resíduo de aminoácidos-serina 19, iniciando a contracção e activando a ATPase de miosina. Ao contrário das células do músculo esquelético, as células do músculo liso não possuem troponina, apesar de conterem a proteína de filamento fino tropomiosina e outras proteínas notáveis – caldesmon e calponina. Assim, as contracções musculares lisas são iniciadas pela fosforilação activada da miosina por Ca2+em vez da ligação de Ca2+ao complexo troponina que regula os locais de ligação da miosina em actina, como nos músculos esqueléticos e cardíacos.
terminação do ciclismo de Ponte cruzada (e deixando o músculo em estado latente) ocorre quando a fosfatase da cadeia de luz de miosina remove os grupos de fosfato das cabeças de miosina. A fosforilação das cadeias de luz myosina de 20 kDa correlaciona-se bem com a velocidade de encurtamento do músculo liso. Durante este período, há uma rápida explosão de utilização de energia medida pelo consumo de oxigênio. Poucos minutos após o início, o nível de cálcio diminui acentuadamente, a fosforilação das cadeias de luz de 20 kDa diminui e a utilização de energia diminui; no entanto, a força no músculo liso tónico é mantida. Durante a contracção muscular, formam-se rapidamente pontes cruzadas entre a actina activada e a miosina fosforilada, gerando força. Supõe-se que a manutenção da força resulta de “pontes de Fecho” desphosphoriladas que lentamente rodeiam e mantêm a força. Acredita-se que uma série de cinases, como rho cinase, DAPK3 e proteína cinase C, participem da fase sustentada de contração, e o fluxo de Ca2+
Pode ser significativo.
NeuromodulationEdit
embora as contracções musculares suaves sejam miogénicas, a taxa e a força das contracções podem ser moduladas pelo sistema nervoso autónomo. As fibras nervosas pós-ganglionares do sistema nervoso parassimpático libertam o neurotransmissor acetilcolina, que se liga aos receptores muscarínicos da acetilcolina (mAChRs) nas células do músculo liso. Estes receptores são metabotrópicos, ou receptores acoplados de proteína G que iniciam uma segunda cascata de Mensageiro. Inversamente, as fibras nervosas pós-ganglionares do sistema nervoso simpático libertam os neurotransmissores epinefrina e norepinefrina, que se ligam aos receptores adrenérgicos que também são metabotrópicos. Os efeitos exatos no músculo liso dependem das características específicas do receptor ativado – tanto a entrada parassimpática como a entrada simpática podem ser excitatórios (contrácteis) ou inibitórios (relaxantes).
Cardíaca muscleEdit

Existem dois tipos de células musculares cardíacas: autorhythmic e contráteis. As células autorrítmicas não se contraiem, mas ajustam o ritmo de contração para outras células musculares cardíacas, que podem ser moduladas pelo sistema nervoso autônomo. Em contraste, as células musculares contrácteis (cardiomiócitos) constituem a maioria do músculo cardíaco e são capazes de contrair.
Excitation-contraction couplingEdit
In both skeletal and cardiac muscle excitation-contraction (E-C) coupling, depolarization conduction and Ca2+ release processes occur. No entanto, embora as proteínas envolvidas sejam similares, elas são distintas em estrutura e regulação. Os receptores da dihidropiridina (DHPRs) são codificados por diferentes genes, e os receptores da ryanodina (RYR) são isoformas distintas. Além disso, DHPR contatos com RyR1 (principal RyR isoforma no músculo esquelético) para regular o Ca2+ lançamento no músculo esquelético, enquanto o L-tipo de canal de cálcio (DHPR em miócitos cardíacos) e RyR2 (principal RyR isoforma no músculo cardíaco) não são fisicamente ligado no músculo cardíaco, mas de cara uns com os outros por um juncional acoplamento.ao contrário do músculo esquelético, pensa-se que o acoplamento e-C no músculo cardíaco depende principalmente de um mecanismo chamado libertação de cálcio induzida pelo cálcio, que é baseado na estrutura junccional entre o túbulo e o retículo sarcoplasmático. Junctophilin-2 (JPH2) é essencial para manter esta estrutura, bem como a integridade do T-túbulos. Outra proteína, a proteína acessória do receptor 5 (REEP5), funciona para manter a morfologia normal da SR juncional. defeitos do acoplamento juncional podem resultar de deficiências de qualquer uma das duas proteínas. Durante o processo de libertação de cálcio induzido, os Rcyr2s são activados por um activador de cálcio, que é provocado pelo fluxo de Ca2+ através dos canais de cálcio do tipo L. Depois disso, o músculo cardíaco tende a exibir estruturas diad (ou dyad), em vez de tríades.o acoplamento de contracção-excitação nas células musculares cardíacas ocorre quando um potencial de acção é iniciado pelas células do pacemaker no nódulo sinoauricular ou no nó Atrioventricular e conduzido a todas as células do coração através de entroncamentos. O potencial de Acção desloca-se ao longo da membrana superficial para T-túbulos (estes últimos não são observados em todos os tipos de células cardíacas) e a despolarização faz com que Ca2+
extracelular entre na célula através de canais de cálcio do tipo L e possivelmente um permutador de sódio-cálcio (NCX) durante a parte inicial da fase de planalto. Embora este influxo de Ca2+ conte apenas para cerca de 10% do Ca2+ necessário para a ativação, é relativamente maior do que o músculo esquelético. Este influxo de Ca2 + causa um pequeno aumento local na Ca2+intracelular. O aumento de Ca2+
intracelular é detectado por RyR2 na membrana do retículo sarcoplasmático, que libera Ca2+
em uma resposta fisiológica positiva. Este feedback positivo é conhecido como libertação de cálcio induzida pelo cálcio e dá origem a faíscas de cálcio (Ca2+
sparks). A soma espacial e temporal de ~30.000 Ca2+
sparks dá um aumento celular na concentração citoplasmática de cálcio. O aumento do cálcio citosólico após o fluxo de cálcio através da membrana celular e retículo sarcoplasmático é moderado por tampões de cálcio, que se ligam a uma grande proporção de cálcio intracelular. Como resultado,um grande aumento no cálcio total leva a um aumento relativamente pequeno no Ca2 + livre.
O cálcio citoplasmático liga-se à troponina C, deslocando o complexo tropomiosina do local de ligação à actina, permitindo que a cabeça da miosina se ligue ao filamento de actina. A partir deste ponto, o mecanismo contráctil é essencialmente o mesmo que para o músculo esquelético (acima). Brevemente, usando hidrólise de ATP, a cabeça de miosina puxa o filamento de actina para o centro do sarcoma.

a Seguir sístole, intracelular de cálcio é absorvida pela sarco/retículo endoplasmático ATPase (SERCA) a bomba de volta para o retículo sarcoplasmático pronto para o próximo ciclo para começar. O cálcio é também ejetado da célula principalmente pelo permutador de sódio-cálcio (NCX) e, em menor extensão, pela membrana plasmática da ATPase de cálcio. O cálcio também é absorvido pela mitocôndria. Uma enzima, o fosfolambano, serve de freio para a SERCA. Em baixas taxas cardíacas, o fosfolambano é ativo e retarda a atividade da ATPase para que Ca2+
não tenha que deixar a célula inteiramente. Em altas taxas cardíacas, o fosfolambano é fosforilado e desativado, tomando a maioria Ca2+
do citoplasma de volta para o retículo sarcoplasmático. Mais uma vez, os tampões de cálcio moderam esta queda na concentração de Ca2+
, permitindo uma diminuição relativamente pequena na concentração livre de Ca2+
em resposta a uma grande alteração no cálcio total. A queda da concentração de Ca2+permite que o complexo troponina se dissocie do filamento de actina, terminando assim a contração. O coração relaxa, permitindo que os ventrículos se encham de sangue e iniciem o ciclo cardíaco novamente.
Leave a Reply