4.4: Características de ligações covalentes
Electronegativity e Bond Polaridade
Apesar de definidos ligação covalente como compartilhamento de elétrons, os elétrons em uma ligação covalente bond não são sempre compartilhado igualmente pelos dois átomos ligados. A menos que a ligação conecte dois átomos do mesmo elemento, como em H2, haverá sempre um átomo que atrai os elétrons na ligação mais fortemente do que o outro átomo faz, como em HCl, mostrado na figura \(\PageIndex{1}\). Uma ligação covalente que tem uma partilha igual de elétrons (figura \(\PageIndex{1a}\)) é chamada de ligação covalente não-polar. Uma ligação covalente que tem uma partilha desigual de elétrons, como Na Figura \(\PageIndex{1b}\), é chamada de ligação covalente polar.

Figure \(\PageIndex{1}\) ligações polares versus ligações covalentes não-polares. (a) the electrons in the covalent bond are equally shared by both hydrogen atoms. Esta é uma ligação covalente não-polar. b) O átomo de cloro atrai os electrões na ligação mais do que o átomo de hidrogénio, conduzindo a um desequilíbrio na distribuição dos electrões. Esta é uma ligação covalente polar.
a distribuição da densidade dos electrões numa ligação polar é desigual. É maior em torno do átomo que atrai os elétrons mais do que o outro. Por exemplo, os elétrons na ligação H–Cl de uma molécula de cloreto de hidrogênio passam mais tempo perto do átomo de cloro do que perto do átomo de hidrogênio. Observe que a área sombreada em torno de Cl na Figura \(\PageIndex{1b}\) é muito maior do que é em torno de H.
Este desequilíbrio na densidade de elétrons resulta em um acúmulo de carga parcial negativa (designado como δ−) em um lado do título (Cl) e uma carga positiva parcial (designado δ+) no outro lado do título (H). Isto é visto na figura \(\PageIndex{2a}\). A separação da carga numa ligação covalente polar resulta num dipolo eléctrico (dois pólos), representado pela seta na figura \(\PageIndex{2b}\). A direção da seta é apontada para a extremidade δ enquanto a cauda + da seta indica a extremidade δ+ da ligação.
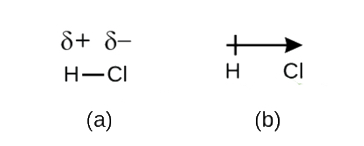
Figura \(\PageIndex{2}\): (a) a Desigual partilha de ligação do par de elétrons entre H e Cl leva a parcial de carga positiva no átomo de H e carga parcial negativa no Cl. Símbolos δ+ e δ-indicam a polaridade da ligação H-Cl. b) o dipolo é representado por uma seta com uma cruz na cauda. A cruz está perto da extremidade δ+ e a ponta da flecha coincide com a δ–.
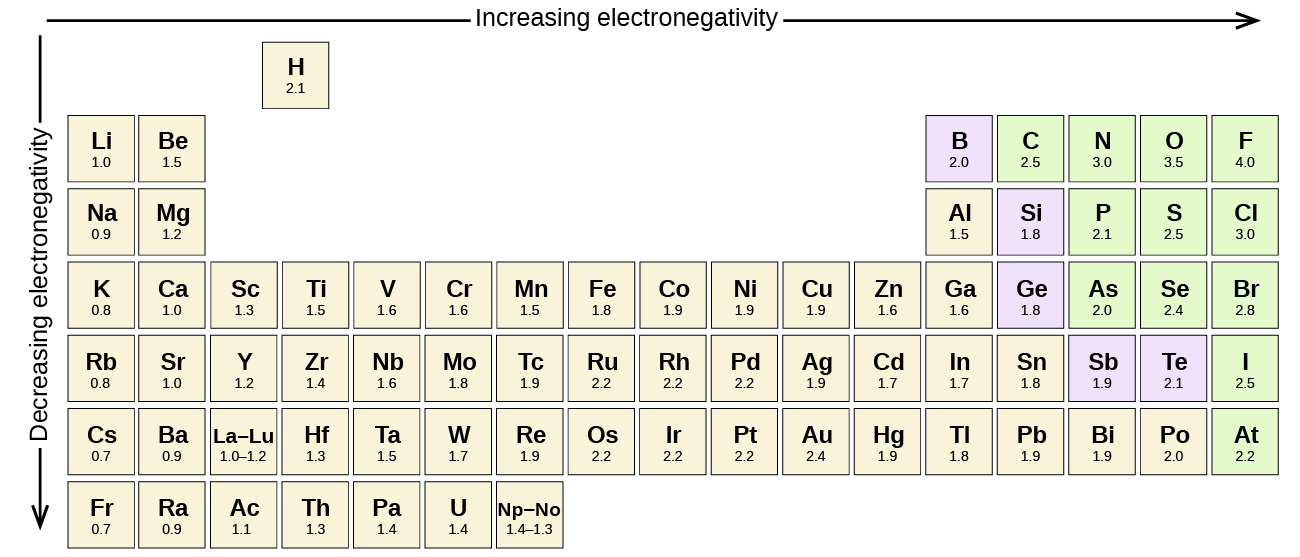
qualquer ligação covalente entre átomos de diferentes elementos é uma ligação polar, mas o grau de polaridade varia muito. Algumas ligações entre diferentes elementos são apenas minimamente polares, enquanto outras são fortemente polares. Ligações iônicas podem ser consideradas a última em polaridade, com elétrons sendo transferidos ao invés de compartilhados. Para julgar a polaridade relativa de uma ligação covalente, os químicos usam eletronegatividade, que é uma medida relativa de quão fortemente um átomo atrai elétrons quando forma uma ligação covalente. Existem várias escalas numéricas para a classificação da eletronegatividade. A figura \(\PageIndex{3}\) mostra uma das mais populares—a escala de Pauling.
olhando mais de perto: Linus Pauling (1901-94) é a única pessoa a ter ganho dois Prêmios Nobel individuais (ou seja, sem se preocupar). Na década de 1930, Pauling usou novas teorias matemáticas para enunciar alguns princípios fundamentais da ligação química. Seu livro de 1939 The Nature of the Chemical Bond é um dos livros mais significativos já publicados em Química.em 1935, Pauling interessou-se por moléculas biológicas, e recebeu o Prêmio Nobel de Química de 1954 por seu trabalho na estrutura proteica. (He was very close to discovering the double helix structure of DNA when James Watson and James Crick announced their own discovery of its structure in 1953. Mais tarde foi agraciado com o Prêmio Nobel da Paz de 1962 por seus esforços para banir os testes de armas nucleares.

Linus Pauling foi um dos químicos mais influentes do século XX.em seus últimos anos, Pauling ficou convencido de que grandes doses de vitamina C evitariam a doença, incluindo o resfriado comum. A maioria da pesquisa clínica não mostrou uma conexão, mas Pauling continuou a tomar grandes doses diárias. Morreu em 1994, tendo passado uma vida inteira estabelecendo um legado científico que poucos jamais igualarão.
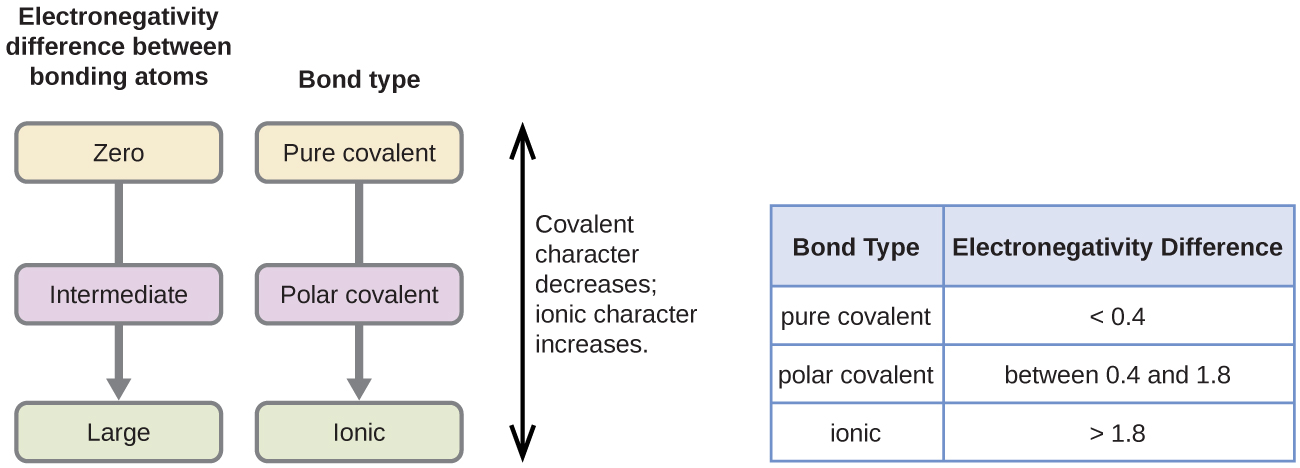
a polaridade de uma ligação covalente pode ser julgada determinando a diferença nas eletronegatividades dos dois átomos que fazem a ligação. Quanto maior a diferença nas eletronegatividades, maior o desequilíbrio da partilha de elétrons na ligação. Embora não existam regras duras e rápidas, a regra geral é se a diferença em eletronegatividades é inferior a cerca de 0.4, a ligação é considerada não-polar; se a diferença for maior que 0,4, a ligação é considerada polar. Se a diferença em eletronegatividades é grande o suficiente (geralmente maior que cerca de 1,8), o composto resultante é considerado iônico ao invés de covalente. Uma diferença de eletronegatividade de zero, é claro, indica uma ligação covalente não-polar.
exemplo \(\PageIndex{1}\)
descreve a diferença de eletronegatividade entre cada par de átomos e a polaridade resultante (ou tipo de ligação).
- C e H
- H e H
- Na e Cl
- S e H
Solução
- de Carbono, tem um electronegativity de 2,5, enquanto o valor para o hidrogênio é 2.1. A diferença é de 0,4, o que é bastante pequeno. A ligação C–H é, portanto, considerada não-polar.ambos os átomos de hidrogénio têm o mesmo valor de eletronegatividade—2.1. A diferença é zero, então a ligação é não-polar.
- a eletronegatividade do sódio é 0.9, enquanto a do cloro é 3.0. A diferença é de 2,1, que é bastante alta, e assim sódio e cloro formam um composto iônico.com 2.1 Para hidrogênio e 3.5 para oxigênio, a diferença de eletronegatividade é 1.4. Esperaríamos uma ligação muito polar. A partilha de elétrons entre O E H é desigual com os elétrons mais fortemente atraídos para O.
exercício \(\PageIndex{1}\)
descreve a diferença electronegatividade (EN) entre cada par de átomos e a polaridade resultante (ou tipo de ligação).
- C e S
- K e Br
- N e N
- Cs e F
Resposta:
O PT diferença é 1.0 , daí polar. A partilha de elétrons entre C e O é desigual com os elétrons mais fortemente atraídos para O.
resposta b:
a diferença EN é maior que 1,8, portanto iônica.
resposta c:
átomos idênticos têm diferença EN zero, portanto não-polares.resposta d: a diferença EN é superior a 1, 8, Portanto iónica.
Leave a Reply