Duricef
Generic Name: cefadroxil
Léková Forma: prášek pro přípravu suspenze
Lékařsky přezkoumány Drugs.com. Naposledy aktualizováno 21. dubna, 2020.
- Přehled
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Další
omezit vznik rezistentních bakterií a zachovat účinnost Duricef® a další antibakteriální léky, Duricef by měl být používán pouze k léčbě nebo prevenci infekcí, které jsou prokázané nebo silně podezření, že je způsobena bakteriemi.
Duricef popis
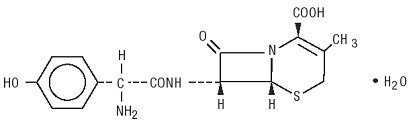
Duricef je polosyntetické cefalosporinové antibiotikum určené k perorálnímu podání. Jedná se o bílý až nažloutlý bílý krystalický prášek. Je rozpustný ve vodě a je kyselinově stabilní. Je chemicky označeny jako 5-Thia-1-azabicyclooct-2-en-2-karboxylová kyselina 7-amino]-3-methyl-8-oxo-, monohydrát]-. Má vzorec C16H17N3O5S * H2O a molekulovou hmotnost 381,40. To má následující strukturní vzorec:
Duricef potahované tablety, 1 g, obsahují následující pomocné látky: mikrokrystalická celulóza, hydroxypropylmethylcelulóza, magnesium-stearát, polyethylenglykol, polysorbát 80, simetikonová emulze, a oxid titaničitý.
Duricef pro přípravu Perorální Suspenze obsahuje následující pomocné látky: FD&C Yellow No. 6, aroma (přírodní a umělá), polysorbát 80, natrium-benzoát, sacharóza, xanthanová guma.
Duricef kapsle obsahují následující pomocné látky: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, želatina, magnesium-stearát, oxid titaničitý.
Duricef-Klinická farmakologie
Duricef se po perorálním podání rychle vstřebává. Po jednorázových dávkách 500 mg a 1000 mg byly průměrné maximální sérové koncentrace přibližně 16 µg/mL a 28 µg / ml. Měřitelné hladiny byly přítomny 12 hodin po podání. Více než 90% léčiva se vylučuje nezměněným močí do 24 hodin. Maximální koncentrace v moči jsou přibližně 1800 µg / mL během období po jednorázové perorální dávce 500 mg. Zvýšení dávky obecně vede k přiměřenému zvýšení koncentrace Duricef (monohydrát cefadroxilu, USP) v moči. Koncentrace antibiotik v moči po dávce 1 g byla udržována výrazně nad MIC citlivých močových patogenů po dobu 20 až 22 hodin.
mikrobiologie
in vitro testy prokazují, že cefalosporiny jsou baktericidní kvůli jejich inhibici syntézy buněčných stěn. Bylo prokázáno, že Cefadroxil je účinný proti následujícím organismům Jak in vitro, tak při klinických infekcích (viz indikace a použití):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Nemá žádnou aktivitu proti druhům Pseudomonas a Acinetobacter calcoaceticus(dříve Mima a herellea).
testů Citlivosti: Difúzní techniky
použití antibiotik diskový test citlivosti metody, které měří průměr zóny poskytnout přesný odhad citlivosti k antibiotikům. Jeden takový standardní postup1, který byl doporučen pro použití s disky k testování citlivosti organismů na cefadroxil, používá disk třídy cefalosporinů (cefalothin). Interpretace zahrnuje korelaci průměrů získaných při diskovém testu s minimální inhibiční koncentrací (MIC) pro cefadroxil.
Zprávy z laboratoře dává výsledky standardního single-disk citlivosti testu s 30 µg cefalothin disku by měly být interpretovány podle následujících kritérií:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of „Citlivý“ znamená, že patogen bude pravděpodobně inhibován obecně dosažitelnými hladinami v krvi. Zprávu o „střední citlivost“ naznačuje, že organismus by být citlivé, pokud vysoká dávka se používá, nebo v případě, že infekce je omezena na tkáně a tekutiny (např. moč), v nichž vysoké hladiny antibiotika je dosaženo. Zpráva „rezistentní“ naznačuje, že dosažitelné koncentrace antibiotika pravděpodobně nebudou inhibiční a měla by být zvolena jiná terapie.
standardizované postupy vyžadují použití laboratorních kontrolních organismů. Cefalotinový disk 30 µg by měl poskytnout následující průměry zón:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (včetně microdilution) method2 nebo ekvivalentní, bakteriální izolát mohou být považovány za citlivé, pokud MIC (minimální inhibiční koncentrace) hodnota pro cefalothin je 8 µg/mL nebo méně. Organismy se považují za rezistentní, pokud je MIC 32 µg / mL nebo vyšší. Organismy s hodnotou MIC nižší než 32 µg / mL, ale vyšší než 8 µg / mL jsou meziprodukty.
stejně jako u standardních difúzních metod vyžadují ředicí postupy použití laboratorních kontrolních organismů. Standardní cefalothin prášek by měl dát hodnoty MIC v rozmezí 0.12 µg/mL a 0,5 µg/mL Staphylococcus aureus ATCC 29213. Pro Escherichia coli ATCC 25922, MIC rozsah by měl být mezi 4,0 µg/mL a 16.0 µg/mL. Pro Streptococcus faecalis ATCC 29212, MIC rozsah by měl být mezi 8,0 a 32.0 µg/mL.
Indikace a Využití pro Duricef
Duricef je indikován pro léčbu pacientů s infekcí, způsobených citlivými kmeny určené organismy v následujících onemocnění:
infekce Močových cest, infekce způsobené E. coli, P. mirabilis a Klebsiella.
infekce kůže a struktury kůže způsobené stafylokoky a / nebo streptokoky.
faryngitida a/nebo tonzilitida způsobená Streptococcus pyogenes (beta-hemolytické streptokoky skupiny a).
poznámka: Bylo prokázáno, že pouze penicilin intramuskulárním způsobem podání je účinný při profylaxi revmatické horečky. Duricef je obecně účinný při eradikaci streptokoků z orofaryngu. Údaje prokazující účinnost přípravku Duricef pro profylaxi následné revmatické horečky však nejsou k dispozici.
Poznámka: Před léčbou a v jejím průběhu by měly být zahájeny testy kultivace a citlivosti. Pokud je to indikováno, měly by být provedeny studie renálních funkcí.
omezit vznik rezistentních bakterií a zachovat účinnost Duricef a jiné antibakteriální léky, Duricef by měl být používán pouze k léčbě nebo prevenci infekcí, které jsou prokázané nebo silně podezření, že je způsobena citlivými bakteriemi. Pokud jsou k dispozici informace o kultuře a citlivosti, měly by být zváženy při výběru nebo úpravě antibakteriální terapie. Při absenci těchto údajů mohou lokální epidemiologie a vzorce citlivosti přispět k empirickému výběru terapie.
Kontraindikace
Duricef je kontraindikován u pacientů se známou alergií na cefalosporiny skupiny antibiotik.
upozornění
před zahájením léčby přípravkem Duricef je třeba pečlivě vyšetřit, zda pacient měl předchozí hypersenzitivní reakce na CEFADROXIL, cefalosporiny, peniciliny nebo jiné léky. POKUD MÁ BÝT TENTO PŘÍPRAVEK PODÁVÁN PACIENTŮM CITLIVÝM NA PENICILIN, JE TŘEBA POSTUPOVAT OPATRNĚ, PROTOŽE ZKŘÍŽENÁ CITLIVOST MEZI BETA-LAKTAMOVÝMI ANTIBIOTIKY BYLA JASNĚ ZDOKUMENTOVÁNA A MŮŽE SE OBJEVIT AŽ U 10% PACIENTŮ S ALERGIÍ NA PENICILIN V ANAMNÉZE.
Pokud dojde k alergické reakci na Duricef, přerušte léčbu. ZÁVAŽNÉ AKUTNÍ HYPERSENZITIVNÍ REAKCE MOHOU VYŽADOVAT LÉČBU EPINEFRINEM A DALŠÍ NOUZOVÁ OPATŘENÍ, VČETNĚ KYSLÍKU, INTRAVENÓZNÍCH TEKUTIN, INTRAVENÓZNÍCH ANTIHISTAMINIK, KORTIKOSTEROIDŮ, PRESORICKÝCH AMINŮ A LÉČBY DÝCHACÍCH CEST, JAK JE KLINICKY INDIKOVÁNO.
Clostridium difficile associated diarrhea (CDAD) byl hlášen při použití téměř všech antibakteriálních látek, včetně Duricef, a může se pohybovat v závažnosti od mírného průjmu až po smrtelnou kolitidu. Léčba antibakteriálními látkami mění normální flóru tlustého střeva, což vede k přemnožení C.difficile.
C. difficile produkuje toxiny A A B, které přispívají k rozvoji CDAD. Produkující Hypertoxin kmenů C. difficile způsobují zvýšenou morbiditu a mortalitu, protože tyto infekce mohou být refrakterní vůči antimikrobiální terapii a mohou vyžadovat kolektomii. CDAD musí být zváženo u všech pacientů, kteří mají průjem po použití antibiotik. Pečlivá lékařská anamnéza je nutná, protože CDAD byl hlášen více než dva měsíce po podání antibiotik.
Pokud je podezření na CDAD nebo potvrdil, pokračující používání antibiotik není namířené proti C. difficile může být nutné ukončit. Podle klinické indikace by měla být zahájena vhodná léčba tekutin a elektrolytů, suplementace bílkovin, antibiotická léčba C.difficile a chirurgické vyšetření.
bezpečnostní Opatření
Obecné
Duricef by měl být používán s opatrností v přítomnosti výrazně porušenou funkcí ledvin (clearance kreatininu menší než 50 mL/min/1,73 M2). (Viz dávkování a podání.) U pacientů se známou nebo suspektní poruchou funkce ledvin, pečlivé klinické sledování a přiměřená laboratorní studie by měly být provedeny před a v průběhu terapie.
Předepisování Duricef v případě prokázané nebo silně podezření na bakteriální infekci nebo profylaktické indikaci je nepravděpodobné, že by poskytnout přínos pro pacienta a zvyšuje riziko vzniku rezistentních bakterií.
dlouhodobé užívání přípravku Duricef může vést k přemnožení nesusceptovatelných organismů. Pečlivé pozorování pacienta je nezbytné. Pokud během léčby dojde k superinfekci, je třeba přijmout vhodná opatření.
Duricef by měl být předepisován s opatrností u jedinců s anamnézou gastrointestinálního onemocnění, zejména kolitida.
Informace pro Pacienty
Pacienti by měli být radil, že antibakteriálními léky, včetně Duricef by měl být používán pouze k léčbě bakteriálních infekcí. Neléčí virové infekce (např. nachlazení). Když Duricef je předepsán k léčbě bakteriálních infekcí, u pacientů by mělo být řečeno, že i když je běžné se cítit lépe brzy v průběhu léčby, lék by měla být přijata přesně podle pokynů. Vynechávání dávek nebo nedokončení kompletní průběh léčby může (1) snížit účinnost okamžité léčby a (2) zvýšit pravděpodobnost, že bakterie vytvoří rezistenci a nebude léčitelná pomocí Duricef nebo jiné antibakteriální léky v budoucnu.
průjem je častým problémem způsobeným antibiotiky, které obvykle končí, když je antibiotikum přerušeno. Někdy po zahájení léčby antibiotiky se u pacientů může vyvinout vodnatá a krvavá stolice (s nebo bez žaludečních křečí a horečky) až dva nebo více měsíců po užití poslední dávky antibiotika. Pokud k tomu dojde, pacienti by měli co nejdříve kontaktovat svého lékaře.
Lék/Interakce s Laboratorními testy
Pozitivní přímý Coombsův test byl hlášen během léčby s cefalosporinová antibiotika. V hematologických studiích nebo v transfúze cross-odpovídající postupy při antiglobulinový testy jsou prováděny na menší straně, nebo v Coombsův testování novorozenců, jejichž matky obdržely cefalosporinová antibiotika před porodem, mělo by být uznáno, že pozitivní Coombsův test může být způsobeno drogami.
karcinogeneze, mutageneze a zhoršení Fertility
nebyly provedeny žádné dlouhodobé studie ke stanovení kancerogenního potenciálu. Nebyly provedeny žádné testy genetické toxicity.
těhotenství: Těhotenství Kategorie B
Reprodukční studie byly prováděny na myších a potkanech v dávkách až do 11 násobku dávky pro člověka a neodhalily žádné důkazy zhoršené plodnosti nebo poškození plodu v důsledku cephalexin monohydrate. Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Protože reprodukční studie na zvířatech nejsou vždy prediktivní pro lidskou odpověď, měl by být tento lék užíván během těhotenství pouze v případě, že je to nezbytně nutné.
porod a porod
Duricef nebyl studován pro použití během porodu a porodu. Léčba by měla být podána pouze v případě, že je to nezbytně nutné.
kojící matky
při podávání monohydrátu cefadroxilu kojící matce je třeba postupovat opatrně.
pediatrické použití
(viz dávkování a podání.)
Geriatrické Použití
přibližně 650 pacientů, kteří dostávali cefadroxil pro léčbu infekcí močových cest ve třech klinických studiích, 28% bylo 60 let a starší, zatímco 16% bylo 70 let a starší. Přibližně 1000 pacientů, kteří dostávali cefadroxil pro léčbu kůže a kožní struktury infekce v 14 klinických hodnocení, 12% bylo 60 let a starší, zatímco 4% bylo 70 let a více. V těchto studiích nebyly pozorovány žádné celkové rozdíly v bezpečnosti mezi staršími pacienty a mladšími pacienty. Klinické studie cefadroxil pro léčbu zánětu hltanu nebo angíny nezahrnovaly dostatečný počet pacientů ve věku 65 let a starší určit, zda reagují jinak než mladší pacienti. Další hlášeny klinické zkušenosti s azithromycin nebyl zjištěn rozdíly v odpovědích mezi staršími a mladšími pacienty, ale větší citlivost některých starších jedinců nelze vyloučit.
Cefadroxil se v podstatě vylučuje ledvinami a úprava dávkování je indikována u pacientů s poruchou funkce ledvin (viz dávkování a podání: porucha funkce ledvin). Protože u starších pacientů je větší pravděpodobnost snížené funkce ledvin, péče by měla být přijata v dávce výběr, a to může být užitečné sledovat renální funkce.
nežádoucí účinky
gastrointestinální
nástup příznaků pseudomembranózní kolitidy se může objevit během nebo po léčbě antibiotiky(Viz Upozornění). Vzácně byly hlášeny dyspepsie, nauzea a zvracení. Objevil se také průjem.
byla pozorována přecitlivělost
alergie (ve formě vyrážky, kopřivky, angioedému a svědění). Tyto reakce obvykle ustoupily po přerušení léčby. Byla také hlášena anafylaxe.
Ostatní
Další reakce zahrnovaly jaterní dysfunkce včetně cholestázy a zvýšení sérových transamináz, genitální pruritus, genitální moniliáza, záněty pochvy, mírné přechodné neutropenie, horečka. Vzácně byly hlášeny agranulocytóza, trombocytopenie, idiosynkratické selhání jater, erythema multiforme, Stevens-Johnsonův syndrom, sérová nemoc a artralgie.
kromě výše uvedených nežádoucích účinků, které byly pozorovány u pacientů léčených přípravkem azithromycin, následující nežádoucí účinky a změněné laboratorní testy byly hlášeny na cefalosporinová třídy antibiotik:
Toxická epidermální nekrolýza, bolest břicha, superinfekce, poruchy funkce ledvin, toxická nefropatie, aplastická anémie, hemolytická anémie, krvácení, prodloužený protrombinový čas, pozitivní Coombsův test, zvýšení BUN, zvýšení kreatininu, zvýšení alkalické fosfatázy, zvýšení aspartát aminotransferázy (AST), zvýšená alaninaminotransferáza (ALT), zvýšení bilirubinu, zvýšení LDH, eozinofilie, pancytopenie, neutropenie.
Několik cefalosporiny byly zapleteny v což vyvolalo záchvaty, zejména u pacientů s poruchou funkce ledvin, kdy dávka nebyla snížena (viz DÁVKOVÁNÍ A PODÁVÁNÍ a PŘEDÁVKOVÁNÍ). Pokud dojde k záchvatům spojeným s farmakoterapií, mělo by být léčivo přerušeno. Antikonvulzivní léčba může být podána, pokud je klinicky indikována.
předávkování
studie u dětí mladších šesti let naznačila, že požití méně než 250 mg/kg cefalosporinů není spojeno s významnými výsledky. Není nutná žádná jiná akce než obecná podpora a pozorování. U množství vyšších než 250 mg / kg vyvolávejte vyprazdňování žaludku.
u pěti anurických pacientů bylo prokázáno, že v průměru 63% perorální dávky 1 g je extrahováno z těla během 6-8 hodinové hemodialýzy.
Duricef Dávkování a způsob Podání
Duricef je kyselina-stabilní a může být podána ústně, bez ohledu na jídlo. Podávání s jídlem může být užitečné při snižování potenciální gastrointestinální potíže, spojené příležitostně s perorálního cefalosporinu terapie.
Dospělí
infekce močových cest: Cystitida) obvyklá dávka je 1 nebo 2 g denně v jedné (q.d.) nebo rozdělených dávkách (b.i.d.).
u všech ostatních infekcí močových cest je obvyklá dávka 2 g denně v rozdělených dávkách (b. i. d.).
Kůže a kožní Struktury Infekcí: Pro kůže a kožní struktury infekce obvyklá dávka je 1 g na den v jedné (q.d.) nebo v rozdělených dávkách (b.jsem.d.).
zánět Hltanu a Mandlí: Léčba skupiny beta-hemolytické streptokokové faryngitidy a angína—1 g na den v jedné (q.d.) nebo v rozdělených dávkách (b.jsem.d.) za 10 dní.
děti
u infekcí močových cest je doporučená denní dávka pro děti 30 mg / kg / den v rozdělených dávkách každých 12 hodin. U faryngitidy, tonzilitidy a impetiga je doporučená denní dávka pro děti 30 mg / kg / den v jedné dávce nebo ve rovnoměrně rozdělených dávkách každých 12 hodin. U jiných infekcí kůže a struktury kůže je doporučená denní dávka 30 mg/kg / den ve rovnoměrně rozdělených dávkách každých 12 hodin. Při léčbě beta-hemolytických streptokokových infekcí by měla být terapeutická dávka přípravku Duricef podávána po dobu nejméně 10 dnů.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | , 2 lžičky |
funkce Ledvin
U pacientů s poruchou funkce ledvin, dávkování cephalexin monohydrate by měla být upravena podle clearance kreatininu sazby, aby se zabránilo akumulaci léku. Navrhuje se následující plán. U dospělých je počáteční dávka 1000 mg přípravku Duricef a udržovací dávka (na základě rychlosti clearance kreatininu ) je 500 mg v níže uvedených časových intervalech.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients s rychlostí clearance kreatininu vyšší než 50 mL / min lze léčit, jako by to byli pacienti s normální funkcí ledvin.
| Láhev Velikost | Rekonstituci Směrech |
| 100 mL |
Pozastavit v celkem 67 mL vody. metoda: lehce poklepejte na lahvičku, abyste uvolnili prášek. přidejte 67 mL vody ve dvou dávkách. po každém přidání dobře protřepejte. |
| 75 mL |
Pozastavit v celkem 51 mL vody. metoda: lehce poklepejte na lahvičku, abyste uvolnili prášek. přidejte 51 mL vody ve dvou dávkách. po každém přidání dobře protřepejte. |
| 50 mL |
Pozastavit v celkem 34 mL vody. metoda: lehce poklepejte na lahvičku, abyste uvolnili prášek. přidejte 34 mL vody ve dvou dávkách. po každém přidání dobře protřepejte. |
|
po rekonstituci uchovávejte v chladničce. Před použitím dobře protřepejte. Uchovávejte obal těsně uzavřený. Nepoužitou dávku zlikvidujte po 14 dnech. |
|
Jak je Duricef Dodávané
Duricef® (cephalexin monohydrate, USP) 500 mg Tobolky: neprůhledné, hnědé a bílé tvrdé želatinové tobolky s potiskem „PPP“ a „784“ na jednom konci a s „Duricef“ a „500 mg“ na druhé straně.
tobolky se dodávají následovně:
N 0430-0780-19 lahvička s 50
uchovávejte při kontrolované pokojové teplotě 15°-30° C (59°-86° F).
Duricef® 1 gram Tablety: bílé až téměř bílé, horní půlen, oválného tvaru, s potiskem „PPP“ na jedné straně půlí a „785“ na druhé straně půlí. Tablety se dodávají následovně:
N 0430-0781-19 lahvička s 50
uchovávejte při kontrolované pokojové teplotě 15°-30° C (59°-86° F).
Duricef® pro perorální suspenzi je ochucený pomerančovým ananasem a je dodáván následovně:
250 mg/5 mL N 0430-2782-15 50 mL Láhev.
N 0430-2782-17 100 mL Láhev.
500 mg/5 mL N 0430-2783-16 75 mL Láhev.
N 0430-2783-17 100 mL Láhev.
Před rekonstituci: Uchovávejte při kontrolované pokojové teplotě 15°-30° C (59°-86° F).
1. Národní výbor pro klinické laboratorní standardy, schválený Standard, výkonnostní standardy pro test citlivosti antimikrobiálních disků, 4. vydání, sv. 10 (7): M2-A4, Villanova, PA, Duben, 1990.
2. Národní výbor pro klinické laboratorní normy, schválená norma: Metody ředění antimikrobiální testy citlivosti na bakterie, které rostou aerobně, 2. vydání, sv. 10 (8): M7-A2, Villanova, PA, Duben, 1990.
výrobce Bristol-Myers Squibb Co.
Princeton, NJ 08543
pro Warner Chilcott Company, Inc.
Fajardo, PR 00738
na trhu Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: první generace cefalosporinů
Spotřebitelské zdroje
- Pokročilé Čtení
Odborné zdroje
- Předepisování Informace
- Cefadroxil Perorální Suspenze (FDA)
Související léčba vodítka
- Bakteriální Endokarditida Prevence
- Kůže a Strukturu Infekce
- Impetigo
- Infekce Ledvin
- … +4 více
lékařské vyloučení odpovědnosti
Leave a Reply