Duricef
nume Generic: cefadroxil
forma de dozare: pulbere, pentru suspensie
Medical revizuite de Drugs.com. Ultima actualizare la 21 aprilie 2020.
- Prezentare generală
- efecte secundare
- dozare
- Professional
- interacțiuni
- mai mult
pentru a reduce dezvoltarea bacteriilor rezistente la medicamente și pentru a menține eficacitatea Duricef și a altor medicamente antibacteriene, Duricef trebuie utilizat numai pentru tratarea sau prevenirea infecțiilor care sunt dovedite sau puternic suspectate a fi cauzate de bacterii.
Duricef descriere
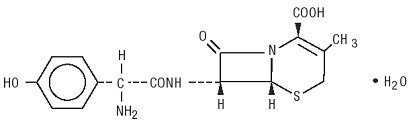
Duricef este un antibiotic cefalosporinic semisintetic destinat administrării orale. Este o pulbere cristalină albă până la alb-gălbuie. Este solubil în apă și este acid-stabil. Este desemnat chimic ca acid 5-tia-1-azabiciclooct-2-enă-2-carboxilic, 7-amino]-3-metil-8-oxo -, monohidrat] -. Are formula C16H17N3O5S * H2O și greutatea moleculară de 381,40. Are următoarea formulă structurală:
Duricef comprimate filmate, 1 g, conțin următoarele ingrediente inactive: celuloză microcristalină, hidroxipropil metilceluloză, stearat de magneziu, polietilen glicol, polisorbat 80, emulsie de simeticonă și dioxid de titan.
Duricef pentru suspensie orală conține următoarele ingrediente inactive: FD&C Yellow no.6, arome (naturale și artificiale), polisorbat 80, benzoat de sodiu, zahăr și gumă de xantan.
capsulele Duricef conțin următoarele ingrediente inactive: D&C Red No.28, FD&C Blue No. 1, FD&C Red No. 40, gelatină, stearat de magneziu și dioxid de titan.
Duricef – Farmacologie Clinică
Duricef este absorbit rapid după administrarea orală. După administrarea unor doze unice de 500 mg și 1000 mg, concentrațiile plasmatice maxime medii au fost de aproximativ 16 și, respectiv, de 28 de hectolitri/mL. Valorile măsurabile au fost prezente la 12 ore după administrare. Peste 90% din medicament este excretat nemodificat în urină în 24 de ore. Concentrațiile plasmatice maxime în urină sunt de aproximativ 1800% / mL în perioada care urmează unei singure doze orale de 500 mg. Creșterea dozei produce, în general, o creștere proporțională a concentrației urinare Duricef (cefadroxil monohidrat, USP). Concentrația de antibiotic în urină, după o doză de 1 g, a fost menținută cu mult peste CMI a agenților patogeni urinari susceptibili timp de 20 până la 22 de ore.
Microbiologie
testele in vitro demonstrează că cefalosporinele sunt bactericide datorită inhibării sintezei peretelui celular. S-a demonstrat că cefadroxilul este activ împotriva următoarelor organisme atât in vitro, cât și în infecțiile clinice (vezi indicații și utilizare):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Nu are activitate împotriva speciilor Pseudomonas și Acinetobacter calcoaceticus (fostele specii mima și Herellea).
teste de susceptibilitate: tehnici de difuzie
utilizarea metodelor de testare a sensibilității discului antibiotic care măsoară diametrul zonei oferă o estimare exactă a susceptibilității la antibiotice. O astfel de procedură standard1 care a fost recomandată pentru utilizarea cu discuri pentru a testa susceptibilitatea organismelor la cefadroxil utilizează discul din clasa cefalosporinei (cefalotină). Interpretarea implică corelarea diametrelor obținute în testul de disc cu concentrația minimă inhibitoare (MIC) pentru cefadroxil.
rapoartele de laborator care dau rezultate ale testului standard de susceptibilitate cu un singur disc cu un disc cefalotin de 30 de hectare trebuie interpretate în conformitate cu următoarele criterii:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of „Susceptibil” indică faptul că agentul patogen este probabil să fie inhibat de nivelurile sanguine în general realizabile. Un raport de „sensibilitate intermediară” sugerează că organismul ar fi susceptibil dacă se utilizează doze mari sau dacă infecția este limitată la țesuturi și fluide (de exemplu, urină) în care se ating niveluri ridicate de antibiotice. Un raport de „rezistent” indică faptul că concentrațiile realizabile ale antibioticului sunt puțin probabil să fie inhibitoare și trebuie selectată altă terapie.
procedurile standardizate necesită utilizarea organismelor de control de laborator. Discul cefalotin de 30 de centigre ar trebui să dea următoarele diametre ale zonei:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (inclusiv metoda microdiluției) 2 sau echivalent, un izolat bacterian poate fi considerat susceptibil dacă valoarea CMI (concentrația minimă inhibitoare) pentru cefalotină este de 8 sau mai puțin. Organismele sunt considerate rezistente în cazul în care MIC este de 32%/ml sau mai mare. Organismele cu o valoare a CMI mai mică de 32%/ml, dar mai mare de 8%/mL sunt intermediare.
ca și în cazul metodelor standard de difuzie, procedurile de diluare necesită utilizarea organismelor de control de laborator. Pulberea standard de cefalotină trebuie să dea valori MIC în intervalul de 0,12 hectog/mL și 0,5 octogg/mL pentru Staphylococcus aureus ATCC 29213. Pentru Escherichia coli ATCC 25922, intervalul MIC ar trebui să fie cuprins între 4,0 hectog/mL și 16,0 centig/mL. Pentru Streptococcus faecalis ATCC 29212, intervalul MIC ar trebui să fie cuprins între 8,0 și 32,0 hectolitri/mL.
indicații și utilizare pentru Duricef
Duricef este indicat pentru tratamentul pacienților cu infecții cauzate de tulpini sensibile ale organismelor desemnate în următoarele boli:
infecții ale tractului urinar cauzate de speciile E. coli, P. mirabilis și Klebsiella.
infecții ale pielii și ale structurii pielii cauzate de stafilococi și / sau streptococi.
faringită și / sau amigdalită cauzată de Streptococcus pyogenes (streptococi beta-hemolitici din grupa a).
Notă: numai penicilina pe cale intramusculară de Administrare s-a dovedit a fi eficientă în profilaxia febrei reumatice. Duricef este în general eficient în eradicarea streptococilor din orofaringe. Cu toate acestea, nu sunt disponibile date care să stabilească eficacitatea Duricef pentru profilaxia febrei reumatice ulterioare.
notă: testele de cultură și susceptibilitate trebuie inițiate înainte și în timpul tratamentului. Atunci când este indicat, trebuie efectuate studii privind funcția renală.pentru a reduce dezvoltarea bacteriilor rezistente la medicamente și pentru a menține eficacitatea Duricef și a altor medicamente antibacteriene, Duricef trebuie utilizat numai pentru tratarea sau prevenirea infecțiilor care sunt dovedite sau puternic suspectate a fi cauzate de bacterii sensibile. Când sunt disponibile informații despre cultură și susceptibilitate, acestea trebuie luate în considerare la selectarea sau modificarea terapiei antibacteriene. În absența unor astfel de date, epidemiologia locală și modelele de susceptibilitate pot contribui la selecția empirică a terapiei.
contraindicații
Duricef este contraindicat la pacienții cu alergie cunoscută la grupul cefalosporinic de antibiotice.
avertismente
înainte de instituirea tratamentului cu Duricef, trebuie efectuată o anchetă atentă pentru a determina dacă pacientul a avut reacții de hipersensibilitate anterioare la CEFADROXIL, cefalosporine, peniciline sau alte medicamente. DACĂ ACEST PRODUS TREBUIE ADMINISTRAT PACIENȚILOR SENSIBILI LA PENICILINĂ, SE RECOMANDĂ PRUDENȚĂ, DEOARECE SENSIBILITATEA ÎNCRUCIȘATĂ ÎNTRE ANTIBIOTICELE BETA-LACTAMICE A FOST CLAR DOCUMENTATĂ ȘI POATE APĂREA LA PÂNĂ LA 10% DINTRE PACIENȚII CU ANTECEDENTE DE ALERGIE LA PENICILINĂ.
dacă apare o reacție alergică la Duricef, întrerupeți medicamentul. REACȚIILE GRAVE DE HIPERSENSIBILITATE ACUTĂ POT NECESITA TRATAMENT CU EPINEFRINĂ ȘI ALTE MĂSURI DE URGENȚĂ, INCLUSIV OXIGEN, FLUIDE INTRAVENOASE, ANTIHISTAMINICE INTRAVENOASE, CORTICOSTEROIZI, AMINE PRESOARE ȘI GESTIONAREA CĂILOR RESPIRATORII, AȘA CUM ESTE INDICAT CLINIC.
diareea asociată cu Clostridium difficile (CDAD) a fost raportată cu utilizarea aproape a tuturor agenților antibacterieni, inclusiv Duricef, și poate varia în severitate de la diaree ușoară până la colită fatală. Tratamentul cu agenți antibacterieni modifică flora normală a colonului, ducând la creșterea excesivă a C. difficile.
C. difficile produce toxinele A și B care contribuie la dezvoltarea CDAD. Tulpinile producătoare de hipertoxină de C. difficile determină creșterea morbidității și mortalității, deoarece aceste infecții pot fi refractare la terapia antimicrobiană și pot necesita colectomie. CDAD trebuie luat în considerare la toți pacienții care prezintă diaree după utilizarea antibioticelor. Este necesar un istoric medical atent, deoarece s-a raportat apariția CDAD la peste două luni de la administrarea agenților antibacterieni.
dacă CDAD este suspectat sau confirmat, poate fi necesară întreruperea utilizării continue a antibioticelor care nu sunt îndreptate împotriva C. difficile. După cum este indicat clinic, trebuie instituit un management adecvat al fluidelor și electroliților, suplimentarea cu proteine, tratamentul antibiotic al C. difficile și evaluarea chirurgicală.
Precauții
General
Duricef trebuie utilizat cu precauție în prezența funcției renale afectate semnificativ (rata clearance-ului creatininei mai mică de 50 mL/min și 1,73 M2). (Vezi dozare și administrare.) La pacienții cu insuficiență renală cunoscută sau suspectată, trebuie efectuate observații clinice atente și studii de laborator adecvate înainte și în timpul tratamentului.
prescrierea Duricef în absența unei infecții bacteriene dovedite sau puternic suspectate sau a unei indicații profilactice este puțin probabil să ofere beneficii pacientului și crește riscul dezvoltării bacteriilor rezistente la medicamente.
utilizarea prelungită a Duricef poate duce la creșterea excesivă a organismelor nesusceptibile. Observarea atentă a pacientului este esențială. Dacă apare suprainfecția în timpul terapiei, trebuie luate măsuri adecvate.
Duricef trebuie prescris cu precauție la persoanele cu antecedente de afecțiuni gastro-intestinale, în special colită.
informații pentru pacienți
pacienții trebuie sfătuiți ca medicamentele antibacteriene, inclusiv Duricef, să fie utilizate numai pentru tratarea infecțiilor bacteriene. Nu tratează infecțiile virale (de exemplu, răceala obișnuită). Când Duricef este prescris pentru a trata o infecție bacteriană, pacienților trebuie să li se spună că, deși este obișnuit să se simtă mai bine la începutul tratamentului, medicamentul trebuie luat exact așa cum este indicat. Omiterea dozelor sau nefinalizarea întregului ciclu de terapie poate (1) scădea eficacitatea tratamentului imediat și (2) crește probabilitatea ca bacteriile să dezvolte rezistență și să nu fie tratabile de Duricef sau alte medicamente antibacteriene în viitor.
diareea este o problemă comună cauzată de antibiotice, care se termină de obicei atunci când antibioticul este întrerupt. Uneori, după începerea tratamentului cu antibiotice, pacienții pot dezvolta scaune apoase și sângeroase (cu sau fără crampe stomacale și febră) chiar și la două sau mai multe luni după ce au luat ultima doză de antibiotic. Dacă se întâmplă acest lucru, pacienții trebuie să contacteze medicul cât mai curând posibil.
interacțiuni medicamentoase/teste de laborator
testele Coombs directe pozitive au fost raportate în timpul tratamentului cu antibiotice cefalosporine. În studiile hematologice sau în procedurile de transfuzie încrucișată atunci când testele antiglobulină sunt efectuate pe partea minoră sau în testarea Coombs a nou-născuților ale căror mame au primit antibiotice cefalosporine înainte de naștere, trebuie recunoscut faptul că un test Coombs pozitiv se poate datora medicamentului.
carcinogeneză, mutageneză și afectarea fertilității
nu s-au efectuat studii pe termen lung pentru determinarea potențialului carcinogen. Nu s-au efectuat teste de toxicitate genetică.
sarcina: Sarcina categoria B
studiile privind reproducerea au fost efectuate la șoareci și șobolani la doze de până la 11 ori mai mari decât doza umană și nu au evidențiat nicio dovadă de afectare a fertilității sau de afectare a fătului din cauza cefadroxilului monohidrat. Cu toate acestea, nu există studii adecvate și bine controlate la femeile gravide. Deoarece studiile de reproducere la animale nu sunt întotdeauna predictive pentru răspunsul uman, acest medicament trebuie utilizat în timpul sarcinii numai dacă este clar necesar.
travaliul și livrarea
Duricef nu a fost studiat pentru utilizare în timpul travaliului și livrării. Tratamentul trebuie administrat numai dacă este absolut necesar.
mamele care alăptează
se recomandă prudență atunci când cefadroxil monohidrat este administrat unei mame care alăptează.
utilizare pediatrică
(vezi dozare și administrare.)
utilizare geriatrică
Din aproximativ 650 de pacienți cărora li s-a administrat cefadroxil pentru tratamentul infecțiilor tractului urinar în trei studii clinice, 28% aveau 60 de ani și peste, în timp ce 16% aveau 70 de ani și peste. Din aproximativ 1000 de pacienți care au primit cefadroxil pentru tratamentul infecției cutanate și a structurii pielii în 14 studii clinice, 12% au fost de 60 de ani și peste, în timp ce 4% au fost de 70 de ani și peste. În aceste studii nu s-au observat diferențe generale în ceea ce privește siguranța între pacienții vârstnici și pacienții mai tineri. Studiile clinice cu cefadroxil pentru tratamentul faringitei sau amigdalitei nu au inclus un număr suficient de pacienți cu vârsta de 65 de ani și peste pentru a determina dacă răspund diferit față de pacienții mai tineri. Alte experiențe clinice raportate cu cefadroxil nu au identificat diferențe în răspunsurile dintre pacienții vârstnici și cei mai tineri, dar nu poate fi exclusă o sensibilitate mai mare a unor persoane în vârstă.
Cefadroxilul este excretat substanțial prin rinichi, iar ajustarea dozei este indicată la pacienții cu insuficiență renală (vezi dozare și administrare: insuficiență renală). Deoarece este mai probabil ca pacienții vârstnici să aibă o funcție renală scăzută, trebuie să se acorde atenție selectării dozei și poate fi utilă monitorizarea funcției renale.
reacții Adverse
gastro-intestinale
debutul colitei pseudomembranoase simptomele pot apărea în timpul sau după tratamentul cu antibiotice (vezi avertismente). Dispepsia, greața și vărsăturile au fost raportate rar. De asemenea, a apărut diaree.
hipersensibilitate
au fost observate alergii (sub formă de erupție cutanată, urticarie, angioedem și prurit). Aceste reacții au scăzut de obicei la întreruperea tratamentului. De asemenea, a fost raportată anafilaxie.
alte
alte reacții au inclus disfuncție hepatică, inclusiv colestază și creșteri ale transaminazelor serice, prurit genital, monilioză genitală, vaginită, neutropenie tranzitorie moderată, febră. Au fost raportate rar agranulocitoză, trombocitopenie, insuficiență hepatică idiosincratică, eritem multiform, sindrom Stevens-Johnson, boală serică și artralgie.
în plus față de reacțiile adverse enumerate mai sus, care au fost observate la pacienții tratați cu cefadroxil, au fost raportate următoarele reacții adverse și teste de laborator modificate pentru antibioticele din clasa cefalosporinei:
necroliză epidermică toxică, durere abdominală, suprainfecție, disfuncție renală, nefropatie toxică, anemie aplastică, anemie hemolitică, hemoragie, timp prelungit de protrombină, test Coombs pozitiv, creșterea BUN, creșterea creatininei, creșterea fosfatazei alcaline, creșterea aspartat aminotransferazei (AST), creșterea alanin aminotransferazei (ALT), creșterea bilirubinei, creșterea LDH, eozinofilie, pancitopenie, neutropenie.
Mai multe cefalosporine au fost implicate în declanșarea convulsiilor, în special la pacienții cu insuficiență renală, când doza nu a fost redusă (vezi dozare și administrare și supradozaj). Dacă apar convulsii asociate terapiei medicamentoase, medicamentul trebuie întrerupt. Terapia anticonvulsivantă poate fi administrată dacă este indicată clinic.
supradozaj
Un studiu efectuat la copii cu vârsta sub șase ani a sugerat că ingestia a mai puțin de 250 mg / kg de cefalosporine nu este asociată cu rezultate semnificative. Nu este necesară nicio altă acțiune decât sprijinul general și observarea. Pentru cantități mai mari de 250 mg/kg, induceți golirea gastrică.
la cinci pacienți anurici, s-a demonstrat că o medie de 63% dintr-o doză orală de 1 g este extrasă din organism în timpul unei sesiuni de hemodializă de 6-8 ore.
Duricef dozare și Administrare
Duricef este acid-stabil și poate fi administrat pe cale orală, indiferent de mese. Administrarea cu alimente poate fi utilă în diminuarea potențialelor afecțiuni gastro-intestinale asociate ocazional cu terapia orală cu cefalosporină.
adulți
infecții ale tractului urinar: Pentru infecțiile necomplicate ale tractului urinar inferior (adică cistita), doza uzuală este de 1 sau 2 g pe zi într-o singură doză (Q.d.) sau divizată (b.i.d.).
pentru toate celelalte infecții ale tractului urinar doza uzuală este de 2 g pe zi în doze divizate (b.I.d.).
infecții cutanate și ale structurii pielii: pentru infecțiile cutanate și ale structurii pielii, doza uzuală este de 1 g pe zi în doze unice (Q.d.) sau divizate (b.I.d.).
faringită și amigdalită: tratamentul faringitei streptococice beta-hemolitice din grupa A și amigdalitei—1 g pe zi în doze unice (q.d.) sau divizate (b.i.d.) timp de 10 zile.
copii
pentru infecțiile tractului urinar, doza zilnică recomandată pentru copii este de 30 mg/kg și zi în doze divizate la fiecare 12 ore. Pentru faringită, amigdalită și impetigo, doza zilnică recomandată pentru copii este de 30 mg/kg/zi într-o singură doză sau în doze egale divizate la fiecare 12 ore. Pentru alte infecții ale pielii și ale structurii pielii, doza zilnică recomandată este de 30 mg/kg și zi în doze egale divizate la fiecare 12 ore. În tratamentul infecțiilor streptococice beta-hemolitice, trebuie administrată o doză terapeutică de Duricef timp de cel puțin 10 zile.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 lingurițe |
insuficiență renală
la pacienții cu insuficiență renală, doza de cefadroxil monohidrat trebuie ajustată în funcție de ratele de clearance al creatininei pentru a preveni acumularea de medicamente. Se sugerează următorul program. La adulți, doza inițială este de 1000 mg Duricef, iar doza de întreținere (pe baza ratei clearance-ului creatininei ) este de 500 mg la intervalele de timp enumerate mai jos.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients cu valori ale clearance-ului creatininei mai mari de 50 mL/min pot fi tratate ca și cum ar fi pacienți cu funcție renală normală.
| Dimensiunea flaconului | instrucțiuni de reconstituire |
| 100 ml |
se suspendă într-un total de 67 ml apă. metodă: atingeți ușor sticla pentru a slăbi pulberea. se adaugă 67 mL de apă în două porții. agitați bine după fiecare adăugare. |
| 75 mL |
se suspendă într-un total de 51 mL apă. metodă: atingeți ușor sticla pentru a slăbi pulberea. se adaugă 51 mL de apă în două porții. agitați bine după fiecare adăugare. |
| 50 mL |
se suspendă într-un total de 34 mL apă. metodă: atingeți ușor sticla pentru a slăbi pulberea. se adaugă 34 mL de apă în două porții. agitați bine după fiecare adăugare. |
|
după reconstituire, a se păstra la frigider. Agitați bine înainte de utilizare. a se ține recipientul bine închis. Aruncați porțiunea neutilizată după 14 zile. |
|
cum se livrează Duricef
duricef (cefadroxil monohidrat, USP) 500 mg capsule: capsule gelatinoase tari opace, maro și albe, inscripționate cu „PPP” și „784” la un capăt și cu „duricef” și „500 mg” la celălalt capăt.
capsulele se livrează după cum urmează:
N 0430-0780-19 flacon a câte 50
a se păstra la temperatura controlată a încăperii 15% -30% C (59% -86% F).
Duricef 1 gram comprimate: de culoare albă până la aproape albă, bisectată, de formă ovală, inscripționată cu „PPP” pe o parte a bisectei și „785” pe cealaltă parte a bisectei. Comprimatele se livrează după cum urmează:
N 0430-0781-19 flacon a câte 50
a se păstra la temperatura controlată a camerei 15% -30% C (59% -86% F).
Duricef pentru suspensie orală este aromatizat cu ananas-portocaliu și este disponibil după cum urmează:
250 mg/5 mL N 0430-2782-15 flacon de 50 mL
N 0430-2782-17 flacon de 100 mL
500 mg/5 mL n 0430-2783-16 flacon de 75 mL
N 0430-2783-17 flacon de 100 mL
înainte de reconstituire: a se păstra la temperatura controlată a încăperii 15 -30 -30 -3 (59 -86 -8).
1. Comitetul Național pentru standarde clinice de laborator, standard aprobat, standarde de performanță pentru testul de susceptibilitate a discului antimicrobian, ediția a 4-a, Vol. 10 (7): m2-A4, Villanova, PA, aprilie, 1990.
2. Comitetul Național pentru standarde clinice de laborator, standard aprobat: Metode de diluare teste de susceptibilitate antimicrobiană pentru bacteriile care cresc aerob, ediția a 2-a, Vol. 10 (8): M7-A2, Villanova, PA, aprilie, 1990.
fabricat de Bristol-Myers Squibb Co.
Princeton, NJ 08543
pentru Warner Chilcott Company, Inc.
Fajardo, PR 00738
comercializat de Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: cefalosporine de primă generație
resurse pentru consumatori
- citire avansată
resurse profesionale
- informații de prescriere
- Cefadroxil suspensie orală (FDA)
ghiduri de tratament conexe
- prevenirea endocarditei bacteriene
- infecția pielii și structurii
- impetigo
- infecții renale
- … + 4 mai multe
Disclaimer Medical
Leave a Reply