Duricef
Generieke naam: cefadroxil
doseringsvorm: poeder, voor suspensie
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 21 April 2020.
- overzicht
- bijwerkingen
- dosering
- professionele
- interacties
- meer
om de ontwikkeling van geneesmiddelresistente bacteriën te verminderen en de werkzaamheid van Duricef® en andere antibacteriële geneesmiddelen te behouden, mag Duricef alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is aangetoond of sterk vermoed wordt dat ze door bacteriën worden veroorzaakt.
Duricef beschrijving
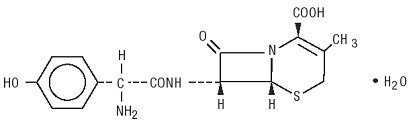
Duricef is een semisynthetisch cefalosporine-antibioticum bestemd voor orale toediening. Het is een wit tot geelwit kristallijn poeder. Het is oplosbaar in water en zuurvast. Het wordt chemisch aangeduid als 5-Thia-1-azabicyclooct-2-een-2-carbonzuur, 7-amino]-3-methyl-8-oxo -, monohydraat] -. Het heeft de formule C16H17N3O5S • H2O en het molecuulgewicht van 381,40. Het heeft de volgende structuurformule:
Duricef filmomhulde tabletten, 1 g, bevatten de volgende inactieve bestanddelen: microkristallijne cellulose, hydroxypropylmethylcellulose, magnesiumstearaat, polyethyleenglycol, polysorbaat 80, simethiconemulsie en titaandioxide.
Duricef voor orale suspensie bevat de volgende inactieve bestanddelen: FD&C Yellow No.6, aroma ‘ s (natuurlijk en kunstmatig), polysorbaat 80, natriumbenzoaat, sucrose en xanthaangom.
Duricef capsules bevatten de volgende inactieve bestanddelen: D&C Red No.28, FD&C Blue No. 1, FD&C Red No. 40, gelatine, magnesiumstearaat en titaandioxide.
Duricef-Klinische Farmacologie
Duricef wordt na orale toediening snel geabsorbeerd. Na enkelvoudige doses van 500 mg en 1000 mg waren de gemiddelde piekserumconcentraties respectievelijk ongeveer 16 en 28 µg / mL. 12 uur na toediening waren meetbare waarden aanwezig. Meer dan 90% van het geneesmiddel wordt onveranderd uitgescheiden in de urine binnen 24 uur. De maximale urineconcentraties zijn ongeveer 1800 µg / mL gedurende de periode na een eenmalige orale dosis van 500 mg. Verhogingen van de dosering leiden over het algemeen tot een evenredige verhoging van de Duricef (cefadroxil monohydraat, USP) urineconcentratie. De antibioticaconcentratie in de urine werd na een dosis van 1 g gedurende 20 tot 22 uur ruim boven het MIC van gevoelige pathogenen in de urine gehouden.
Microbiologie
In vitro tests tonen aan dat de cefalosporinen bactericide zijn vanwege hun remming van celwandsynthese. Cefadroxil is werkzaam gebleken tegen de volgende organismen, zowel in vitro als bij klinische infecties (zie indicaties en gebruik):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Het heeft geen activiteit tegen Pseudomonas soorten en Acinetobacter calcoaceticus (voorheen Mima en Herellea soorten).
gevoeligheidstesten: Diffusietechnieken
het gebruik van antibioticaschijfgevoeligheidstesten die de zonediameter meten, geeft een nauwkeurige schatting van de gevoeligheid voor antibiotica. Een van deze standaardprocedure1 die is aanbevolen voor gebruik met schijven om de gevoeligheid van organismen voor cefadroxil te testen, gebruikt de cephalosporineklasse (cephalothine) schijf. De interpretatie omvat de correlatie van de diameters verkregen in de schijftest met de minimum inhibitory concentration (MIC) voor cefadroxil.
rapporten van het laboratorium met de resultaten van de standaard gevoeligheidstest op één schijf met een 30 µg cefalothineschijf moeten worden geïnterpreteerd aan de hand van de volgende criteria::
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of “Gevoelig” geeft aan dat de ziekteverwekker waarschijnlijk wordt geremd door over het algemeen haalbare bloedspiegels. Een rapport van “middelmatige gevoeligheid” suggereert dat het organisme gevoelig zou zijn als hoge dosering wordt gebruikt of als de infectie beperkt is tot weefsel en vloeistoffen (bijv. urine) waarin hoge antibioticaspiegels worden bereikt. Een melding van” resistent ” geeft aan dat bereikbare concentraties van het antibioticum waarschijnlijk niet remmend zijn en dat een andere therapie moet worden gekozen.
gestandaardiseerde procedures vereisen het gebruik van controleorganismen in het laboratorium. De 30 µg cefalothine schijf moet de volgende zone diameters geven:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (met inbegrip van microdilutie) methode2 of gelijkwaardig, kan een bacterieel isolaat als gevoelig worden beschouwd indien de MIC-waarde (minimum inhibitory concentration) voor cefalothine 8 µg/mL of minder bedraagt. Organismen worden als resistent beschouwd als de MIC 32 µg/mL of meer bedraagt. Organismen met een MIC-waarde van minder dan 32 µg/mL maar meer dan 8 µg/mL zijn intermediair.
zoals bij standaarddiffusiemethoden, vereisen verdunningsprocedures het gebruik van controleorganismen in het laboratorium. Standaard cefalothinepoeder moet MIC-waarden opleveren tussen 0,12 µg/mL en 0,5 µg / mL voor Staphylococcus aureus ATCC 29213. Voor Escherichia coli ATCC 25922 moet het MIC-bereik tussen 4,0 µg/mL en 16,0 µg/mL liggen. Voor Streptococcus faecalis ATCC 29212 moet het MIC-bereik tussen 8,0 en 32,0 µg/mL liggen.
indicaties en gebruik voor Duricef
Duricef is geïndiceerd voor de behandeling van patiënten met infectie veroorzaakt door gevoelige stammen van de aangewezen organismen bij de volgende ziekten:
urineweginfecties veroorzaakt door E. coli, P. mirabilis en Klebsiella soorten.
huid-en huidstructuur infecties veroorzaakt door stafylokokken en/of streptokokken.
faryngitis en / of tonsillitis veroorzaakt door Streptococcus pyogenes (Groep A beta-hemolytische streptokokken).
Opmerking: Alleen penicilline via intramusculaire toediening is werkzaam gebleken bij de profylaxe van reumatische koorts. Duricef is over het algemeen effectief in de uitroeiing van streptokokken uit de orofarynx. Er zijn echter geen gegevens beschikbaar over de werkzaamheid van Duricef voor de profylaxe van daaropvolgende reumatische koorts.
opmerking: kweek-en gevoeligheidstesten moeten worden gestart voor en tijdens de behandeling. Indien geïndiceerd moet onderzoek naar de nierfunctie worden uitgevoerd.
om de ontwikkeling van geneesmiddelresistente bacteriën te verminderen en de werkzaamheid van Duricef en andere antibacteriële geneesmiddelen te behouden, mag Duricef alleen worden gebruikt voor de behandeling of preventie van infecties waarvan is bewezen of sterk vermoed wordt dat deze door gevoelige bacteriën worden veroorzaakt. Wanneer cultuur-en gevoeligheidsinformatie beschikbaar zijn, moet hiermee rekening worden gehouden bij het selecteren of wijzigen van antibacteriële therapie. Bij gebrek aan dergelijke gegevens kunnen lokale epidemiologie en gevoeligheidspatronen bijdragen aan de empirische selectie van therapie.
contra-indicaties
Duricef is gecontra-indiceerd bij patiënten met een bekende allergie voor de cefalosporinegroep van antibiotica.
waarschuwingen
voordat de behandeling met Duricef wordt ingesteld, moet zorgvuldig worden onderzocht of de patiënt eerder overgevoeligheidsreacties heeft gehad op CEFADROXIL, cefalosporinen, penicillinen of andere geneesmiddelen. ALS DIT PRODUCT AAN PENICILLINEGEVOELIGE PATIËNTEN MOET WORDEN GEGEVEN, MOET VOORZICHTIGHEID WORDEN BETRACHT OMDAT KRUISGEVOELIGHEID TUSSEN BÈTALACTAMANTIBIOTICA DUIDELIJK IS GEDOCUMENTEERD EN KAN OPTREDEN BIJ MAXIMAAL 10% VAN DE PATIËNTEN MET EEN VOORGESCHIEDENIS VAN PENICILLINEALLERGIE.
als er een allergische reactie op Duricef optreedt, stop dan met het gebruik van het geneesmiddel. ERNSTIGE ACUTE OVERGEVOELIGHEIDSREACTIES KUNNEN BEHANDELING MET ADRENALINE EN ANDERE NOODMAATREGELEN VEREISEN, WAARONDER ZUURSTOF, INTRAVENEUZE VLOEISTOFFEN, INTRAVENEUZE ANTIHISTAMINICA, CORTICOSTEROÏDEN, BLOEDDRUKVERHOGENDE AMINES EN LUCHTWEGMANAGEMENT, INDIEN KLINISCH GEÏNDICEERD.
Clostridium difficile geassocieerde diarree (CDAD) is gemeld bij gebruik van bijna alle antibacteriële middelen, waaronder Duricef, en kan in ernst variëren van lichte diarree tot fatale colitis. Behandeling met antibacteriële middelen verandert de normale flora van de dikke darm leidt tot overgroei van C. difficile.
C. difficile produceert toxinen A en B die bijdragen aan de ontwikkeling van CDAD. Hypertoxine producerende stammen van C. difficile veroorzaken verhoogde morbiditeit en mortaliteit, aangezien deze infecties ongevoelig voor antimicrobiële therapie kan zijn en colectomie kan vereisen. CDAD moet worden overwogen bij alle patiënten die diarree hebben na gebruik van antibiotica. Zorgvuldige medische anamnese is noodzakelijk omdat CDAD meer dan twee maanden na toediening van antibacteriële middelen is gemeld.
als CDAD wordt vermoed of bevestigd, moet het gebruik van antibiotica die niet gericht zijn tegen C. difficile mogelijk worden stopgezet. Indien klinisch geïndiceerd, dienen adequate vocht-en elektrolytenbehandeling, proteïnesuppletie, behandeling met antibiotica van C. difficile en chirurgische evaluatie te worden ingesteld.
voorzorgsmaatregelen
Algemeen
Duricef dient met voorzichtigheid te worden gebruikt bij een duidelijk verminderde nierfunctie (creatinineklaring minder dan 50 mL/min / 1,73 M2). (Zie dosering en toediening.) Bij patiënten met een bekende of vermoede nierfunctiestoornis dienen voorafgaand aan en tijdens de behandeling zorgvuldige klinische observatie en geschikte laboratoriumonderzoeken te worden uitgevoerd.
het voorschrijven van Duricef bij afwezigheid van een aangetoonde of sterk vermoede bacteriële infectie of een profylactische indicatie zal waarschijnlijk geen voordeel opleveren voor de patiënt en verhoogt het risico op de ontwikkeling van geneesmiddelresistente bacteriën.
langdurig gebruik van Duricef kan leiden tot overgroei van niet-waarneembare organismen. Zorgvuldige observatie van de patiënt is essentieel. Als tijdens de behandeling een superinfectie optreedt, moeten passende maatregelen worden genomen.
Duricef dient met voorzichtigheid te worden voorgeschreven bij personen met een voorgeschiedenis van gastro-intestinale aandoeningen, met name colitis.
informatie voor patiënten
patiënten dienen te worden geadviseerd dat antibacteriële geneesmiddelen, waaronder Duricef, alleen mogen worden gebruikt voor de behandeling van bacteriële infecties. Ze behandelen geen virale infecties (bijvoorbeeld verkoudheid). Wanneer Duricef wordt voorgeschreven om een bacteriële infectie te behandelen, moeten patiënten worden verteld dat hoewel het gebruikelijk is om zich vroeg in de loop van de therapie beter te voelen, de medicatie precies moet worden genomen zoals voorgeschreven. Het overslaan van doses of het niet voltooien van de volledige behandelingskuur kan (1) de effectiviteit van de onmiddellijke behandeling verminderen en (2) de kans vergroten dat bacteriën resistentie ontwikkelen en in de toekomst niet te behandelen zijn met Duricef of andere antibacteriële geneesmiddelen.
diarree is een veel voorkomend probleem veroorzaakt door antibiotica, dat meestal eindigt wanneer het antibioticum wordt gestopt. Soms kunnen patiënten na het starten van de behandeling met antibiotica waterige en bloederige ontlasting (met of zonder maagkrampen en koorts) ontwikkelen, zelfs tot twee of meer maanden na het nemen van de laatste dosis van het antibioticum. Als dit gebeurt, moeten patiënten zo snel mogelijk contact opnemen met hun arts.
geneesmiddel / laboratoriumtest interacties
positieve directe Coombs-tests zijn gemeld tijdens behandeling met cefalosporine-antibiotica. In hematologisch onderzoek of in transfusie cross-matching procedures wanneer antiglobulinetests worden uitgevoerd aan de kleine kant of bij Coombs’ testen van pasgeborenen van wie de moeders cefalosporine antibiotica hebben gekregen vóór de bevalling, moet worden erkend dat een positieve Coombs’ test kan worden veroorzaakt door het geneesmiddel.
carcinogenese, mutagenese en aantasting van de vruchtbaarheid
Er zijn geen langetermijnstudies uitgevoerd om het carcinogeen potentieel te bepalen. Er zijn geen genetische toxiciteitstests uitgevoerd.
zwangerschap: Zwangerschapscategorie B
reproductiestudies zijn uitgevoerd bij muizen en ratten met doses tot 11 maal de humane dosis en er zijn geen aanwijzingen gevonden voor verminderde vruchtbaarheid of schade aan de foetus als gevolg van cefadroxilmonohydraat. Er zijn echter geen adequate en goed gecontroleerde studies bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de menselijke respons, moet dit medicijn tijdens de zwangerschap alleen worden gebruikt als het duidelijk nodig is.
arbeid en bevalling
Duricef is niet onderzocht voor gebruik tijdens de bevalling. Behandeling mag alleen worden gegeven als dit duidelijk noodzakelijk is.
moeders die borstvoeding geven
voorzichtigheid is geboden wanneer cefadroxil monohydraat wordt toegediend aan een moeder die borstvoeding geeft.
gebruik bij kinderen
(zie dosering en toediening.)
geriatrisch gebruik
van ongeveer 650 patiënten die cefadroxil kregen voor de behandeling van urineweginfecties in drie klinische studies was 28% 60 jaar en ouder, terwijl 16% 70 jaar en ouder was. Van de ongeveer 1000 patiënten die in 14 klinische studies cefadroxil kregen voor de behandeling van huid-en huidstructuur-infecties, was 12% 60 jaar en ouder en was 4% 70 jaar en ouder. Er werden in deze studies geen algemene verschillen in veiligheid waargenomen tussen oudere patiënten en jongere patiënten. Klinische studies met cefadroxil voor de behandeling van faryngitis of tonsillitis omvatten niet voldoende patiënten van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten. Andere gemelde klinische ervaring met cefadroxil heeft geen verschillen in respons tussen oudere en jongere patiënten aangetoond, maar een grotere gevoeligheid van sommige oudere personen kan niet worden uitgesloten.
Cefadroxil wordt grotendeels door de nieren uitgescheiden en aanpassing van de dosering is geïndiceerd voor patiënten met een nierfunctiestoornis (zie dosering en toediening: nierfunctiestoornis). Omdat oudere patiënten vaker een verminderde nierfunctie hebben, is voorzichtigheid geboden bij het kiezen van de dosis en kan het nuttig zijn de nierfunctie te controleren.
bijwerkingen
gastro-intestinale
symptomen van pseudomembraneuze colitis kunnen tijdens of na behandeling met antibiotica optreden (zie waarschuwingen). Dyspepsie, misselijkheid en braken zijn zelden gemeld. Diarree is ook opgetreden.
overgevoeligheid
allergieën (in de vorm van huiduitslag, urticaria, angio-oedeem en pruritus) zijn waargenomen. Deze reacties verdwenen gewoonlijk na stopzetting van het geneesmiddel. Anafylaxie is ook gemeld.
andere
andere reacties waren leverdysfunctie waaronder cholestase en verhogingen van serumtransaminase, genitale pruritus, genitale moniliasis, vaginitis, matige voorbijgaande neutropenie, koorts. Agranulocytose, trombocytopenie, idiosyncratisch leverfalen, erythema multiforme, Stevens-Johnson syndroom, serumziekte en artralgie zijn zelden gemeld.
naast de hierboven genoemde bijwerkingen die zijn waargenomen bij patiënten behandeld met cefadroxil, zijn de volgende bijwerkingen en gewijzigde laboratoriumtesten gemeld voor cefalosporine-klasse antibiotica:
toxische epidermale necrolyse, buikpijn, superinfectie, nierdisfunctie, toxische nefropathie, aplastische anemie, hemolytische anemie, bloeding, verlengde protrombinetijd, positieve Coombs-test, verhoogd BUN, verhoogd creatinine, verhoogd alkalische fosfatase, verhoogd aspartaataminotransferase (AST), verhoogd alanineaminotransferase (ALT), verhoogd bilirubine, verhoogd LDH, eosinofilie, pancytopenie, neutropenie.
verschillende cefalosporinen zijn betrokken bij het veroorzaken van aanvallen, met name bij patiënten met een nierfunctiestoornis, wanneer de dosering niet werd verlaagd (zie dosering en toediening en overdosering). Als epileptische aanvallen geassocieerd met medicamenteuze behandeling optreden, moet het geneesmiddel worden gestaakt. Anticonvulsiva kunnen worden toegediend indien dit klinisch geïndiceerd is.
overdosering
een onderzoek bij kinderen jonger dan zes jaar suggereerde dat inname van minder dan 250 mg/kg cefalosporinen niet geassocieerd is met significante resultaten. Er is geen andere actie nodig dan algemene ondersteuning en observatie. Bij hoeveelheden hoger dan 250 mg/kg, maaglediging induceren.
bij vijf anurie patiënten werd aangetoond dat gemiddeld 63% van een orale dosis van 1 g uit het lichaam wordt geëxtraheerd tijdens een hemodialysesessie van 6-8 uur.
Duricef dosering en toediening
Duricef is zuurstabiel en kan oraal worden toegediend zonder rekening te houden met maaltijden. Toediening met voedsel kan nuttig zijn bij het verminderen van potentiële gastro-intestinale klachten die soms geassocieerd worden met orale cefalosporine therapie.
volwassenen
urineweginfecties: Voor ongecompliceerde lagere urineweginfecties (d.w.z. cystitis) is de gebruikelijke dosering 1 of 2 g per dag in een enkele (q.d.) of verdeelde doses (b.i.d.).
voor alle andere urineweginfecties is de gebruikelijke dosering 2 g per dag in verdeelde doses (b.i.d.).
infecties van de huid en de huidstructuur: voor infecties van de huid en de huidstructuur is de gebruikelijke dosering 1 g per dag in enkelvoudige (q.d.) of verdeelde doses (b.i.d.).
faryngitis en Tonsillitis: behandeling van bèta-hemolytische streptokokken faryngitis en tonsillitis van groep A-1 g per dag in enkelvoudige (q.d.) of verdeelde doses (b.i.d.) gedurende 10 dagen.
kinderen
voor urineweginfecties is de aanbevolen dagelijkse dosering voor kinderen 30 mg/kg / dag in verdeelde doses om de 12 uur. Voor faryngitis, tonsillitis en impetigo is de aanbevolen dagelijkse dosering voor kinderen 30 mg/kg/dag in een enkele dosis of in gelijk verdeelde doses om de 12 uur. Voor andere infecties van de huid en de huidstructuur is de aanbevolen dagelijkse dosering 30 mg / kg / dag in gelijk verdeelde doses om de 12 uur. Bij de behandeling van bèta-hemolytische streptokokkeninfecties dient gedurende ten minste 10 dagen een therapeutische dosering Duricef te worden toegediend.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 tsp |
nierfunctiestoornis
bij patiënten met de dosering van cefadroxil-monohydraat moet worden aangepast aan de creatinineklaring om geneesmiddelaccumulatie te voorkomen. Het volgende schema wordt voorgesteld. Bij volwassenen is de aanvangsdosis 1000 mg Duricef en de onderhoudsdosis (gebaseerd op de creatinineklaring ) 500 mg met de hieronder vermelde tijdsintervallen.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients met een creatinineklaring van meer dan 50 mL/min kan worden behandeld alsof het patiënten met een normale nierfunctie.
| Fles Grootte | Reconstructie-acties voor Routebeschrijvingen |
| 100 mL |
op te Schorten in totaal 67 mL water. methode: tik licht tegen de fles om het poeder los te maken. voeg 67 mL water toe in twee porties. goed schudden na elke toevoeging. |
| 75 mL |
suspensie in totaal 51 mL water. methode: tik licht tegen de fles om het poeder los te maken. voeg 51 mL water in twee porties toe. goed schudden na elke toevoeging. |
| 50 mL |
suspensie in totaal 34 mL water. methode: tik licht tegen de fles om het poeder los te maken. voeg 34 mL water in twee porties toe. goed schudden na elke toevoeging. |
|
na reconstitutie in de koelkast bewaren. Goed schudden voor gebruik. de container zorgvuldig gesloten houden. Ongebruikte portie na 14 dagen weggooien. |
|
Hoe wordt Duricef geleverd
Duricef® (cefadroxil monohydraat, USP) 500 mg Capsules: ondoorzichtige, kastanjebruine en witte harde gelatinecapsules, aan één kant bedrukt met “PPP” en “784” en met “Duricef” en “500 mg” aan de andere kant.
Capsules worden als volgt geleverd:
N 0430-0780-19 fles van 50
Bewaren bij gecontroleerde kamertemperatuur 15°-30° C (59°-86° F).
Duricef ® 1 gram tabletten: wit tot gebroken wit, in doorsnede boven, ovaal, bedrukt met “PPP” aan de ene kant van de doorsnede en “785” aan de andere kant van de doorsnede. Tabletten worden als volgt geleverd:
n 0430-0781-19 fles van 50
Bewaren bij gecontroleerde kamertemperatuur 15°-30° C (59°-86° F).
Duricef® voor orale suspensie is op smaak gebracht met sinaasappel-ananas en wordt als volgt geleverd:
250 mg/5 mL n 0430-2782-15 50 mL fles
n 0430-2782-17 100 mL fles
500 mg/5 mL n 0430-2783-16 75 mL fles
n 0430-2783-17 100 mL fles
vóór reconstitutie: Bewaren bij gecontroleerde kamertemperatuur 15°-30° C (59°-86° F).
1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk Susceptibility Test, 4th Edition, Vol. 10 (7): M2-A4, Villanova, PA, April 1990.
2. Nationaal Comité voor klinische Laboratoriumnormen, goedgekeurde norm: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, April 1990.
vervaardigd door Bristol-Myers Squibb Co.
Princeton, NJ 08543
voor Warner Chilcott Company, Inc.
Fajardo, PR 00738
Op de markt gebracht door Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: cefalosporinen van de eerste generatie
consumentenhulpmiddelen
- geavanceerde lezing
professionele hulpmiddelen
- voorschrijfinformatie
- Cefadroxil orale suspensie (FDA)
gerelateerde behandelingsgidsen
- bacteriële Endocarditis preventie
- huid en structuurinfectie
- impetigo
- nierinfecties
- … + 4 meer
medische Disclaimer
Leave a Reply