Duricef
nazwa ogólna: cefadroksyl
postać dawkowania: proszek do sporządzania zawiesiny
Drugs.com. Ostatnia aktualizacja: 21 kwietnia 2020 r.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- Więcej
aby ograniczyć rozwój bakterii lekoopornych i utrzymać skuteczność Duricef® i innych leków przeciwbakteryjnych, Duricef powinien być stosowany wyłącznie w leczeniu lub zapobieganiu infekcjom, które są udowodnione lub silnie podejrzewane o wywoływanie przez bakterie.
Duricef opis
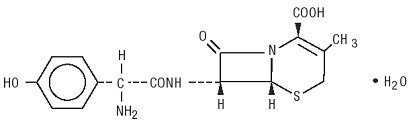
Duricef jest półsyntetycznym antybiotykiem cefalosporynowym przeznaczonym do podawania doustnego. Jest to krystaliczny proszek o barwie białej do żółtawobiałej. Jest rozpuszczalny w wodzie i jest stabilny kwasowo. Jest chemicznie oznaczony jako kwas 5-Tia-1-azabicyklookt-2-Eno-2-karboksylowy, 7-amino]-3-metylo-8-okso -, monohydrat] -. Ma wzór C16H17N3O5S * H2O i masę cząsteczkową 381,40. Ma on następujący wzór strukturalny:
Duricef tabletki powlekane, 1 g, zawierają następujące składniki nieaktywne: celuloza mikrokrystaliczna, hydroksypropylometyloceluloza, stearynian magnezu, glikol polietylenowy, polisorbat 80, Emulsja simetikonu i dwutlenek tytanu.
Duricef do sporządzania zawiesiny doustnej zawiera następujące nieaktywne składniki: FD& C żółty nr 6, aromaty (naturalne i sztuczne), polisorbat 80, benzoesan sodu, sacharoza i guma ksantanowa.
kapsułki Duricef zawierają następujące nieaktywne składniki: d&C czerwony nr 28, FD&C niebieski nr 1, FD & C czerwony nr 40, żelatyna, stearynian magnezu i dwutlenek tytanu.
Duricef – Farmakologia kliniczna
Duricef jest szybko wchłaniany po podaniu doustnym. Po podaniu pojedynczych dawek 500 mg i 1000 mg średnie maksymalne stężenia w surowicy wynosiły odpowiednio około 16 i 28 µg/mL. Mierzalne poziomy były obecne po 12 godzinach od podania. Ponad 90% leku jest wydalane w postaci niezmienionej z moczem w ciągu 24 godzin. Maksymalne stężenie w moczu wynosi około 1800 µg/mL w okresie po podaniu pojedynczej dawki doustnej 500 mg. Zwiększenie dawki powoduje na ogół proporcjonalne zwiększenie stężenia Duricef (cefadroksylu jednowodnego, USP) w moczu. Stężenie antybiotyku w moczu po podaniu dawki 1 g utrzymywało się znacznie powyżej MIC podatnych patogenów w moczu przez 20 do 22 godzin.
Mikrobiologia
testy in vitro wykazują, że cefalosporyny są bakteriobójcze ze względu na hamowanie syntezy ściany komórkowej. Wykazano, że cefadroksyl działa przeciw następującym organizmom zarówno in vitro, jak i w zakażeniach klinicznych (patrz wskazania i zastosowanie):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Nie wykazuje działania przeciwko gatunkom Pseudomonas i Acinetobacter calcoaceticus (dawniej gatunki Mima i Herellea).
testy podatności: techniki dyfuzji
zastosowanie antybiotykowych metod badania podatności dysku, które mierzą średnicę strefy, daje dokładne oszacowanie podatności na antybiotyki. Jedna z takich standardowych procedur1, zalecana do stosowania z dyskami do badania wrażliwości organizmów na cefadroksyl, wykorzystuje dysk klasy cefalosporyny (cephalothin). Interpretacja polega na korelacji średnic uzyskanych w teście dysku z minimalnym stężeniem hamującym (MIC) dla cefadroksylu.
raporty z laboratorium dające wyniki standardowego testu wrażliwości pojedynczego dysku z dyskiem cefalotyny 30 µg należy interpretować według następujących kryteriów:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of „Podatny” oznacza, że patogen może być hamowany przez ogólnie osiągalne poziomy we krwi. Raport „pośredniej podatności” sugeruje, że organizm byłby podatny, jeśli stosuje się wysokie dawki lub jeśli zakażenie ogranicza się do tkanek i płynów (np. moczu), w których osiąga się wysoki poziom antybiotyku. Raport „oporności” wskazuje, że jest mało prawdopodobne, aby możliwe do osiągnięcia stężenia antybiotyku były hamujące i należy wybrać inne leczenie.
standaryzowane procedury wymagają stosowania laboratoryjnych organizmów kontrolnych. Dysk cefalotyny 30 µg powinien mieć następujące średnice stref:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution Metoda 2 lub równoważna, izolat bakteryjny można uznać za wrażliwy, jeżeli wartość Mic (minimalne stężenie hamujące) dla cefalotyny wynosi 8 µg / mL lub mniej. Organizmy uważa się za oporne, jeżeli MIC wynosi 32 µg/mL lub więcej. Organizmy o wartości MIC mniejszej niż 32 µg/mL, ale większej niż 8 µg/mL są pośrednie.
podobnie jak w przypadku standardowych metod dyfuzji, procedury rozcieńczania wymagają użycia laboratoryjnych organizmów kontrolnych. Standardowy proszek cefalotyny powinien dawać wartości MIC w zakresie 0,12 µg / mL i 0,5 µg / mL dla Staphylococcus aureus ATCC 29213. W przypadku Escherichia coli ATCC 25922 zakres MIC powinien wynosić od 4,0 µg / mL do 16,0 µg/mL. W przypadku Streptococcus faecalis ATCC 29212 zakres MIC powinien wynosić od 8,0 do 32,0 µg / mL.
wskazania i zastosowanie produktu Duricef
Duricef jest wskazany w leczeniu pacjentów z zakażeniem wywołanym przez wrażliwe szczepy wyznaczonych organizmów w następujących chorobach:
zakażenia dróg moczowych wywołane przez gatunki E. coli, P. mirabilis i Klebsiella.
zakażenia skóry i struktury skóry wywołane przez gronkowce i (lub) paciorkowce.
zapalenie gardła i/lub zapalenie migdałków spowodowane przez Streptococcus pyogenes (paciorkowce beta-hemolityczne grupy a).
Uwaga: wykazano, że skuteczna w profilaktyce gorączki reumatycznej jest tylko penicylina podawana domięśniowo. Duricef jest ogólnie skuteczny w zwalczaniu paciorkowców z jamy ustnej i gardła. Jednakże dane dotyczące skuteczności produktu Duricef w profilaktyce późniejszej gorączki reumatycznej nie są dostępne.
Uwaga: Przed leczeniem i w jego trakcie należy rozpocząć badania dotyczące kultury i wrażliwości. Jeśli jest to wskazane, należy wykonać badania czynności nerek.
aby ograniczyć rozwój bakterii lekoopornych i utrzymać skuteczność Duricef i innych leków przeciwbakteryjnych, Duricef powinien być stosowany wyłącznie w leczeniu lub zapobieganiu zakażeniom, które są udowodnione lub silnie podejrzewane, że są spowodowane przez wrażliwe bakterie. Kiedy dostępne są informacje dotyczące kultury i wrażliwości, należy wziąć pod uwagę wybór lub modyfikację leczenia przeciwbakteryjnego. W przypadku braku takich danych miejscowa epidemiologia i wzorce wrażliwości mogą przyczynić się do empirycznego wyboru terapii.
przeciwwskazania
Duricef jest przeciwwskazany u pacjentów ze stwierdzoną alergią na antybiotyki z grupy cefalosporyn.
Ostrzeżenia
przed rozpoczęciem leczenia produktem Duricef należy dokładnie zbadać, czy u pacjenta występowały wcześniej reakcje nadwrażliwości na CEFADROKSYL, cefalosporyny, penicyliny lub inne leki. JEŚLI TEN PRODUKT MA BYĆ PODAWANY PACJENTOM WRAŻLIWYM NA PENICYLINĘ, NALEŻY ZACHOWAĆ OSTROŻNOŚĆ, PONIEWAŻ WRAŻLIWOŚĆ KRZYŻOWA WŚRÓD ANTYBIOTYKÓW BETA-LAKTAMOWYCH ZOSTAŁA WYRAŹNIE UDOKUMENTOWANA I MOŻE WYSTĄPIĆ DO 10% PACJENTÓW Z ALERGIĄ NA PENICYLINĘ W WYWIADZIE.
Jeśli wystąpi reakcja alergiczna na Duricef, należy przerwać stosowanie leku. CIĘŻKIE OSTRE REAKCJE NADWRAŻLIWOŚCI MOGĄ WYMAGAĆ LECZENIA EPINEFRYNĄ I INNYMI ŚRODKAMI DORAŹNYMI, W TYM TLENEM, PŁYNAMI DOŻYLNYMI, DOŻYLNYMI LEKAMI PRZECIWHISTAMINOWYMI, KORTYKOSTEROIDAMI, AMINAMI CIŚNIENIOWYMI I LECZENIEM DRÓG ODDECHOWYCH, ZGODNIE ZE WSKAZANIAMI KLINICZNYMI.
Clostridium difficile associated diarrhea (CDAD) donoszono o stosowaniu prawie wszystkich środków przeciwbakteryjnych, w tym Duricef, i może mieć nasilenie od łagodnej biegunki do śmiertelnego zapalenia jelita grubego. Leczenie środkami przeciwbakteryjnymi zmienia prawidłową florę jelita grubego prowadząc do przerostu C. difficile.
C. difficile produkuje toksyny A i B, które przyczyniają się do rozwoju CDAD. Hypertoxin produkujących szczepy C. difficile powodować zwiększoną zachorowalność i śmiertelność, jak te infekcje mogą być oporne na leczenie przeciwdrobnoustrojowe i może wymagać kolektomii. CDAD należy rozważyć u wszystkich pacjentów, u których występuje biegunka po zastosowaniu antybiotyku. Konieczna jest dokładna historia choroby, ponieważ zgłaszano występowanie CDAD ponad dwa miesiące po podaniu leków przeciwbakteryjnych.
w przypadku podejrzenia lub potwierdzenia CDAD, może być konieczne przerwanie stosowania antybiotyków nie skierowanych przeciwko C. difficile. Odpowiednie zarządzanie płynami i elektrolitami, suplementacja białkami, leczenie antybiotykami C. difficile i ocena chirurgiczna powinny być wdrożone zgodnie ze wskazaniami klinicznymi.
środki ostrożności
ogólne
produkt Duricef należy stosować ostrożnie u pacjentów ze znacznym zaburzeniem czynności nerek (klirens kreatyniny poniżej 50 mL/min/1, 73 M2). (Patrz dawkowanie i sposób podawania.) U pacjentów ze stwierdzonym lub podejrzewanym zaburzeniem czynności nerek przed rozpoczęciem leczenia i w jego trakcie należy przeprowadzić dokładną obserwację kliniczną i odpowiednie badania laboratoryjne.
przepisywanie produktu Duricef w przypadku braku udowodnionego lub silnie podejrzewanego zakażenia bakteryjnego lub wskazania profilaktycznego jest mało prawdopodobne, aby przynosiło korzyści pacjentowi i zwiększało ryzyko rozwoju bakterii lekoopornych.
długotrwałe stosowanie Duricef może prowadzić do przerostu organizmów niesusceptywnych. Niezbędna jest uważna obserwacja pacjenta. Jeśli podczas leczenia wystąpi nadkażenie, należy podjąć odpowiednie środki.
Duricef należy przepisywać ostrożnie u osób z chorobami przewodu pokarmowego w wywiadzie, w szczególności z zapaleniem jelita grubego.
informacje dla pacjentów
należy doradzić pacjentom, że leki przeciwbakteryjne, w tym Duricef, powinny być stosowane wyłącznie w leczeniu zakażeń bakteryjnych. Nie leczą infekcji wirusowych (na przykład przeziębienie). Kiedy Duricef jest przepisywany w leczeniu infekcji bakteryjnej, pacjentom należy powiedzieć, że chociaż często na początku leczenia czuje się lepiej, lek należy przyjmować dokładnie zgodnie z zaleceniami. Pomijanie dawek lub nie ukończenie pełnego cyklu terapii może (1) zmniejszyć skuteczność natychmiastowego leczenia i (2) zwiększyć prawdopodobieństwo, że bakterie rozwiną oporność i nie będą uleczalne za pomocą Duricef lub innych leków przeciwbakteryjnych w przyszłości.
biegunka jest częstym problemem spowodowanym przez antybiotyki, które zwykle kończy się po odstawieniu antybiotyku. Czasami po rozpoczęciu leczenia antybiotykami u pacjentów mogą pojawić się wodniste i krwawe stolce (z skurczami żołądka i gorączką lub bez) nawet po dwóch lub więcej miesiącach od przyjęcia ostatniej dawki antybiotyku. W takim przypadku pacjenci powinni jak najszybciej skontaktować się z lekarzem.
interakcje między lekami i badaniami laboratoryjnymi
podczas leczenia antybiotykami cefalosporynowymi zgłaszano pozytywne bezpośrednie testy Coombsa. W badaniach hematologicznych lub w procedurach krzyżowego dopasowania transfuzji, gdy testy antyglobulinowe są wykonywane po stronie mniejszej, lub w testach Coombsa u noworodków, których matki otrzymały antybiotyki z grupy cefalosporyn przed porodem, należy uznać, że pozytywny wynik testu Coombsa może być spowodowany lekiem.
Rakotwórczość, mutageneza i zaburzenia płodności
nie przeprowadzono długoterminowych badań w celu określenia potencjalnego działania rakotwórczego. Nie przeprowadzono badań toksyczności genetycznej.
ciąża: Ciąża Kategoria B
badania wpływu na reprodukcję przeprowadzono na myszach i szczurach w dawkach do 11 razy większych od dawek stosowanych u ludzi i nie wykazały żadnych objawów upośledzenia płodności lub uszkodzenia płodu spowodowanego jednowodnym cefadroksylem. Nie przeprowadzono jednak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania reprodukcji zwierząt nie zawsze są predykcyjne odpowiedzi człowieka, lek ten powinien być stosowany w czasie ciąży tylko wtedy, gdy jest to wyraźnie konieczne.
Praca i poród
Duricef nie był badany pod kątem stosowania podczas porodu i porodu. Leczenie należy stosować tylko wtedy, gdy jest to wyraźnie konieczne.
matki karmiące
należy zachować ostrożność podczas podawania cefadroksylu jednowodnego matce karmiącej.
do stosowania u dzieci
(Patrz dawkowanie i sposób podawania.
zastosowanie geriatryczne
z około 650 pacjentów, którzy otrzymywali cefadroksyl w leczeniu zakażeń dróg moczowych w trzech badaniach klinicznych, 28% było w wieku 60 lat i starszych, a 16% było w wieku 70 lat i starszych. Spośród około 1000 pacjentów, którzy otrzymywali cefadroksyl w leczeniu zakażeń skóry i struktury skóry w 14 badaniach klinicznych, 12% miało 60 lat i więcej, a 4% miało 70 lat i więcej. W tych badaniach nie zaobserwowano ogólnych różnic w bezpieczeństwie stosowania leku pomiędzy pacjentami w podeszłym wieku a młodszymi. Badania kliniczne cefadroksylu w leczeniu zapalenia gardła lub zapalenia migdałków nie obejmowały wystarczającej liczby pacjentów w wieku 65 lat i starszych, aby określić, czy reagują oni inaczej niż pacjenci młodsi. Inne doniesienia kliniczne dotyczące stosowania cefadroksylu nie wykazały różnic w odpowiedziach pomiędzy pacjentami w podeszłym wieku i młodszymi, ale nie można wykluczyć większej wrażliwości u niektórych osób w starszym wieku.
Cefadroksyl jest w znacznym stopniu wydalany przez nerki i wskazane jest dostosowanie dawkowania u pacjentów z zaburzeniami czynności nerek (patrz dawkowanie i sposób podawania: zaburzenie czynności nerek). Ponieważ u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo pogorszenia czynności nerek, należy zachować ostrożność podczas doboru dawki i może być przydatne monitorowanie czynności nerek.
działania niepożądane
żołądkowo-jelitowe
objawy rzekomobłoniastego zapalenia jelita grubego mogą wystąpić podczas lub po leczeniu antybiotykiem (patrz Ostrzeżenia). Rzadko zgłaszano niestrawność, nudności i wymioty. Wystąpiła również biegunka.
nadwrażliwość
obserwowano alergie (w postaci wysypki, pokrzywki, obrzęku naczynioruchowego i świądu). Reakcje te zwykle ustępowały po odstawieniu leku. Donoszono również o anafilaksji.
Inne
inne reakcje obejmowały zaburzenia czynności wątroby, w tym cholestazę i zwiększenie aktywności aminotransferaz w surowicy krwi, świąd narządów płciowych, moniliozę narządów płciowych, zapalenie pochwy, umiarkowaną przejściową neutropenię, gorączkę. Rzadko zgłaszano agranulocytozę, małopłytkowość, idiosynkratyczną niewydolność wątroby, rumień wielopostaciowy, Zespół Stevensa-Johnsona, chorobę posurowiczą i bóle stawów.
oprócz działań niepożądanych wymienionych powyżej, które obserwowano u pacjentów leczonych cefadroksylem, zgłaszano następujące działania niepożądane i zmienione wyniki badań laboratoryjnych dla antybiotyków z grupy cefalosporyn:
toksyczna nekroliza naskórka, ból brzucha, nadkażenie, zaburzenia czynności nerek, toksyczna nefropatia, niedokrwistość aplastyczna, niedokrwistość hemolityczna, krwotok, wydłużony czas protrombinowy, dodatni wynik testu Coombsa, zwiększenie aktywności BUN, zwiększenie stężenia kreatyniny, zwiększenie aktywności fosfatazy zasadowej, zwiększenie aktywności aminotransferazy asparaginianowej (AspAT), zwiększenie aktywności aminotransferazy alaninowej (alat), zwiększenie stężenia bilirubiny, zwiększenie aktywności LDH, eozynofilia, pancytopenia, neutropenia.
kilka cefalosporyn było zaangażowanych w wywoływanie napadów padaczkowych, szczególnie u pacjentów z zaburzeniami czynności nerek, gdy dawka nie była zmniejszona (patrz dawkowanie i podawanie oraz przedawkowanie). Jeśli wystąpią napady związane z terapią lekową, lek należy przerwać. Leczenie przeciwdrgawkowe można zastosować, jeśli jest to klinicznie wskazane.
przedawkowanie
badanie z udziałem dzieci w wieku poniżej 6 lat wykazało, że spożycie cefalosporyn w dawce mniejszej niż 250 mg/kg mc.nie wiąże się z istotnymi wynikami. Nie jest wymagane żadne działanie poza ogólnym wsparciem i obserwacją. W przypadku ilości większych niż 250 mg/kg należy wywołać opróżnianie żołądka.
u pięciu pacjentów bezmoczowych wykazano, że średnio 63% dawki doustnej 1 g jest pobierane z organizmu podczas 6-8 godzinnej hemodializy.
Duricef Dawkowanie i sposób podawania
Duricef jest stabilny kwasowo i może być podawany doustnie bez względu na posiłki. Podawanie z pokarmem może być pomocne w zmniejszaniu potencjalnych dolegliwości żołądkowo-jelitowych sporadycznie związanych z doustnym leczeniem cefalosporyną.
Dorośli
zakażenia układu moczowego: W przypadku niepowikłanych zakażeń dolnych dróg moczowych (tj. zapalenia pęcherza moczowego) zwykle stosowana dawka wynosi 1 lub 2 g na dobę w pojedynczej (QD) lub podzielonej dawce (b. i. d.).
w przypadku wszystkich innych zakażeń dróg moczowych zazwyczaj stosowana dawka wynosi 2 g na dobę w dawkach podzielonych (2 razy na dobę).
infekcje skóry i struktury skóry: w przypadku infekcji skóry i struktury skóry zwykle dawka wynosi 1 g na dobę w dawkach pojedynczych (q.d.) lub podzielonych (b.i.d.).
zapalenie gardła i migdałków: leczenie paciorkowcowego zapalenia gardła i migdałków grupy a beta-hemolityczne-1 g dziennie w pojedynczych (q.d.) lub podzielonych dawkach (b.i.d.) przez 10 dni.
dzieci
w przypadku zakażeń dróg moczowych zalecana dawka dobowa dla dzieci wynosi 30 mg/kg mc./dobę w dawkach podzielonych co 12 godzin. W przypadku zapalenia gardła, zapalenia migdałków i liszajca zalecana dzienna dawka dla dzieci wynosi 30 mg/kg mc./dobę w pojedynczej dawce lub w równych dawkach podzielonych co 12 godzin. W przypadku innych zakażeń skóry i struktury skóry zalecana dawka dobowa wynosi 30 mg/kg mc. / dobę w równych dawkach podzielonych co 12 godzin. W leczeniu zakażeń paciorkowcami beta-hemolitycznymi należy podawać terapeutyczną dawkę Duricef przez co najmniej 10 dni.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 tsp |
zaburzenia czynności
u pacjentów z zaburzeniami czynności nerek należy dostosować dawkę cefadroksylu jednowodnego w zależności od klirensu kreatyniny, aby zapobiec kumulacji leku. Proponowany jest następujący harmonogram. U dorosłych dawka początkowa wynosi 1000 mg produktu Duricef, a dawka podtrzymująca (na podstawie klirensu kreatyniny) wynosi 500 mg w podanych poniżej odstępach czasu.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients z klirensem kreatyniny powyżej 50 mL / min mogą być traktowane tak, jakby byli pacjenci z prawidłową czynnością nerek.
| Rozmiar butelki | Wskazówki dotyczące rekonstytucji |
| 100 ml |
zawiesić w sumie 67 ml wody. metoda: dotknij lekko butelki, aby poluzować proszek. dodać 67 mL wody w dwóch porcjach. dobrze wstrząsnąć po każdym dodaniu. |
| 75 mL |
zawiesić w sumie 51 mL wody. metoda: dotknij lekko butelki, aby poluzować proszek. dodać 51 mL wody w dwóch porcjach. dobrze wstrząsnąć po każdym dodaniu. |
| 50 mL |
zawiesić w sumie 34 mL wody. metoda: dotknij lekko butelki, aby poluzować proszek. dodać 34 mL wody w dwóch porcjach. dobrze wstrząsnąć po każdym dodaniu. |
|
Po rozpuszczeniu przechowywać w lodówce. Dobrze wstrząsnąć przed użyciem. Przechowywać pojemnik szczelnie zamknięty. Niewykorzystaną porcję należy wyrzucić po 14 dniach. |
|
jak jest dostarczany Duricef
Duricef® (Cefadroxil monohydrate, USP) kapsułki 500 mg: nieprzezroczyste, bordowe i białe twarde Kapsułki żelatynowe, z nadrukiem „PPP” i „784” na jednym końcu i z „duricef” i „500 mg” na drugim końcu.
kapsułki są dostarczane w następujący sposób:
n 0430-0780-19 butelka po 50
Przechowywać w kontrolowanej temperaturze pokojowej 15°-30° C (59°-86° F).
Duricef® 1 gram tabletki: białe lub prawie białe, podzielone na części górne, owalne, z nadrukiem „PPP” po jednej stronie przedziału i „785” po drugiej stronie przedziału. Tabletki są dostarczane w następujący sposób:
n 0430-0781-19 butelka po 50
Przechowywać w kontrolowanej temperaturze pokojowej 15°-30° C (59°-86° F).
Duricef® do sporządzania zawiesiny doustnej ma smak pomarańczowo-ananasowy i jest dostarczany w następujący sposób:
250 mg/5 mL N 0430-2782-15 butelka 50 mL
N 0430-2782-17 Butelka 100 mL
500 mg/5 mL N 0430-2783-16 butelka 75 mL
N 0430-2783-17 Butelka 100 mL
przed rekonstytucją: Przechowywać w temperaturze kontrolowanej.temperatura pokojowa 15°-30° C (59°-86° f).
1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk sensibility Test, 4th Edition, Vol. 10( 7): M2-A4, Villanova, PA, kwiecień, 1990.
2. National Committee for Clinical Laboratory Standards, Approved Standard: Metody rozcieńczania badań wrażliwości na drobnoustroje bakterii, które rosną Aerobicznie, wydanie II, T.II 10( 8): M7-A2, Villanova, PA, kwiecień, 1990.
wyprodukowany przez Bristol-Myers Squibb Co.
Princeton, NJ 08543
dla Warner Chilcott Company, Inc.
Fajardo, PR 00738
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: cefalosporyny pierwszej generacji
zasoby konsumenckie
- zaawansowane Czytanie
zasoby profesjonalne
- informacje o przepisywaniu
- Cefadroksyl zawiesina doustna (FDA)
powiązane Przewodniki leczenia
- zapobieganie bakteryjnemu zapaleniu wsierdzia
- infekcja skóry i struktury
- liszajec
- infekcje nerek
- … + 4 więcej
oświadczenie lekarskie
Leave a Reply