Duricef
一般名:セファドロキシル剤形:懸濁液のための粉末
医学的にレビューされたDrugs.com最終更新日は2020年4月21日です。
- 概要
- 副作用
- 投与量
- プロフェッショナル
- 相互作用
- More
薬剤耐性菌の発生を減らし、Duricef®および他の抗菌薬の有効性を維持するために、Duricefは、細菌によ
デュリセフ説明
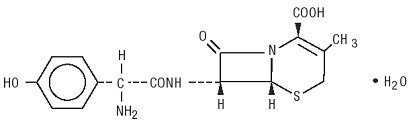
デュリセフは、経口投与を意図した半合成セファロスポリン抗生物質です。 それは黄色がかった白の結晶の粉へ白です。 それは水で溶け、酸安定しています。 それは化学的に5-Thia-1-azabicyclooct-2-ene-2-カルボン酸、7-アミノ]-3-メチル-8-オキソ-、一水和物]-として指定されています。 それは式C16H17N3O5S•H2Oと381.40の分子量を持っています。 それは次の構造式を持っています:
ジュリセフフィルムコーティング錠、1gは、以下の不活性成分を含んでいます:微結晶セルロース、ハイ
経口懸濁液用デュリセフには、以下の不活性成分が含まれています:FD&C Yellow No.6、香料(天然および人工)、ポリソルベート80、安息香酸ナトリ
デュリセフカプセルには、以下の不活性成分が含まれています:D&C Red No.28、FD&C Blue No.1、FD&C Red No.40、ゼラチン、ステアリン酸マグネシウム、二酸化チタン。
デュリセフ-臨床薬理学
デュリセフは経口投与後に急速に吸収される。 500mgおよび1000mgの単回投与後、平均ピーク血清濃度はそれぞれ約16および28μ g/mLであった。 測定可能なレベルは、投与12時間後に存在した。 薬物の90%以上が24時間以内に尿中に変化せずに排泄される。 ピーク尿濃度は、単一の500mgの経口用量に続く期間中、約1800μ g/mLである。 適量の増加は一般にDuricef(cefadroxilの一水和物、USP)の尿の集中の比例した増加を作り出します。 尿抗生物質濃度は、1gの用量に続いて、20-22時間感受性尿病原体のMICをはるかに上回って維持された。
微生物学
in vitro試験では、セファロスポリンは細胞壁合成の阻害のために殺菌性であることが示されています。
微生物学
In vitro試験では、セファロスポリンは Cefadroxilは生体外でそして臨床伝染の次の有機体に対して活動的であるために示されていました(徴候および使用法を見て下さい):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Pseudomonas種およびAcinetobactercalcoaceticus(以前のMimaおよびHerellea種)に対しては活性を有さない。
感受性試験:拡散技術
ゾーン直径を測定する抗生物質ディスク感受性試験方法の使用は、抗生物質感受性の正確な推定を与える。 セファドロキシルに対する生物の感受性を試験するためのディスクとの使用が推奨されているそのような標準的な手順1の1つは、セファロスポリンクラス(セファロチン)ディスクを使用する。 解釈はcefadroxilのための最低の抑制的な集中(MIC)とディスクテストで得られた直径の相関関係を含みます。
30μ gのセファロチンディスクを用いた標準的な単一ディスク感受性試験の結果を与える実験室からの報告は、以下の基準に従って解釈されるべ:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of 「感受性」は、病原体が、一般的に達成可能な血中レベルによって阻害される可能性があることを示す。 「中間感受性」の報告は、高用量が使用される場合、または感染が高い抗生物質レベルが達成される組織および体液(例えば、尿)に限定される場合、生物は感受性 「耐性」の報告は、達成可能な濃度の抗生物質が抑制性である可能性が低く、他の治療法を選択すべきであることを示している。
標準化された手順は、実験室の制御生物の使用を必要とします。 30μ gのセファロチンディスクは、以下のゾーン直径を与える必要があります:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (マイクロ希釈を含む)method2または同等のものであれば、セファロチンのMIC(最小阻害濃度)値が8μ g/mL以下であれば、細菌単離物は感受性であると考えられる。 MICが32μ g/mL以上の場合、生物は耐性があるとみなされます。 MIC値が32μ g/mL未満であるが8μ g/mLを超える生物は中間体である。
標準的な拡散方法と同様に、希釈手順は実験室対照生物の使用を必要とする。 標準的なセファロチン粉末は、黄色ブドウ球菌ATCC29213に対して0.12μ g/mLおよび0.5μ g/mLの範囲のMIC値を与えるべきである。 大腸菌ATCC25922では、MIC範囲は4.0μ g/mL16.0μ g/mLの間である必要があります。 Streptococcus faecalis ATCC29212の場合、MICの範囲は8.0 32.0μ g/mLの間でなければなりません。
Duricefの適応症と使用法
Duricefは、以下の疾患における指定された生物の感受性株によって引き起こされる感染症患者の治療のために示されています。
大腸菌、p.mirabilis、およびKlebsiella種によって引き起こされる尿路感染症。ブドウ球菌および/または連鎖球菌によって引き起こされる皮膚および皮膚構造感染症。
皮膚および皮膚構造感染症は、ブドウ球菌および/または連鎖球菌によって引き起こされる。
化膿レンサ球菌(A群β溶血性連鎖球菌)によって引き起こされる咽頭炎および/または扁桃炎。
注:筋肉内投与経路によるペニシリンのみがリウマチ熱の予防に有効であることが示されている。 デュリセフは、口腔咽頭からの連鎖球菌の根絶に一般的に有効である。 しかし、その後のリウマチ熱の予防のためのデュリセフの有効性を確立するデータは入手できない。
注:培養および感受性試験は、治療前および治療中に開始する必要があります。
注:培養および感受性試験は、治療前および治療 腎機能研究は示されたときに行われるべきである。
薬剤耐性菌の発生を減らし、Duricefおよび他の抗菌薬の有効性を維持するために、duricefは、感受性細菌によって引き起こされることが証明されているか、 文化および感受性情報が利用できるとき、抗菌性療法を選ぶか、または変更することで考慮されるべきです。 このようなデータがない場合、局所疫学および感受性パターンは、治療の経験的選択に寄与する可能性がある。
禁忌
デュリセフは、抗生物質のセファロスポリン群に対する既知のアレルギーを有する患者には禁忌である。
警告
デュリセフによる治療が開始される前に、患者がセファドロキシル、セファロスポリン、ペニシリン、または他の薬物に対する以前の過敏 このプロダクトがペニシリンに敏感な患者に与えられるべきならベータラクタムの抗生物質間の交差感受性がはっきり文書化され、ペニシリンのア
デュリセフに対するアレルギー反応が発生した場合は、薬物を中止してください。 重篤な急性過敏反応は、臨床的に示されるように、エピネフリンおよび酸素、静脈内液、静脈内抗ヒスタミン薬、コルチコステロイド、昇圧アミン、および気道管理を含む他の緊急措置による治療を必要とすることがある。
Clostridium difficile associated下痢(CDAD)は、デュリセフを含むほぼすべての抗菌剤の使用で報告されており、軽度の下痢から致命的な大腸炎までの重症度の範囲であり得る。 抗菌剤による治療は、c.difficileの過増殖につながる結腸の正常な細菌叢を変化させる。
C.difficileは、cdadの開発に寄与する毒素AおよびBを産生する。 これらの伝染が抗菌療法に不応性である場合もあり、colectomyを要求するかもしれないのでc.difficile原因の高められた罹患率および死亡率のhypertoxinの生産の緊張。 CDADは抗生の使用の後で下痢と示すすべての患者で考慮されなければなりません。 CDADは抗菌剤の投与後二ヶ月にわたって発生することが報告されているので、注意深い病歴が必要である。
CDADが疑われるか確認された場合、C.difficileに対して指示されていない継続的な抗生物質の使用を中止する必要があるかもしれません。 C.difficileの適切な液体および電解物管理、蛋白質の補足、抗生の処置、および外科評価は臨床的に示されるように提起されるべきです。
注意事項
一般
デュリセフは、著しく障害された腎機能(クレアチニンクリアランス率が50mL/分/1.73M2未満)の存在下では注意して使用す (適量および管理を見て下さい。)腎機能障害が知られているか疑われる患者では、治療前および治療中に慎重な臨床観察および適切な実験室研究を行うべきである。
証明された、または強く疑われる細菌感染または予防的適応症がない場合にDuricefを処方することは、患者に利益をもたらす可能性は低く、薬剤耐性
デュリセフの長期使用は、非感受性生物の過増殖をもたらす可能性がある。 患者の注意深い観察は必要である。 治療中に重感染が発生した場合は、適切な措置を講じる必要があります。
デュリセフは、胃腸疾患、特に大腸炎の病歴を有する個人には注意して処方されるべきである。
患者のための情報
患者は、デュリセフを含む抗菌薬は細菌感染症の治療にのみ使用すべきであると助言されるべきである。 彼らはウイルス感染(例えば、一般的な風邪)を治療しません。 Duricefが細菌感染症を治療するために処方されている場合、治療の過程で早期に気分が良くなるのは一般的ですが、指示どおりに投薬を受けるべきであると患者に伝えなければなりません。 用量をスキップしたり、治療の全過程を完了しないことは、(1)即時治療の有効性を低下させ、(2)細菌が耐性を発症し、将来デュリセフまたは他の抗菌薬によ下痢は、抗生物質が中止されたときに通常終了する抗生物質によって引き起こされる一般的な問題です。
下痢は、抗生物質が中止されたときに 時には、抗生物質による治療を開始した後、患者は、抗生物質の最後の用量を服用した後、二ヶ月以上遅くても、水っぽい血便(胃のけいれんおよび発熱の有無にかかわらず)を発症することがある。 これが発生した場合、患者はできるだけ早く医師に連絡する必要があります。
薬物/実験室試験の相互作用
セファロスポリン抗生物質による治療中に陽性の直接クームスの試験が報告されている。 分娩前にセファロスポリン抗生物質を母親に投与した新生児の抗グロブリン検査またはクームス検査を行う血液学的研究または輸血クロスマッチングプロシージャでは、クームス検査が陽性であることが認識されるべきである。
発癌、突然変異誘発および生殖能力の障害
発癌性の可能性を決定するための長期的な研究は行われていない。 遺伝的毒性試験は実施されていない。
妊娠中の妊娠
妊娠: 妊娠カテゴリB
生殖研究は、ヒトの用量の11倍までの用量でマウスおよびラットで行われており、セファドロキシル一水和物による胎児への受 しかし、妊娠中の女性には適切で十分に制御された研究はありません。 動物の生殖研究は必ずしも人間の反応を予測するものではないため、この薬は明らかに必要な場合にのみ妊娠中に使用する必要があります。
労働と配達
Duricefは、労働と配達の間に使用するために研究されていません。 処置ははっきり必要とされたらだけ与えられるべきです。授乳中の母親にセファドロキシル一水和物を投与する場合は注意が必要です。
授乳中の母親
授乳中の母親にセファドロキシル一水和物を投与する場合は注意が必要です。
小児用
(投与量および投与量を参照してください。)
老人使用
尿路感染症の治療のためにセファドロキシルを受けた約650人の患者のうち、28%が60歳以上であり、16%が70歳以上であった。 皮膚および皮膚構造感染の治療のためにセファドロキシルを受けた約1000人の患者のうち、14の臨床試験では、12%が60歳以上であり、4%が70歳以上であった。 これらの研究では、高齢患者と若年患者の間に安全性の全体的な違いは観察されなかった。 咽頭炎または扁桃炎の治療のためのセファドロキシルの臨床研究には、65歳以上の患者が若い患者とは異なる反応を示すかどうかを判断するのに十 Cefadroxilの他の報告された臨床経験は年配者およびより若い患者間の応答の相違を識別しませんでしたが、何人かのより古い個人のより大きい感受性は
セファドロキシルは腎臓によって実質的に排泄され、腎障害を有する患者には投与量の調整が適応される(投与量および投与:腎障害を参照)。 高齢の患者は腎機能が低下する可能性が高いため、用量選択に注意を払う必要があり、腎機能をモニターすることは有用であり得る。
有害反応
胃腸
偽膜性大腸炎の症状の発症は、抗生物質治療中または抗生物質治療後に起こることがあります(警告を参照)。 消化不良、悪心および嘔吐はまれに報告されていません。 下痢も発生しています。
過敏症
アレルギー(発疹、蕁麻疹、血管浮腫、掻痒の形)が観察されている。 これらの反応は、通常、薬物の中止時に沈静化した。 アナフィラキシーも報告されている。
その他
その他の反応には、胆汁うっ滞および血清トランスアミナーゼの上昇を含む肝機能障害、生殖器そう痒症、生殖器moniliasis、膣炎、中等度の一過性好中球減少症、発熱が含まれている。 無顆粒球症,血小板減少症,特異性肝不全,多形性紅斑,Stevens-Johnson症候群,血清病,関節痛はほとんど報告されていない。
セファドロキシルで治療された患者で観察された上記の有害反応に加えて、セファロスポリンクラスの抗生物質については、以下の有害反応およ:
毒性表皮壊死症、腹痛、重感染、腎機能障害、毒性腎症、再生不良性貧血、溶血性貧血、出血、プロトロンビン時間の延長、陽性クームス試験、BUNの増加、クレアチニンの増加、アルカリホスファターゼの上昇、アスパラギン酸アミノトランスフェラーゼ(AST)の上昇、アラニンアミノトランスフェラーゼ(ALT)の上昇、ビリルビンの上昇、LDHの上昇、好酸球減少症、汎血球減少症、好中球減少症。
いくつかのセファロスポリンは、投与量が減少しなかった場合、特に腎障害を有する患者において、発作を誘発することに関与している(投与量およ 薬物療法に関連する発作が発生した場合は、薬物を中止する必要があります。 抗けいれん療法は臨床的に示されれば与えることができます。
過剰投与
6歳未満の小児を対象とした研究では、250mg/kg未満のセファロスポリンの摂取は有意な結果と関連していないことが示唆された。 一般的なサポートと観察以外の行動は必要ありません。 250mg/kgより大きい量のために、胃の空けることを引き起こして下さい。
5人のanuric患者では、63時間の血液透析セッション中に1gの経口用量の平均63%が体内から抽出されることが実証された。
デュリセフ投与量および投与
デュリセフは酸安定であり、食事に関係なく経口投与することができる。 食物との投与は、時折経口セファロスポリン療法に関連する潜在的な胃腸愁訴を減少させるのに有用であり得る。H3>
尿路感染症
尿路感染症
尿路感染症: 合併症のない下部尿路感染症(すなわち、膀胱炎)の場合、通常の投与量は、単一(q.d.)または分割用量(b.i.d.)で1日あたり1または2gである。
他のすべての尿路感染症については、通常の投与量は、分割用量(b.i.d.)で一日あたり2gである。皮膚および皮膚構造感染症:皮膚および皮膚構造感染症の場合、通常の投与量は、単回(q.d.)または分割用量(b.i.d.)で1日あたり1gである。
皮膚および皮膚構造感染症の場合、通常の投与量は、単回(q.d.)または分割用量(b.i.d.)である。
咽頭炎および扁桃炎:a群β溶血性連鎖球菌咽頭炎および扁桃炎の治療-1日あたり1gを単回(q.d.)または分割用量(b.i.d.)で10日間治療する。尿路感染症のために、子供のための推奨される毎日の投与量は、12時間ごとに分割用量で30mg/kg/日である。 咽頭炎、扁桃炎、および膿痂疹の場合、小児の推奨される毎日の投与量は、単回投与または12時間ごとに均等に分割された用量で30mg/kg/日である。 他の皮膚および皮膚構造感染症の場合、推奨される毎日の投与量は、12時間ごとに均等に分割された用量で30mg/kg/日である。 Β溶血性連鎖球菌感染症の治療において、デュリセフの治療用量は少なくとも10日間投与されるべきである。
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2tsp |
腎障害
腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する患者では、腎障害を有する減損はクレアチニンの整理率に従って薬剤の蓄積を防ぐために、cefadroxilの一水和物の適量調節されるべきです。 以下のスケジュールが提案されています。 成人では、初期用量は1000mgのDuricefであり、維持用量(クレアチニンクリアランス率に基づく)は以下の時間間隔で500mgである。
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients クレアチニンクリアランス率が50mL/分を超える場合は、正常な腎機能を有する患者であるかのように治療することができる。/div>
| ボトルサイズ | 再構成方向 |
| 100ミリリットル |
合計67ミリリットルの水に懸濁します。方法:粉末を緩めるために軽くボトルをタップします。 方法:粉末を緩めるために軽くボトルをタップ 67mLの水を二つの部分に加えます。 各添加後によく振る。 |
| 75mL |
合計51mLの水に懸濁します。方法:粉末を緩めるために軽くボトルをタップします。 方法:粉末を緩めるために軽くボトルをタップ 2つの部分に51mLの水を加えます。 各添加後によく振る。 |
| 50ミリリットル |
合計34ミリリットルの水に懸濁します。方法:粉末を緩めるために軽くボトルをタップします。 方法:粉末を緩めるために軽くボトルをタップ 34mLの水を二つの部分に加えます。 各添加後によく振る。 |
|
再構成後、冷蔵庫に保管してください。 使用する前によく振ってください。 容器をしっかりと閉じたままにしてください。 14日後に未使用部分を破棄します。 |
|
Duricefの供給方法
Duricef®(cefadroxil monohydrate,USP)500mgカプセル:不透明な、栗色と白の硬質ゼラチンカプセル、一端に”PPP”と”784″が刻印され、”PPP”と”784″が刻印されている。もう一方の端には「500mg」と「Duricef」があります。
カプセルは次のように供給されます:
N0430-0780-19 50のボトル
制御された室温15°-30°C(59°-86°F)で保管してください。
Duricef®1グラム錠剤:白からオフホワイト、二等分線、楕円形、二等分線の片側に”PPP”、二等分線の反対側に”785″が刻印されています。 錠剤は以下のように供給される:
N0430-0781-19 50のボトル
制御された室温15°-30°C(59°-86°F)で保管する。
経口懸濁液用Duricef®は、オレンジパイナップル風味で、以下のように供給されます:
250mg/5mL N0430-2782-15 50mLボトル
N0430-2782-17 100mLボトル
500mg/5mL N0430-2783-16 75mLボトル
n0430-2783-17 100mLボトル
再構成の前に:管理された室温15°-30°c(59°-86°f)。
1. National Committee for Clinical Laboratory Standards,Approved Standard,Performance Standards for Antimicrobial Disk Sessibility Test,第4版,Vol. 10(7):M2-A4,Villanova,PA,April,1990.
2. 臨床検査の標準のための国民委員会、承認された標準: 方法希釈抗菌感受性試験のための細菌の生育するAerobically第2版,Vol. 10(8):M7-A2,Villanova,PA,April,1990.Bristol-Myers Squibb Co.によって製造されています。
プリンストン、ニュージャージー州08543
ワーナー-チルコット-カンパニー、株式会社のために。
Fajardo,PR00738
ワーナー-チルコット社によって販売されています。
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: 第一世代セファロスポリン
消費者資源
- 高度な読み取り
プロフェッショナルリソース
- 処方情報
- セファドロキシル経口懸濁液(FDA)
関連治療ガイド
- 細菌性心内膜炎予防
- 皮膚および構造感染
- 膿痂疹
- 腎臓感染症
- 。..
医療に関する免責事項
Leave a Reply