Duricef
Generischer Name: Cefadroxil
Darreichungsform: Pulver, zur Suspension
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am April 21, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Wechselwirkungen
- Mehr
Um die Entwicklung arzneimittelresistenter Bakterien zu reduzieren und die Wirksamkeit von Duricef® und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte Duricef nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, bei denen nachgewiesen wurde oder bei denen der starke Verdacht besteht, dass sie durch Bakterien verursacht werden.
Duricef Beschreibung
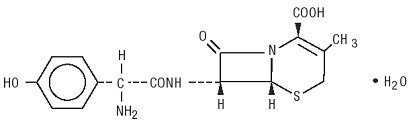
Duricef ist ein halbsynthetisches Cephalosporin-Antibiotikum zur oralen Verabreichung. Es ist ein weißes bis gelblich-weißes kristallines Pulver. Es ist wasserlöslich und säurestabil. Es wird chemisch als 5-Thia-1-azabicyclooct-2-en-2-carbonsäure, 7-amino] -3-methyl-8-oxo-, Monohydrat] – bezeichnet. Es hat die Formel C16H17N3O5S • H2O und das Molekulargewicht von 381,40. Es hat die folgende Strukturformel:
Duricef Filmtabletten, 1 g, enthalten die folgenden inaktiven Bestandteile: mikrokristalline Cellulose, Hydroxypropylmethylcellulose, Magnesiumstearat, Polyethylenglykol, Polysorbat 80, Simethiconemulsion und Titandioxid.
Duricef zur Herstellung einer Suspension zum Einnehmen enthält die folgenden inaktiven Bestandteile: FD&C Yellow No. 6, Aromen (natürlich und künstlich), Polysorbat 80, Natriumbenzoat, Saccharose und Xanthangummi.
Duricef-Kapseln enthalten die folgenden inaktiven Bestandteile: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, Gelatine, Magnesiumstearat und Titandioxid.
Duricef – Klinische Pharmakologie
Duricef wird nach oraler Verabreichung schnell resorbiert. Nach Einzeldosen von 500 mg und 1000 mg betrugen die durchschnittlichen maximalen Serumkonzentrationen etwa 16 bzw. 28 µg/ml. Messbare Konzentrationen waren 12 Stunden nach der Verabreichung vorhanden. Über 90% des Arzneimittels werden innerhalb von 24 Stunden unverändert im Urin ausgeschieden. Die maximalen Urinkonzentrationen liegen im Zeitraum nach einer oralen Einzeldosis von 500 mg bei etwa 1800 µg / ml. Dosiserhöhungen führen im Allgemeinen zu einem proportionalen Anstieg der Duricef-Konzentration (Cefadroxil-Monohydrat, USP) im Urin. Die Antibiotikakonzentration im Urin wurde nach einer Dosis von 1 g 20 bis 22 Stunden lang deutlich über der MHK empfindlicher Harn-Pathogene gehalten.
Mikrobiologie
In-vitro-Tests zeigen, dass die Cephalosporine aufgrund ihrer Hemmung der Zellwandsynthese bakterizid sind. Es wurde gezeigt, dass Cefadroxil sowohl in vitro als auch bei klinischen Infektionen gegen die folgenden Organismen wirksam ist (siehe INDIKATIONEN UND ANWENDUNG):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Es hat keine Aktivität gegen Pseudomonas-Arten und Acinetobacter calcoaceticus (früher Mima- und Herellea-Arten).
Suszeptibilitätstests: Diffusionstechniken
Die Verwendung von Antibiotika-Disk-Suszeptibilitätstestmethoden, die den Zonendurchmesser messen, gibt eine genaue Schätzung der Antibiotika-Suszeptibilität. Ein solches Standardverfahren1, das für die Verwendung mit Scheiben empfohlen wurde, um die Empfindlichkeit von Organismen gegenüber Cefadroxil zu testen, verwendet die Scheibe der Cephalosporin-Klasse (Cephalothin). Die Interpretation beinhaltet die Korrelation der im Scheibentest erhaltenen Durchmesser mit der minimalen Hemmkonzentration (MHK) für Cefadroxil.
Berichte aus dem Labor, die Ergebnisse des Standard-Single-Disk-Suszeptibilitätstests mit einer 30 µg Cephalothin-Scheibe enthalten, sollten nach folgenden Kriterien interpretiert werden:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of „Anfällig“ bedeutet, dass der Erreger wahrscheinlich durch allgemein erreichbare Blutspiegel gehemmt wird. Ein Bericht über „intermediäre Empfindlichkeit“ legt nahe, dass der Organismus anfällig wäre, wenn eine hohe Dosierung verwendet wird oder wenn die Infektion auf Gewebe und Flüssigkeiten (z. B. Urin) beschränkt ist, in denen hohe Antibiotikaspiegel erreicht werden. Ein Bericht über „Resistent“ zeigt an, dass erreichbare Konzentrationen des Antibiotikums wahrscheinlich nicht hemmend sind und eine andere Therapie ausgewählt werden sollte.
Standardisierte Verfahren erfordern den Einsatz von Laborkontrollorganismen. Die 30 µg Cephalothinscheibe sollte folgende Zonendurchmesser ergeben:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (einschließlich Mikrodilution) Methode2 oder gleichwertig, ein bakterielles Isolat kann als anfällig angesehen werden, wenn der MHK-Wert (minimale Hemmkonzentration) für Cephalothin 8 µg / ml oder weniger beträgt. Organismen gelten als resistent, wenn die MHK 32 µg/ml oder mehr beträgt. Organismen mit einem MHK-Wert von weniger als 32 µg / ml, aber mehr als 8 µg / ml sind intermediär.
Wie bei Standarddiffusionsmethoden erfordern Verdünnungsverfahren die Verwendung von Laborkontrollorganismen. Standard-Cephalothinpulver sollte MHK-Werte im Bereich von 0,12 µg / ml und 0,5 µg / ml für Staphylococcus aureus ATCC 29213 ergeben. Für Escherichia coli ATCC 25922 sollte der MHK-Bereich zwischen 4,0 µg /ml und 16,0 µg/ml liegen. Für Streptococcus faecalis ATCC 29212 sollte der MHK-Bereich zwischen 8,0 und 32,0 µg/ml liegen.
Indikationen und Anwendung von Duricef
Duricef ist indiziert zur Behandlung von Patienten mit Infektionen, die durch anfällige Stämme der bezeichneten Organismen bei folgenden Krankheiten verursacht werden:
Harnwegsinfektionen durch E. coli, P. mirabilis und Klebsiella-Arten.
Haut- und Hautstrukturinfektionen durch Staphylokokken und/oder Streptokokken.
Pharyngitis und/oder Tonsillitis durch Streptococcus pyogenes (beta-hämolytische Streptokokken der Gruppe A).
Hinweis: Nur Penicillin auf intramuskulärem Verabreichungsweg hat sich bei der Prophylaxe von rheumatischem Fieber als wirksam erwiesen. Duricef ist im Allgemeinen wirksam bei der Ausrottung von Streptokokken aus dem Oropharynx. Es liegen jedoch keine Daten zur Wirksamkeit von Duricef zur Prophylaxe des nachfolgenden rheumatischen Fiebers vor.
Hinweis: Kultur- und Empfindlichkeitstests sollten vor und während der Therapie eingeleitet werden. Nierenfunktionsstudien sollten durchgeführt werden, wenn dies angezeigt ist.
Um die Entwicklung arzneimittelresistenter Bakterien zu verringern und die Wirksamkeit von Duricef und anderen antibakteriellen Arzneimitteln aufrechtzuerhalten, sollte Duricef nur zur Behandlung oder Vorbeugung von Infektionen angewendet werden, bei denen nachweislich oder stark vermutet wird, dass sie durch empfindliche Bakterien verursacht werden. Wenn Kultur- und Empfindlichkeitsinformationen verfügbar sind, sollten sie bei der Auswahl oder Änderung der antibakteriellen Therapie berücksichtigt werden. In Ermangelung solcher Daten können lokale Epidemiologie und Suszeptibilitätsmuster zur empirischen Auswahl der Therapie beitragen.
Kontraindikationen
Duricef ist bei Patienten mit bekannter Allergie gegen die Cephalosporin-Gruppe von Antibiotika kontraindiziert.
Warnhinweise
VOR BEGINN DER THERAPIE MIT Duricef SOLLTE SORGFÄLTIG UNTERSUCHT WERDEN, OB DER PATIENT ZUVOR ÜBEREMPFINDLICHKEITSREAKTIONEN GEGEN CEFADROXIL, CEPHALOSPORINE, PENICILLINE ODER ANDERE ARZNEIMITTEL HATTE. WENN DIESES ARZNEIMITTEL PENICILLIN-EMPFINDLICHEN PATIENTEN VERABREICHT WERDEN SOLL, IST VORSICHT GEBOTEN, DA EINE KREUZSENSITIVITÄT ZWISCHEN BETA-LACTAM-ANTIBIOTIKA EINDEUTIG DOKUMENTIERT IST UND BEI BIS ZU 10% DER PATIENTEN MIT PENICILLIN-ALLERGIE IN DER VORGESCHICHTE AUFTRETEN KANN.
WENN EINE ALLERGISCHE REAKTION AUF Duricef AUFTRITT, BRECHEN SIE DAS MEDIKAMENT AB. SCHWERWIEGENDE AKUTE ÜBEREMPFINDLICHKEITSREAKTIONEN KÖNNEN EINE BEHANDLUNG MIT ADRENALIN UND ANDEREN NOTFALLMAßNAHMEN ERFORDERN, EINSCHLIEßLICH SAUERSTOFF, INTRAVENÖSEN FLÜSSIGKEITEN, INTRAVENÖSEN ANTIHISTAMINIKA, KORTIKOSTEROIDEN, DRUCKAMINEN UND ATEMWEGSMANAGEMENT, WIE KLINISCH INDIZIERT.Clostridium difficile assoziierte Diarrhoe (CDAD) wurde bei der Verwendung von fast allen antibakteriellen Mitteln, einschließlich Duricef, berichtet und kann in der Schwere von leichter Diarrhoe bis hin zu tödlicher Kolitis reichen. Die Behandlung mit antibakteriellen Mitteln verändert die normale Flora des Dickdarms, was zu einem Überwachsen von C. difficile führt.
C. difficile produziert Toxine A und B, die zur Entwicklung von CDAD beitragen. Hypertoxin produzierende Stämme von C. difficile verursachen eine erhöhte Morbidität und Mortalität, da diese Infektionen gegen eine antimikrobielle Therapie refraktär sein können und eine Kolektomie erfordern können. CDAD muss bei allen Patienten in Betracht gezogen werden, bei denen nach der Anwendung von Antibiotika Durchfall auftritt. Eine sorgfältige Anamnese ist erforderlich, da berichtet wurde, dass CDAD mehr als zwei Monate nach der Verabreichung antibakterieller Mittel auftritt.
Wenn CDAD vermutet oder bestätigt wird, muss der laufende Antibiotikaeinsatz, der nicht gegen C. difficile gerichtet ist, möglicherweise abgebrochen werden. Ein angemessenes Flüssigkeits- und Elektrolytmanagement, eine Proteinsupplementierung, eine antibiotische Behandlung von C. difficile und eine chirurgische Untersuchung sollten nach klinischer Indikation eingeleitet werden.
Vorsichtsmaßnahmen
Allgemein
Duricef sollte bei deutlich eingeschränkter Nierenfunktion (Kreatinin-Clearance von weniger als 50 ml/ min/1,73 M2) mit Vorsicht angewendet werden. (Siehe DOSIERUNG UND VERABREICHUNG.) Bei Patienten mit bekannter oder vermuteter Nierenfunktionsstörung sollten vor und während der Therapie sorgfältige klinische Beobachtungen und geeignete Laborstudien durchgeführt werden.
Die Verschreibung von Duricef in Abwesenheit einer nachgewiesenen oder stark vermuteten bakteriellen Infektion oder einer prophylaktischen Indikation bringt dem Patienten wahrscheinlich keinen Nutzen und erhöht das Risiko der Entwicklung arzneimittelresistenter Bakterien.
Bei längerer Anwendung von Duricef kann es zu einem übermäßigen Wachstum nicht empfänglicher Organismen kommen. Eine sorgfältige Beobachtung des Patienten ist unerlässlich. Wenn während der Therapie eine Superinfektion auftritt, sollten geeignete Maßnahmen ergriffen werden.
Duricef sollte bei Personen mit gastrointestinalen Erkrankungen in der Vorgeschichte, insbesondere Colitis, mit Vorsicht verschrieben werden.
Informationen für Patienten
Patienten sollten darauf hingewiesen werden, dass antibakterielle Arzneimittel, einschließlich Duricef, nur zur Behandlung bakterieller Infektionen angewendet werden sollten. Sie behandeln keine Virusinfektionen (z. B. Erkältung). Wenn Duricef verschrieben wird, um eine bakterielle Infektion zu behandeln, sollten die Patienten darüber informiert werden, dass, obwohl es üblich ist, sich zu Beginn der Therapie besser zu fühlen, das Medikament genau wie angewiesen eingenommen werden sollte. Das Überspringen von Dosen oder das Nichterfüllen des gesamten Therapieverlaufs kann (1) die Wirksamkeit der sofortigen Behandlung verringern und (2) die Wahrscheinlichkeit erhöhen, dass Bakterien Resistenzen entwickeln und in Zukunft nicht mehr mit Duricef oder anderen antibakteriellen Arzneimitteln behandelt werden können.Durchfall ist ein häufiges Problem, das durch Antibiotika verursacht wird und normalerweise endet, wenn das Antibiotikum abgesetzt wird. Manchmal können Patienten nach Beginn der Behandlung mit Antibiotika bereits zwei oder mehr Monate nach Einnahme der letzten Dosis des Antibiotikums wässrigen und blutigen Stuhl (mit oder ohne Magenkrämpfe und Fieber) entwickeln. In diesem Fall sollten Patienten so schnell wie möglich ihren Arzt kontaktieren.
Arzneimittel-/Labortest-Wechselwirkungen
Während der Behandlung mit den Cephalosporin-Antibiotika wurden positive direkte Coombs-Tests berichtet. In hämatologischen Studien oder in Transfusions-Cross-Matching-Verfahren, wenn Antiglobulin-Tests auf der Nebenseite durchgeführt werden, oder in Coombs-Tests von Neugeborenen, deren Mütter vor der Geburt Cephalosporin-Antibiotika erhalten haben, sollte erkannt werden, dass ein positiver Coombs-Test auf das Medikament zurückzuführen sein kann.
Karzinogenese, Mutagenese und Beeinträchtigung der Fertilität
Es wurden keine Langzeitstudien zur Bestimmung des karzinogenen Potenzials durchgeführt. Es wurden keine genetischen Toxizitätstests durchgeführt.
Schwangerschaft: Schwangerschaftskategorie B
Reproduktionsstudien wurden an Mäusen und Ratten in Dosen bis zum 11-fachen der Humandosis durchgeführt und haben keine Hinweise auf eine beeinträchtigte Fruchtbarkeit oder Schädigung des Fötus durch Cefadroxilmonohydrat ergeben. Es gibt jedoch keine ausreichenden und gut kontrollierten Studien bei schwangeren Frauen. Da Reproduktionsstudien an Tieren nicht immer die Reaktion des Menschen vorhersagen, sollte dieses Medikament während der Schwangerschaft nur angewendet werden, wenn dies eindeutig erforderlich ist.
Wehen und Entbindung
Duricef wurde nicht zur Anwendung während der Wehen und Entbindung untersucht. Die Behandlung sollte nur erfolgen, wenn dies eindeutig erforderlich ist.
Stillende Mütter
Vorsicht ist geboten, wenn Cefadroxil-Monohydrat einer stillenden Mutter verabreicht wird.
Pädiatrische Anwendung
(Siehe DOSIERUNG UND ANWENDUNG.)
Geriatrische Anwendung
Von etwa 650 Patienten, die in drei klinischen Studien Cefadroxil zur Behandlung von Harnwegsinfektionen erhielten, waren 28% 60 Jahre und älter, während 16% 70 Jahre und älter waren. Von ungefähr 1000 Patienten, die in 14 klinischen Studien Cefadroxil zur Behandlung von Haut- und Hautstrukturinfektionen erhielten, waren 12% 60 Jahre und älter, während 4% 70 Jahre und älter waren. Insgesamt wurden keine Unterschiede in der Sicherheit zwischen den älteren Patienten in diesen Studien und jüngeren Patienten beobachtet. Klinische Studien mit Cefadroxil zur Behandlung von Pharyngitis oder Tonsillitis schlossen keine ausreichende Anzahl von Patienten ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Patienten. Andere berichtete klinische Erfahrung mit cefadroxil hat Unterschiede in Antworten zwischen älteren und jüngeren Patienten nicht identifiziert, aber größere Empfindlichkeit von einigen älteren Personen kann nicht ausgeschlossen werden.
Cefadroxil wird im Wesentlichen über die Niere ausgeschieden, und bei Patienten mit eingeschränkter Nierenfunktion ist eine Dosisanpassung angezeigt (siehe DOSIERUNG UND ANWENDUNG: Nierenfunktionsstörung). Da ältere Patienten eher eine verminderte Nierenfunktion haben, sollte bei der Dosisauswahl Vorsicht walten gelassen werden, und es kann nützlich sein, die Nierenfunktion zu überwachen.
Nebenwirkungen
Gastrointestinal
Während oder nach einer Antibiotikabehandlung können Symptome einer pseudomembranösen Kolitis auftreten (siehe WARNHINWEISE). Dyspepsie, Übelkeit und Erbrechen wurden selten berichtet. Durchfall ist ebenfalls aufgetreten.
Überempfindlichkeit
Es wurden Allergien (in Form von Hautausschlag, Urtikaria, Angioödem und Pruritus) beobachtet. Diese Reaktionen klingen normalerweise nach Absetzen des Arzneimittels ab. Anaphylaxie wurde ebenfalls berichtet.
Andere
Andere Reaktionen umfassten Leberfunktionsstörungen einschließlich Cholestase und Erhöhungen der Serumtransaminase, Juckreiz im Genitalbereich, Moniliasis im Genitalbereich, Vaginitis, mäßige vorübergehende Neutropenie, Fieber. Agranulozytose, Thrombozytopenie, idiosynkratisches Leberversagen, Erythema multiforme, Stevens-Johnson-Syndrom, Serumkrankheit und Arthralgie wurden selten berichtet.
Zusätzlich zu den oben aufgeführten Nebenwirkungen, die bei mit Cefadroxil behandelten Patienten beobachtet wurden, wurden die folgenden Nebenwirkungen und veränderten Labortests für Antibiotika der Cephalosporin-Klasse berichtet:
Toxische epidermale Nekrolyse, Bauchschmerzen, Superinfektion, Nierenfunktionsstörung, toxische Nephropathie, aplastische Anämie, hämolytische Anämie, Blutung, verlängerte Prothrombinzeit, positiver Coombs-Test, erhöhtes BUN, erhöhtes Kreatinin, erhöhte alkalische Phosphatase, erhöhte Aspartataminotransferase (AST), erhöhte Alaninaminotransferase (ALT), erhöhtes Bilirubin, erhöhte LDH, Eosinophilie, Panzytopenie, Neutropenie.
Mehrere Cephalosporine wurden mit der Auslösung von Anfällen in Verbindung gebracht, insbesondere bei Patienten mit eingeschränkter Nierenfunktion, wenn die Dosierung nicht reduziert wurde (siehe DOSIERUNG UND VERABREICHUNG und ÜBERDOSIERUNG). Wenn Krampfanfälle im Zusammenhang mit der medikamentösen Therapie auftreten, sollte das Medikament abgesetzt werden. Eine antikonvulsive Therapie kann gegeben werden, wenn klinisch indiziert.
Überdosierung
Eine Studie mit Kindern unter sechs Jahren ergab, dass die Einnahme von weniger als 250 mg / kg Cephalosporinen nicht mit signifikanten Ergebnissen verbunden ist. Es sind keine anderen Maßnahmen als allgemeine Unterstützung und Beobachtung erforderlich. Bei Mengen von mehr als 250 mg / kg Magenentleerung einleiten.
Bei fünf anurischen Patienten wurde gezeigt, dass durchschnittlich 63% einer oralen Dosis von 1 g während einer 6-8-stündigen Hämodialysesitzung aus dem Körper extrahiert werden.
Duricef Dosierung und Anwendung
Duricef ist säurestabil und kann oral ohne Rücksicht auf Mahlzeiten verabreicht werden. Die Verabreichung mit Nahrung kann hilfreich sein, um potenzielle gastrointestinale Beschwerden zu verringern, die gelegentlich mit einer oralen Cephalosporin-Therapie verbunden sind.
Erwachsene
Harnwegsinfektionen: Bei unkomplizierten Infektionen der unteren Harnwege (d. H. Zystitis) beträgt die übliche Dosierung 1 oder 2 g pro Tag in einer Einzeldosis (q.d.) oder geteilten Dosis (b.i.d.).
Bei allen anderen Harnwegsinfektionen beträgt die übliche Dosierung 2 g pro Tag in aufgeteilten Dosen (b.i.d.).
Haut- und Hautstrukturinfektionen: Bei Haut- und Hautstrukturinfektionen beträgt die übliche Dosierung 1 g pro Tag in Einzeldosen (q.d.) oder geteilten Dosen (b.i.d.).
Pharyngitis und Tonsillitis: Behandlung der beta-hämolytischen Streptokokken—Pharyngitis und Tonsillitis der Gruppe A- 1 g pro Tag in Einzeldosen (q.d.) oder geteilten Dosen (b.i.d.) für 10 Tage.
Kinder
Bei Harnwegsinfektionen beträgt die empfohlene Tagesdosis für Kinder 30 mg/kg/Tag in aufgeteilten Dosen alle 12 Stunden. Bei Pharyngitis, Tonsillitis und Impetigo beträgt die empfohlene Tagesdosis für Kinder 30 mg/kg / Tag in einer Einzeldosis oder in gleichmäßig aufgeteilten Dosen alle 12 Stunden. Bei anderen Haut- und Hautstrukturinfektionen beträgt die empfohlene Tagesdosis 30 mg / kg / Tag in gleichmäßig aufgeteilten Dosen alle 12 Stunden. Bei der Behandlung von beta-hämolytischen Streptokokkeninfektionen sollte eine therapeutische Dosierung von Duricef für mindestens 10 Tage verabreicht werden.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 TL |
Nierenfunktionsstörung
Bei Patienten mit bei eingeschränkter Nierenfunktion sollte die Dosierung von Cefadroxilmonohydrat entsprechend den Kreatinin-Clearance-Raten angepasst werden, um eine Akkumulation des Arzneimittels zu verhindern. Der folgende Zeitplan wird vorgeschlagen. Bei Erwachsenen beträgt die Anfangsdosis 1000 mg Duricef und die Erhaltungsdosis (basierend auf der Kreatinin-Clearance-Rate ) 500 mg in den unten aufgeführten Zeitintervallen.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients mit Kreatinin-Clearance-Raten über 50 ml / min kann behandelt werden, als wären sie Patienten mit normaler Nierenfunktion.
| Flaschengröße | Anleitung zur Zubereitung der Suspension zum Einnehmen |
| 100 ml |
In insgesamt 67 ml Wasser suspendieren. Methode: Tap flasche leicht zu lösen pulver. 67 ml Wasser in zwei Portionen zugeben. Nach jeder Zugabe gut schütteln. |
| 75 ml |
In insgesamt 51 ml Wasser suspendieren. Methode: Tap flasche leicht zu lösen pulver. 51 ml Wasser in zwei Portionen zugeben. Nach jeder Zugabe gut schütteln. |
| 50 ml |
In insgesamt 34 ml Wasser suspendieren. Methode: Tap flasche leicht zu lösen pulver. Fügen Sie 34 ml Wasser in zwei Portionen hinzu. Nach jeder Zugabe gut schütteln. |
|
Nach der Rekonstitution im Kühlschrank aufbewahren. Vor Gebrauch gut schütteln. Behälter dicht verschlossen halten. Nicht verwendete Portion nach 14 Tagen verwerfen. |
|
Wie wird Duricef geliefert?
Duricef® (Cefadroxil-Monohydrat, USP) 500 mg Kapseln: opake, kastanienbraune und weiße Hartgelatinekapseln mit dem Aufdruck „PPP“ und „784“ an einem Ende und mit “ Duricef“ und „500 mg“ am anderen Ende.
Kapseln werden wie folgt geliefert:
N 0430-0780-19 Flasche mit 50
Bei kontrollierter Raumtemperatur 15° -30 ° C (59° -86 ° F) lagern.
Duricef® 1-Gramm-Tabletten: weiß bis cremefarben, oben halbiert, oval geformt, bedruckt mit „PPP“ auf einer Seite der Halbierenden und „785“ auf der anderen Seite der Halbierenden. Tabletten werden wie folgt geliefert:
N 0430-0781-19 Flasche mit 50
Bei kontrollierter Raumtemperatur 15 ° -30 ° C (59° -86 ° F) lagern.
Duricef® zur Herstellung einer Suspension zum Einnehmen ist mit Orangen-Ananas-Geschmack aromatisiert und wird wie folgt geliefert:
250 mg/5 ml N 0430-2782-15 50 ml Flasche
N 0430-2782-17 100 ml Flasche
500 mg/5 ml N 0430-2783-16 75 ml Flasche
N 0430-2783-17 100 ml Flasche
Vor der Rekonstitution: bei kontrollierter Raumtemperatur 15°-30° C (59°-86° F).
1. Nationales Komitee für klinische Laborstandards, genehmigter Standard, Leistungsstandards für den antimikrobiellen Scheibenempfindlichkeitstest, 4. Auflage, Vol. 10 (7): M2-A4, Villanova, PA, April 1990.
2. Nationales Komitee für klinische Laborstandards, genehmigter Standard: Methoden zur Verdünnung Antimikrobielle Empfindlichkeitstests für Bakterien, die aerob wachsen, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, April 1990.
Hergestellt von Bristol-Myers Squibb Co.Princeton, NJ 08543 Für Warner Chilcott Company, Inc.
Fajardo, PR 00738
Vermarktet von Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: Cephalosporine der ersten Generation
Verbraucherressourcen
- Weiterführende Literatur
Professionelle Ressourcen
- Verschreibungsinformationen
- Cefadroxil Suspension zum Einnehmen (FDA)
Zugehörige Behandlungsleitfäden
- Bakterielle Endokarditis Prävention
- Haut- und Strukturinfektion
- Impetigo
- Niereninfektionen
- … +4 mehr
Medizinischer Haftungsausschluss
Leave a Reply