Duricef
Generiskt Namn: cefadroxil
doseringsform: pulver, för suspension
medicinskt granskad av Drugs.com. Senast uppdaterad den 21 April 2020.
- översikt
- biverkningar
- dosering
- Professional
- interaktioner
- mer
För att minska utvecklingen av läkemedelsresistenta bakterier och upprätthålla effektiviteten av Duricef-ci och andra antibakteriella läkemedel, bör Duricef endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta för att orsakas av bakterier.
Duricef beskrivning
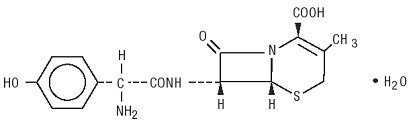
Duricef är ett semisyntetiskt cefalosporinantibiotikum avsett för oral administrering. Det är ett vitt till gulvitt kristallint pulver. Det är lösligt i vatten och det är syrastabilt. Det betecknas kemiskt som 5-Tia-1-azabicyklooct-2-ene-2-karboxylsyra, 7-amino]-3-metyl-8-oxo -, monohydrat] -. Den har formeln C16H17N3O5S * H2O och molekylvikten 381.40. Den har följande strukturformel:
Duricef filmdragerade tabletter, 1 g, innehåller följande inaktiva ingredienser: mikrokristallin cellulosa, hydroxipropylmetylcellulosa, magnesiumstearat, polyetylenglykol, polysorbat 80, simetikonemulsion och titandioxid.
Duricef för oral Suspension innehåller följande inaktiva ingredienser: FD&C gul nr 6, smaker (naturliga och artificiella), polysorbat 80, natriumbensoat, sackaros och xantangummi.
Duricef kapslar innehåller följande inaktiva ingredienser: D&C Red No.28, FD&C Blue No. 1, FD& C Red No. 40, gelatin, magnesiumstearat och titandioxid.
Duricef – klinisk farmakologi
Duricef absorberas snabbt efter oral administrering. Efter engångsdoser på 500 mg och 1000 mg var de genomsnittliga maximala serumkoncentrationerna cirka 16 respektive 28 mikrogram/mL. Mätbara nivåer förekom 12 timmar efter administrering. Över 90% av läkemedlet utsöndras oförändrat i urinen inom 24 timmar. Maximala urinkoncentrationer är cirka 1800 mikrog/mL under perioden efter en oral engångsdos på 500 mg. Dosökningar ger i allmänhet en proportionell ökning av urinkoncentrationen Duricef (cefadroxil monohydrat, USP). Urinantibiotikakoncentrationen, efter en dos på 1 g, bibehölls långt över MIC av mottagliga urinpatogener i 20 till 22 timmar.
mikrobiologi
in vitro-tester visar att cefalosporinerna är bakteriedödande på grund av deras hämning av cellväggssyntes. Cefadroxil har visat sig vara aktivt mot följande organismer både in vitro och vid kliniska infektioner (se indikationer och användning):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Den har ingen aktivitet mot Pseudomonas arter och Acinetobacter calcoaceticus (tidigare Mima och Herellea arter).
Känslighetstester: Diffusionstekniker
användningen av antibiotikaskivans mottaglighetstestmetoder som mäter zondiameter ger en exakt uppskattning av antibiotikas mottaglighet. Ett sådant standardprocedur1 som har rekommenderats för användning med skivor för att testa organismernas känslighet för cefadroxil använder cefalosporinklassen (cefalotin) skiva. Tolkning innefattar korrelationen mellan diametrarna erhållna i skivtestet med den minsta hämmande koncentrationen (MIC) för cefadroxil.
rapporter från laboratoriet som ger resultat av det vanliga känslighetstestet på en skiva med en 30 cu g cephalothin-skiva ska tolkas enligt följande kriterier:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of ”Mottaglig” indikerar att patogenen sannolikt kommer att hämmas av allmänt uppnåeliga blodnivåer. En rapport om” intermediär känslighet ” tyder på att organismen skulle vara mottaglig om hög dosering används eller om infektionen är begränsad till vävnad och vätskor (t.ex. urin) där höga antibiotikanivåer uppnås. En rapport om ”resistent” indikerar att uppnåbara koncentrationer av antibiotikumet sannolikt inte är hämmande och annan behandling bör väljas.
standardiserade procedurer kräver användning av laboratoriekontrollorganismer. Cephalothin-skivan på 30 kg bör ge följande zondiametrar:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (inklusive mikrodilution) metod2 eller motsvarande kan ett bakterieisolat anses mottagligt om MIC-värdet (minsta hämmande koncentration) för cephalotin är 8 mikrog/mL eller mindre. Organismer anses vara resistenta om MIC är 32 mikrogram/mL eller mer. Organismer med ett MIC-värde på mindre än 32 mikrogram/mL men större än 8 mikrogram/mL är mellanliggande.
som med vanliga diffusionsmetoder kräver utspädningsförfaranden användning av laboratoriekontrollorganismer. Standard cephalothin pulver bör ge MIC-värden i intervallet 0,12 mikrogram / mL och 0,5 mikrogram / mL för Staphylococcus aureus ATCC 29213. För Escherichia coli ATCC 25922 bör MIC-intervallet vara mellan 4,0 mikrogram/mL och 16,0 mikrogram/mL. För Streptococcus faecalis ATCC 29212 bör MIC-intervallet vara mellan 8,0 och 32,0 mikrogram/mL.
indikationer och användning för Duricef
Duricef är indicerat för behandling av patienter med infektion orsakad av mottagliga stammar av de utsedda organismerna vid följande sjukdomar:
urinvägsinfektioner orsakade av E. coli, P. mirabilis och Klebsiella arter.
hud-och hudstrukturinfektioner orsakade av stafylokocker och/eller streptokocker.
faryngit och / eller tonsillit orsakad av Streptococcus pyogenes (grupp A beta-hemolytiska streptokocker).
OBS: Endast penicillin via intramuskulär administreringsväg har visat sig vara effektivt vid profylax av reumatisk feber. Duricef är generellt effektivt vid utrotning av streptokocker från orofarynxen. Data som fastställer effekten av Duricef för profylax av efterföljande reumatisk feber är emellertid inte tillgängliga.
Obs: kultur-och känslighetstester bör inledas före och under behandlingen. Njurfunktionsstudier bör utföras när det anges.
För att minska utvecklingen av läkemedelsresistenta bakterier och upprätthålla effektiviteten hos Duricef och andra antibakteriella läkemedel, bör Duricef endast användas för att behandla eller förebygga infektioner som bevisas eller starkt misstänks orsakas av mottagliga bakterier. När kultur-och känslighetsinformation finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell behandling. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till empiriskt urval av terapi.
kontraindikationer
Duricef är kontraindicerat hos patienter med känd allergi mot cefalosporingruppen antibiotika.
varningar
innan behandling med Duricef inleds bör noggrann undersökning göras för att avgöra om patienten har haft tidigare överkänslighetsreaktioner mot CEFADROXIL, cefalosporiner, penicilliner eller andra läkemedel. OM DENNA PRODUKT SKA GES TILL PENICILLINKÄNSLIGA PATIENTER, BÖR FÖRSIKTIGHET IAKTTAS EFTERSOM KORSKÄNSLIGHET BLAND BETA-LAKTAMANTIBIOTIKA HAR DOKUMENTERATS TYDLIGT OCH KAN FÖREKOMMA HOS UPP TILL 10% AV PATIENTERNA MED EN HISTORIA AV PENICILLINALLERGI.
om en allergisk reaktion mot Duricef inträffar, avbryt läkemedlet. ALLVARLIGA AKUTA ÖVERKÄNSLIGHETSREAKTIONER KAN KRÄVA BEHANDLING MED EPINEFRIN OCH ANDRA NÖDÅTGÄRDER, INKLUSIVE SYRE, INTRAVENÖSA VÄTSKOR, INTRAVENÖSA ANTIHISTAMINER, KORTIKOSTEROIDER, PRESSORAMINER OCH LUFTVÄGSHANTERING, SOM KLINISKT INDICERAT.
Clostridium difficile-associerad diarre (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive Duricef, och kan variera i svårighetsgrad från mild diarre till dödlig kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och dödlighet, eftersom dessa infektioner kan vara eldfasta mot antimikrobiell behandling och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som uppvisar diarre efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa under två månader efter administrering av antibakteriella medel.
om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske-och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör inledas enligt kliniskt indicerat.
försiktighetsåtgärder
allmänt
Duricef ska användas med försiktighet i närvaro av markant nedsatt njurfunktion (kreatininclearance på mindre än 50 mL/min/1, 73 M2). (Se dosering och administrering.) Hos patienter med känt eller misstänkt nedsatt njurfunktion bör noggrann klinisk observation och lämpliga laboratoriestudier göras före och under behandlingen.
förskrivning av Duricef i avsaknad av en bevisad eller starkt misstänkt bakteriell infektion eller en profylaktisk indikation är osannolikt att ge nytta för patienten och ökar risken för utveckling av läkemedelsresistenta bakterier.
långvarig användning av Duricef kan leda till överväxt av icke-uppfattbara organismer. Noggrann observation av patienten är nödvändig. Om superinfektion inträffar under behandlingen bör lämpliga åtgärder vidtas.
Duricef ska förskrivas med försiktighet till personer med gastrointestinal sjukdom i anamnesen, särskilt kolit.
information för patienter
patienter ska rådas att antibakteriella läkemedel inklusive Duricef endast ska användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När Duricef ordineras för att behandla en bakteriell infektion, bör patienter få veta att även om det är vanligt att må bättre tidigt under behandlingen, ska medicinen tas exakt enligt anvisningarna. Hoppa över doser eller inte slutföra hela behandlingen kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och kommer inte att behandlas av Duricef eller andra antibakteriella läkemedel i framtiden.
diarre är ett vanligt problem som orsakas av antibiotika som vanligtvis slutar när antibiotikumet avbryts. Ibland efter att ha påbörjat behandling med antibiotika kan patienter utveckla vattniga och blodiga avföring (med eller utan magkramper och feber) även så sent som två eller flera månader efter att ha tagit den sista dosen av antibiotikumet. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
läkemedels – /Laboratorietestinteraktioner
positiva direkta Coombs-tester har rapporterats under behandling med cefalosporinantibiotika. I hematologiska studier eller vid transfusionskorsmatchningsförfaranden när antiglobulintester utförs på den mindre sidan eller i Coombs testning av nyfödda vars mödrar har fått cefalosporinantibiotika före förlossning, bör det erkännas att ett positivt Coombs test kan bero på läkemedlet.
karcinogenes, mutagenes och nedsatt fertilitet
inga långtidsstudier har utförts för att bestämma karcinogen potential. Inga genetiska toxicitetstester har utförts.
graviditet: Graviditet kategori B
reproduktionsstudier har utförts på möss och råttor i doser upp till 11 gånger humandosen och har inte visat några tecken på nedsatt fertilitet eller skada på fostret på grund av cefadroxil monohydrat. Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom djurreproduktionsstudier inte alltid är prediktiva för mänskligt svar, bör detta läkemedel endast användas under graviditet om det är klart nödvändigt.
arbete och leverans
Duricef har inte studerats för användning under arbete och leverans. Behandling ska endast ges om det är uppenbart nödvändigt.
ammande mödrar
försiktighet bör iakttas när cefadroxil monohydrat administreras till en ammande mamma.
pediatrisk användning
(se dosering och administrering.)
geriatrisk användning
av cirka 650 patienter som fick cefadroxil för behandling av urinvägsinfektioner i tre kliniska studier var 28% 60 år och äldre, medan 16% var 70 år och äldre. Av cirka 1000 patienter som fick cefadroxil för behandling av hud-och hudstrukturinfektion i 14 kliniska prövningar var 12% 60 år och äldre medan 4% var 70 år och äldre. Inga övergripande skillnader i säkerhet observerades mellan äldre patienter i dessa studier och yngre patienter. Kliniska studier av cefadroxil för behandling av faryngit eller tonsillit omfattade inte tillräckligt många patienter 65 år och äldre för att avgöra om de svarar annorlunda än yngre patienter. Annan rapporterad klinisk erfarenhet av cefadroxil har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Cefadroxil utsöndras väsentligt av njurarna och dosjustering är indicerad för patienter med nedsatt njurfunktion (se dosering och administrering: nedsatt njurfunktion). Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör försiktighet iakttas vid dosval och det kan vara användbart att övervaka njurfunktionen.
biverkningar
Gastrointestinal
symtom på pseudomembranös kolit kan uppträda under eller efter antibiotikabehandling (se varningar). Dyspepsi, illamående och kräkningar har rapporterats i sällsynta fall. Diarre har också inträffat.
överkänslighet
allergier (i form av utslag, urtikaria, angioödem och klåda) har observerats. Dessa reaktioner avtog vanligtvis vid avbrytande av läkemedlet. Anafylaxi har också rapporterats.
andra
andra reaktioner har inkluderat leverdysfunktion inklusive kolestas och förhöjningar av serumtransaminas, genital klåda, genital moniliasis, vaginit, måttlig övergående neutropeni, feber. Agranulocytos, trombocytopeni, idiosynkratisk leversvikt, erythema multiforme, Stevens-Johnsons syndrom, serumsjukdom och artralgi har rapporterats i sällsynta fall.
förutom de ovan angivna biverkningarna som har observerats hos patienter som behandlats med cefadroxil har följande biverkningar och förändrade laboratorietester rapporterats för cefalosporinklassantibiotika:
toxisk epidermal nekrolys, buksmärta, superinfektion, njurdysfunktion, toxisk nefropati, aplastisk anemi, hemolytisk anemi, blödning, förlängd protrombintid, positivt Coombs-test, ökad BUN, ökat kreatinin, förhöjt alkaliskt fosfatas, förhöjt aspartataminotransferas (ASAT), förhöjt alaninaminotransferas (alat), förhöjt bilirubin, förhöjt LDH, eosinofili, pancytopeni, neutropeni.
flera cefalosporiner har varit inblandade i att utlösa kramper, särskilt hos patienter med nedsatt njurfunktion, när dosen inte reducerades (se dosering och administrering och överdosering). Om anfall i samband med läkemedelsbehandling inträffar, ska läkemedlet avbrytas. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
överdosering
en studie av barn under sex år föreslog att intag av mindre än 250 mg/kg cefalosporiner inte är associerat med signifikanta resultat. Ingen åtgärd krävs annat än allmänt stöd och observation. För mängder större än 250 mg/kg, inducera gastrisk tömning.
hos fem anuriska patienter visades att i genomsnitt 63% av en 1 g oral dos extraheras från kroppen under en 6-8 timmars hemodialyssession.
Duricef dosering och administrering
Duricef är syrastabil och kan administreras oralt utan hänsyn till måltider. Administrering med mat kan vara till hjälp vid minskande potentiella gastrointestinala klagomål som ibland förknippas med oral cefalosporinbehandling.
vuxna
urinvägsinfektioner: För okomplicerade nedre urinvägsinfektioner (dvs cystit) är den vanliga dosen 1 eller 2 g per dag i en enda (q.d.) eller uppdelade doser (B.i.d.).
för alla andra urinvägsinfektioner är den vanliga dosen 2 g per dag i uppdelade doser (b.i.d.).
hud-och Hudstrukturinfektioner: för hud-och hudstrukturinfektioner är den vanliga dosen 1 g per dag i enstaka (q.d.) eller uppdelade doser (B.i.d.).
faryngit och tonsillit: behandling av grupp A beta-hemolytisk streptokockfaryngit och tonsillit—1 g per dag i singel (q.d.) eller uppdelade doser (b.i.d.) i 10 dagar.
barn
för urinvägsinfektioner är den rekommenderade dagliga dosen för barn 30 mg / kg / dag i uppdelade doser var 12: e timme. För faryngit, tonsillit och impetigo är den rekommenderade dagliga dosen för barn 30 mg/kg/dag i en enstaka dos eller i lika uppdelade doser var 12: e timme. För andra hud-och hudstrukturinfektioner är den rekommenderade dagliga dosen 30 mg/kg/dag i lika uppdelade doser var 12: e timme. Vid behandling av beta-hemolytiska streptokockinfektioner bör en terapeutisk dos av Duricef administreras i minst 10 dagar.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8 + | — | 2 tsk |
nedsatt njurfunktion
hos patienter med nedsatt njurfunktion bör dosen av Cefadroxil-monohydrat justeras enligt kreatininclearance-hastigheter för att förhindra ackumulering av läkemedel. Följande schema föreslås. Hos vuxna är initialdosen 1000 mg Duricef och underhållsdosen (baserat på kreatininclearance-hastigheten ) är 500 mg vid de tidsintervall som anges nedan.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients med kreatininclearance över 50 mL / min kan behandlas som om de var patienter med normal njurfunktion.
| flaskstorlek | anvisningar för beredning |
| 100 ml |
Avbryt totalt 67 ml vatten. metod: tryck lätt på flaskan för att lossa pulvret. tillsätt 67 mL vatten i två portioner. Skaka väl efter varje tillsats. |
| 75 mL |
suspendera i totalt 51 mL vatten. metod: tryck lätt på flaskan för att lossa pulvret. tillsätt 51 mL vatten i två portioner. Skaka väl efter varje tillsats. |
| 50 mL |
suspendera i totalt 34 mL vatten. metod: tryck lätt på flaskan för att lossa pulvret. tillsätt 34 mL vatten i två portioner. Skaka väl efter varje tillsats. |
|
efter beredning, förvaras i kylskåp. Skaka väl innan du använder. håll behållaren tätt stängd. Kassera oanvänd portion efter 14 dagar. |
|
hur levereras Duricef
Duricef Aci (cefadroxil monohydrat, USP) 500 mg kapslar: ogenomskinliga, rödbruna och vita hårda gelatinkapslar, märkta med ”PPP” och ”784” i ena änden och med ”Duricef” och ”500 mg” i andra änden.
kapslar levereras enligt följande:
N 0430-0780-19 flaska 50
Förvara vid kontrollerad rumstemperatur 15-30 C (59 86 F).
Duricef 1 gram tabletter: vita till benvita, toppbisekterade, ovala, präglade med ” PPP ”på ena sidan av bisekten och” 785 ” på andra sidan bisekten. Tabletterna levereras enligt följande:
N 0430-0781-19 flaska med 50
Förvara vid kontrollerad rumstemperatur 15-30-C (59-86-F).
Duricef ASIC för oral Suspension är smaksatt med apelsin-ananas och levereras enligt följande:
250 mg/5 mL n 0430-2782-15 50 mL flaska
N 0430-2782-17 100 mL flaska
500 mg/5 mL n 0430-2783-16 75 mL flaska
n 0430-2783-17 100 mL flaska
före beredning: Förvara vid kontrollerad rumstemperatur 15-30-C (59-86-c).
1. National Committee for Clinical Laboratory Standards, godkänd Standard, prestandastandarder för antimikrobiell Diskkänslighetstest, 4: e upplagan, Vol. 10 (7): M2-A4, Villanova, PA, April, 1990.
2. National Committee for Clinical Laboratory Standards, godkänd Standard: Metoder för utspädning antimikrobiella Känslighetstester för bakterier som växer aerobt, 2: a upplagan, Vol. 10 (8): M7-A2, Villanova, PA, April, 1990.
Tillverkad av Bristol-Myers Squibb Co.
Princeton, NJ 08543
för Warner Chilcott Company, Inc.
Fajardo, PR 00738
marknadsförs av Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: första generationens cefalosporiner
Konsumentresurser
- avancerad läsning
professionella resurser
- förskrivningsinformation
- Cefadroxil oral Suspension (FDA)
relaterade behandlingsguider
- förebyggande av bakteriell endokardit
- hud-och Strukturinfektion
- impetigo
- njurinfektioner
- … + 4 Mer
Medicinsk ansvarsfriskrivning
Leave a Reply