Duricef
Generisk Navn: cefadroxil
Doseringsform: pulver, til suspensjon
Medisinsk gjennomgått av Drugs.com. Sist oppdatert 21.April 2020.
- Oversikt
- Bivirkninger
- Dosering
- Interaksjoner
- Mer
For å redusere utviklingen av resistente bakterier og opprettholde Effekten Av Duricef® og andre antibakterielle legemidler, Bør Duricef bare brukes til å behandle eller forebygge infeksjoner som er påvist eller sterkt mistenkt for å være forårsaket av bakterier.
Duricef Beskrivelse
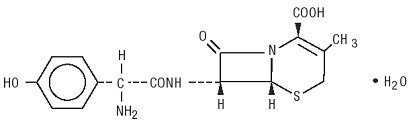
Duricef Er et semisyntetisk cefalosporin antibiotikum beregnet til oral administrering. Det er et hvitt til gulaktig hvitt krystallinsk pulver. Det er løselig i vann og det er syrestabilt. Det er kjemisk betegnet som 5-Thia-1-azabicyclooct-2-ene-2-karboksylsyre, 7-amino] – 3-metyl-8-okso -, monohydrat]-. Den har formelen C16H17N3O5S * H2O OG molekylvekten på 381,40. Den har følgende strukturformel:
Duricef filmdrasjerte tabletter, 1 g, inneholder følgende inaktive ingredienser: mikrokrystallinsk cellulose, hydroksypropylmetylcellulose, magnesiumstearat, polyetylenglykol, polysorbat 80, simetikon emulsjon og titandioksid.
Duricef For Mikstur inneholder følgende inaktive ingredienser:FD &C Gul no. 6, smaker (naturlig og kunstig), polysorbat 80, natriumbenzoat, sukrose, og xantangummi.
Duricef kapsler inneholder følgende inaktive ingredienser: D&C Rød no. 28, FD&C Blå No. 1, FD&c Rød no. 40, gelatin, magnesiumstearat og titandioksid.
Duricef-Klinisk Farmakologi
Duricef absorberes raskt etter oral administrering. Etter enkeltdoser på 500 mg og 1000 mg var gjennomsnittlig maksimal serumkonsentrasjon henholdsvis ca. 16 og 28 µ/mL. Målbare nivåer var til stede 12 timer etter administrering. Over 90% av legemidlet utskilles uendret i urinen innen 24 timer. Maksimal urinkonsentrasjon er ca. 1800 µ / mL i perioden etter en oral enkeltdose på 500 mg. Økninger i dosering gir generelt en forholdsmessig økning i Duricef (cefadroxilmonohydrat, USP) urinkonsentrasjon. Urinantibiotikumkonsentrasjonen, etter en 1 g dose, ble opprettholdt godt over MIC av følsomme urinpatogener i 20 til 22 timer.
Mikrobiologi
in vitro-tester viser At cefalosporiner er bakteriedrepende på grunn av deres hemming av celleveggsyntese. Cefadroxil har vist seg å være aktiv mot følgende organismer både in vitro og ved kliniske infeksjoner (SE INDIKASJONER og BRUK):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Det har ingen aktivitet mot Pseudomonas-arter og Acinetobacter calcoaceticus (tidligere mima-og Herellea-arter).
Følsomhetstester: Diffusjonsteknikker
bruk av antibiotika disk følsomhetstestmetoder som måler sonediameter gir en nøyaktig estimering av antibiotikaresistens. En slik standard prosedyre1 som er anbefalt for bruk med disker for å teste mottakelighet av organismer til cefadroxil bruker cephalosporin klasse (cephalothin) disk. Tolkning innebærer korrelasjonen av diametrene oppnådd i diskprøven med den minste hemmende konsentrasjonen (MIC) for cefadroxil.
Rapporter fra laboratoriet som gir resultater fra standard enkeltdisk følsomhetstest med en 30 µ cephalothin disk skal tolkes i henhold til følgende kriterier:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of «Følsom» indikerer at patogenet sannsynligvis vil bli hemmet av generelt oppnåelige blodnivåer. En rapport om» mellomliggende følsomhet » antyder at organismen vil være mottakelig hvis høy dosering brukes eller hvis infeksjonen er begrenset til vev og væsker (f. eks. En rapport om «Resistent» indikerer at oppnåelige konsentrasjoner av antibiotika er usannsynlig å være hemmende og annen behandling bør velges.
Standardiserte prosedyrer krever bruk av laboratoriekontrollorganismer. Den 30 µ cephalothin disk skal gi følgende sonediametre:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (inkludert mikrofortynning) metode2 eller tilsvarende, kan et bakterieisolat anses som sensitivt dersom MIC-verdien (minimum inhibitorisk konsentrasjon) for cefalotin er 8 µ / mL eller mindre. Organismer anses som resistente hvis MIC er 32 µ / mL eller høyere. Organismer med EN MIC-verdi på mindre enn 32 hryvnias / mL, men større enn 8 hryvnias / mL er middels store.
som med standard diffusjonsmetoder krever fortynning bruk av laboratoriekontrollorganismer. Standard cefalotinpulver bør gi MIC-verdier i området 0,12 µ / mL og 0,5 µ / mL For Staphylococcus aureus ATCC 29213. For Escherichia coli ATCC 25922 bør MIC-området være mellom 4,0 µ / mL og 16,0 µ / mL. For Streptococcus faecalis ATCC 29212 bør MIC-området være mellom 8,0 og 32,0 µ / mL.
Indikasjoner og Bruk For Duricef
Duricef er indisert for behandling av pasienter med infeksjoner forårsaket av følsomme stammer av de utpekte organismer ved følgende sykdommer:
Urinveisinfeksjoner forårsaket av e. coli, P. mirabilis og Klebsiella-arter.
hud-og hudstrukturinfeksjoner forårsaket av stafylokokker og / eller streptokokker.
Faryngitt og / eller tonsillitt forårsaket Av Streptococcus pyogenes (gruppe a beta-hemolytiske streptokokker).
Merk: bare penicillin ved intramuskulær administrasjonsvei har vist seg å være effektiv i profylakse av revmatisk feber. Duricef er generelt effektiv i utryddelsen av streptokokker fra oropharynx. Data som fastslår Effekten Av Duricef for profylakse av påfølgende revmatisk feber er imidlertid ikke tilgjengelig.
Merk: Kultur-og følsomhetstester bør initieres før og under behandlingen. Nyrefunksjonsstudier bør utføres når indisert.For å redusere utviklingen av legemiddelresistente bakterier og opprettholde Effekten Av Duricef og andre antibakterielle legemidler, Bør Duricef bare brukes til å behandle eller forebygge infeksjoner som er påvist eller sterkt mistenkt for å være forårsaket av følsomme bakterier. Når informasjon om kultur og følsomhet er tilgjengelig, bør de vurderes ved valg eller modifisering av antibakteriell behandling. I fravær av slike data kan lokal epidemiologi og følsomhetsmønstre bidra til empirisk seleksjon av terapi.
Kontraindikasjoner
Duricef er kontraindisert hos pasienter med kjent allergi mot cefalosporin-gruppen av antibiotika.
Advarsler
Før Behandling Med Duricef STARTES, BØR DET UNDERSØKES NØYE OM PASIENTEN TIDLIGERE HAR HATT OVERFØLSOMHETSREAKSJONER OVERFOR CEFADROKSIL, CEFALOSPORINER, PENICILLINER eller ANDRE LEGEMIDLER. HVIS DETTE PRODUKTET SKAL GIS TIL PENICILLINFØLSOMME PASIENTER, BØR DET UTVISES FORSIKTIGHET FORDI KRYSSFØLSOMHET BLANT BETA-LAKTAMANTIBIOTIKA ER TYDELIG DOKUMENTERT OG KAN FOREKOMME HOS OPPTIL 10% AV PASIENTENE MED TIDLIGERE PENICILLINALLERGI.
HVIS EN ALLERGISK REAKSJON PÅ Duricef OPPSTÅR, AVBRYT LEGEMIDLET. ALVORLIGE AKUTTE OVERFØLSOMHETSREAKSJONER KAN KREVE BEHANDLING MED ADRENALIN OG ANDRE NØDTILTAK, INKLUDERT OKSYGEN, INTRAVENØSE VÆSKER, INTRAVENØSE ANTIHISTAMINER, KORTIKOSTEROIDER, PRESSORAMINER OG LUFTVEISADMINISTRASJON, SOM KLINISK INDISERT.Clostridium difficile associated diare (CDAD) er rapportert ved bruk av nesten alle antibakterielle midler, inkludert Duricef, og kan variere i alvorlighetsgrad fra mild diare til dødelig kolitt. Behandling med antibakterielle midler endrer den normale floraen i tykktarmen som fører Til overvekst Av c. difficile.c. difficile produserer toksiner A og B som bidrar til UTVIKLINGEN AV CDAD. Hypertoksinproduserende stammer av c. difficile forårsaker økt morbiditet og mortalitet, da disse infeksjonene kan være refraktære mot antimikrobiell behandling og kan kreve kolektomi. CDAD må vurderes hos alle pasienter som får diare etter antibiotikabruk. Forsiktig medisinsk historie er nødvendig siden CDAD er rapportert å forekomme over to måneder etter administrering av antibakterielle midler.
dersom CDAD mistenkes eller bekreftes, kan det være nødvendig å seponere pågående antibiotikabruk som Ikke er rettet Mot c. difficile. Passende væske-og elektrolyttbehandling, proteintilskudd, antibiotikabehandling Av c. difficile og kirurgisk evaluering bør igangsettes som klinisk indisert.
Forholdsregler
Generelt
Duricef bør brukes med forsiktighet i nærvær av markert nedsatt nyrefunksjon (kreatininclearance på mindre enn 50 mL/min/1,73 M2). (SE DOSERING og ADMINISTRASJON.) Hos pasienter med kjent eller mistenkt nedsatt nyrefunksjon bør nøye klinisk observasjon og egnede laboratoriestudier gjøres før og under behandlingen.
Forskrivning Av Duricef i fravær av påvist eller sterkt mistenkt bakteriell infeksjon eller en profylaktisk indikasjon er usannsynlig å gi nytte for pasienten og øker risikoen for utvikling av legemiddelresistente bakterier.
Langvarig Bruk Av Duricef kan føre til overvekst av ikke-følsomme organismer. Nøye observasjon av pasienten er viktig. Hvis superinfeksjon oppstår under behandlingen, bør egnede tiltak tas.
Duricef bør forskrives med forsiktighet hos personer med tidligere gastrointestinal sykdom, spesielt kolitt.
Informasjon til Pasienter
Pasienter bør informeres om at antibakterielle legemidler, Inkludert Duricef, kun skal brukes til behandling av bakterieinfeksjoner. De behandler ikke virusinfeksjoner(f. eks. forkjølelse). Når Duricef er foreskrevet for å behandle en bakteriell infeksjon, bør pasientene bli fortalt at selv om det er vanlig å føle seg bedre tidlig i løpet av behandlingen, bør medisinen tas nøyaktig som anvist. Hoppe doser eller ikke fullføre hele løpet av behandlingen kan (1) redusere effekten av umiddelbar behandling og (2) øke sannsynligheten for at bakterier vil utvikle resistens og vil ikke være mulig å behandle Av Duricef eller andre antibakterielle legemidler i fremtiden.
Diare Er et vanlig problem forårsaket av antibiotika som vanligvis slutter når antibiotika avbrytes. Noen ganger etter å ha startet behandling med antibiotika, kan pasienter utvikle vannaktig og blodig avføring (med eller uten magekramper og feber) selv så sent som to eller flere måneder etter å ha tatt den siste dosen av antibiotika. Hvis dette skjer, bør pasientene kontakte legen så snart som mulig.
Legemiddel – / Laboratorieprøveinteraksjoner
Positive direkte Coombs-tester har blitt rapportert under behandling med cefalosporinantibiotika. I hematologiske studier eller transfusjonstester når antiglobulintester utføres på den mindre siden eller I Coombs ‘testing av nyfødte hvis mødre har fått cefalosporinantibiotika før fødsel, bør det anerkjennes at en positiv Coombs’ test kan skyldes legemidlet.
Karsinogenese, Mutagenese og Nedsatt Fertilitet
det er Ikke utført langtidsstudier for å fastslå karsinogent potensial. Ingen genetiske toksisitetstester er utført.
Graviditet: Graviditet Kategori B
Reproduksjonsstudier er utført hos mus og rotter ved doser opptil 11 ganger human dose og har ikke vist tegn på nedsatt fertilitet eller skade på fosteret på grunn av cefadroksilmonohydrat. Det er imidlertid ingen tilstrekkelige og godt kontrollerte studier hos gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Fødsel
Duricef er ikke undersøkt for bruk under fødsel. Behandling bør kun gis dersom det er helt nødvendig.
Ammende Mødre
Forsiktighet bør utvises når cefadroxilmonohydrat administreres til en ammende mor.
Pediatrisk Bruk
(SE DOSERING og ADMINISTRASJON.)
Geriatrisk Bruk
av omtrent 650 pasienter som fikk cefadroxil til behandling av urinveisinfeksjoner i tre kliniske studier, var 28% 60 år og eldre, mens 16% var 70 år og eldre. Av omtrent 1000 pasienter som fikk cefadroxil til behandling av hud-og hudstrukturinfeksjon i 14 kliniske studier, var 12% 60 år og eldre, mens 4% var 70 år og eldre. Det ble ikke observert noen generelle forskjeller i sikkerhet mellom eldre pasienter i disse studiene og yngre pasienter. Kliniske studier av cefadroxil for behandling av faryngitt eller tonsillitt inkluderte ikke tilstrekkelig antall pasienter 65 år og eldre for å avgjøre om de reagerer annerledes enn yngre pasienter. Annen rapportert klinisk erfaring med cefadroksil har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større følsomhet hos noen eldre individer kan ikke utelukkes.
Cefadroxil utskilles vesentlig via nyrene, og dosejustering er indisert for pasienter med nedsatt nyrefunksjon(SE DOSERING og ADMINISTRASJON: Nedsatt Nyrefunksjon). Fordi eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon, bør forsiktighet utvises ved dosevalg, og det kan være nyttig å overvåke nyrefunksjonen.
Bivirkninger
Gastrointestinal
symptomer på pseudomembranøs kolitt Kan Oppstå under eller etter antibiotikabehandling(SE ADVARSLER). Dyspepsi, kvalme og oppkast er rapportert i sjeldne tilfeller. Diare har også skjedd.
Overfølsomhet
Allergier (i form av utslett, urtikaria, angioødem og kløe) er observert. Disse reaksjonene gikk vanligvis ned ved seponering av legemidlet. Anafylaksi er også rapportert.
Andre
Andre reaksjoner har inkludert nedsatt leverfunksjon, inkludert kolestase og økning i serumtransaminase, genital kløe, genital moniliasis, vaginitt, moderat forbigående nøytropeni, feber. Agranulocytose, trombocytopeni, idiosynkratisk leversvikt, erythema multiforme, Stevens-Johnsons syndrom, serumsyke og artralgi er rapportert i sjeldne tilfeller.
i tillegg til de ovennevnte bivirkningene som er observert hos pasienter behandlet med cefadroxil, er følgende bivirkninger og endrede laboratorietester rapportert for cefalosporin-klasse antibiotika:Toksisk epidermal nekrolyse, magesmerter, superinfeksjon, nyresvikt, toksisk nefropati, aplastisk anemi, hemolytisk anemi, blødning, forlenget protrombintid, positiv coombs ‘ test, økt BUN, økt kreatinin, forhøyet alkalisk fosfatase, forhøyet aspartataminotransferase( ASAT), forhøyet alaninaminotransferase (ALAT), forhøyet bilirubin, forhøyet LDH, eosinofili, pancytopeni, nøytropeni.
Flere cefalosporiner har vært involvert i utløsende anfall, spesielt hos pasienter med nedsatt nyrefunksjon, når dosen ikke ble redusert (SE DOSERING OG ADMINISTRASJON og OVERDOSERING). Hvis anfall forbundet med medisinering oppstår, bør legemidlet avbrytes. Antikonvulsiv terapi kan gis hvis det er klinisk indisert.
Overdosering
en studie av barn under seks år antydet at inntak av mindre enn 250 mg/kg cefalosporiner ikke er forbundet med signifikante utfall. Ingen handling er nødvendig annet enn generell støtte og observasjon. For mengder større enn 250 mg/kg, indusere gastrisk tømming.hos fem anuriske pasienter ble det påvist at gjennomsnittlig 63% av en 1 g oral dose ekstraheres fra kroppen i løpet av en 6-8 timers hemodialysesesjon.
Duricef Dosering og Administrasjon
Duricef er syrestabil og kan administreres oralt uten hensyn til måltider. Administrasjon sammen med mat kan være nyttig for å redusere mulige gastrointestinale plager, av og til forbundet med oral cefalosporinbehandling.
Voksne
Urinveisinfeksjoner: For ukompliserte nedre urinveisinfeksjoner (dvs. cystitis) er den vanlige dosen 1 eller 2 g per dag i en enkelt (qd) eller delt dose(bid).
for alle andre urinveisinfeksjoner er den vanlige dosen 2 g per dag i delte doser (b.i.d.).
Hud-Og Hudstrukturinfeksjoner: for hud-og hudstrukturinfeksjoner er den vanlige dosen 1 g per dag i enkeltdoser eller delte doser (b.i.d.).
Faryngitt Og Tonsillitt: behandling av gruppe a beta-hemolytisk streptokokkfaryngitt og tonsillitt-1 g per dag i enkelt (q.d.) eller delte doser (b. i.d.) i 10 dager.
Barn
for urinveisinfeksjoner er anbefalt daglig dose for barn 30 mg/kg / dag i delte doser hver 12. time. For faryngitt, tonsillitt og impetigo er anbefalt daglig dose for barn 30 mg/kg/dag i en enkelt dose eller i like delte doser hver 12. time. For andre hud-og hudstrukturinfeksjoner er anbefalt daglig dose 30 mg/kg / dag i like delte doser hver 12. time. Ved behandling av beta-hemolytiske streptokokkinfeksjoner bør En terapeutisk dose Av Duricef administreres i minst 10 dager.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | ||||||||||||||||||||||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | ||||||||||||||||||||
| 10 | 4.5 | ½ tsp | ||||||||||||||||||||
| 20 | 9.1 | 1 tsp | ||||||||||||||||||||
| 30 | 13.6 | 1½ tsp | ||||||||||||||||||||
| 40 | 18.2 | 2 tsp | 1 tsp | |||||||||||||||||||
| 50 | 22.7 | 2½ tsp | 1¼ tsp | |||||||||||||||||||
| 60 | 27.3 | 3 tsp | 1½ tsp | |||||||||||||||||||
|
70 & above |
31.8+ | — | 2 ts | |||||||||||||||||||
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients med kreatininclearance over 50 mL / min kan det behandles som om de var pasienter med normal nyrefunksjon.
| Flaskestørrelse | Rekonstitueringsveiledning |
| 100 Ml |
suspender i totalt 67 ml vann. Metode: Trykk lett på flasken for å løsne pulveret. Tilsett 67 mL vann i to porsjoner. Rist godt etter hver tilsetning. |
75 mL |
Suspender i totalt 51 mL vann. Metode: Trykk lett på flasken for å løsne pulveret. Tilsett 51 mL vann i to porsjoner. Rist godt etter hver tilsetning. |
| 50 mL |
Suspender i totalt 34 mL vann. Metode: Trykk lett på flasken for å løsne pulveret. Tilsett 34 mL vann i to porsjoner. Rist godt etter hver tilsetning. |
|
oppbevares i kjøleskap etter rekonstituering. Rist godt før bruk. hold beholderen tett lukket. Kast ubrukt porsjon etter 14 dager. |
|
Hvordan Leveres Duricef
Duricef® (cefadroxilmonohydrat, USP) 500 mg Kapsler: ugjennomsiktige, rødbrune og hvite harde gelatinkapsler, merket med «PPP» og «784» på den ene enden og med «duricef» og «500 mg» på den andre enden.
Kapsler leveres som følger:
N 0430-0780-19 Flaske med 50
Oppbevares ved kontrollert romtemperatur 15°-30° C (59°-86° F).
Duricef® 1 gram Tabletter: hvit til off white, topp bisected, oval formet, merket med «PPP «på den ene siden av bisect og» 785 » på den andre siden av bisect. Tabletter leveres som følger:
N 0430-0781-19 Flaske med 50
Oppbevares ved kontrollert romtemperatur 15°-30° C (59°-86° F).
Duricef® mikstur, Suspensjon smaksatt med appelsin-ananas, og leveres som følger:
250 mg/5 mL n 0430-2782-15 50 mL Flaske
N 0430-2782-17 100 mL Flaske
500 mg/5 mL n 0430-2783-16 75 mL Flaske
n 0430-2783-17 100 mL Flaske
Før rekonstituering: Oppbevares på kontrollert romtemperatur 15 hryvnja -30 hryvnja c (59°-86 hryvnja f).
1. Nasjonalt Utvalg For Kliniske Laboratoriestandarder, Godkjent Standard, Ytelsesstandarder for Antimikrobiell Disksensitivitetstest, 4. Utgave, Vol. 10 (7): M2-A4, Villanova, PA, April, 1990.
2. Nasjonalt Utvalg For Kliniske Laboratoriestandarder, Godkjent Standard: Metoder For Fortynning Antimikrobielle Følsomhetstester For Bakterier Som Vokser Aerobisk, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, April, 1990.Produsert Av Bristol-Myers Squibb Co.
Princeton, NJ 08543
For Warner Chilcott Company, Inc.
Fajardo, PR 00738
Markedsført Av Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: første generasjon cefalosporiner
Forbruker ressurser
Profesjonelle ressurser
Relaterte behandlingsveiledninger
- Bakteriell Endokarditt Forebygging
- Hud Og Struktur Infeksjon
- impetigo
- nyre infeksjoner
- … +4 mer
Medisinsk Ansvarsfraskrivelse
Leave a Reply