Duricef
általános név: cefadroxil
adagolási forma: por, szuszpenzióhoz
orvosilag felül Drugs.com. Utoljára frissítve: 2020. április 21.
- Áttekintés
- Mellékhatások
- Adagolás
- Szakmai
- Kölcsönhatások
- Több
csökkentése, a fejlődés, a gyógyszer-rezisztens baktériumok, illetve fenntartani a hatékonyságát Duricef®, valamint egyéb antibakteriális szerek, Duricef kell használni, csak kezelésére vagy megelőzésére fertőzések, amelyek bizonyítottan vagy erősen gyanítható, hogy baktérium okozza.
Duricef leírás
a Duricef orális beadásra szánt félszintetikus cefalosporin antibiotikum. Ez egy fehér-sárgásfehér kristályos por. Vízben oldódik, savban stabil. Kémiailag 5-Thia-1-azabiciklookt-2-én-2-karbonsav, 7-amino]-3-metil-8-oxo-, monohidrát]-nak nevezik. Képlete c16h17n3o5s * H2O, molekulatömege 381.40. A következő szerkezeti képlet:
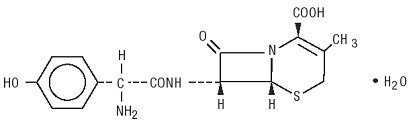
Duricef filmtabletta, 1 g, tartalmazzák a következő inaktív összetevők: mikrokristályos cellulóz, hidroxipropil-cellulóz, magnézium-sztearát, polietilén-glikol, poliszorbát 80, nyulak emulzió, illetve titán-dioxid.
a belsőleges szuszpenzióhoz való Duricef a következő inaktív összetevőket tartalmazza: FD&C sárga No. 6, ízek (természetes és mesterséges), poliszorbát 80, nátrium-benzoát, szacharóz és xantángumi.
A Duricef kapszula a következő inaktív összetevőket tartalmazza: D&C Red No.28, FD&C Blue No. 1, FD&C Red No. 40, zselatin, magnézium-sztearát és titán-dioxid.
Duricef – Klinikai farmakológia
a Duricef orális alkalmazás után gyorsan felszívódik. Az egyszeri 500 mg-os és 1000 mg-os dózisok után az átlagos szérumkoncentráció csúcsértéke megközelítőleg 16, illetve 28 µg/mL volt. Mérhető szintek voltak jelen 12 órával a beadás után. A gyógyszer több mint 90% – a változatlan formában ürül a vizelettel 24 órán belül. A vizelet csúcskoncentrációja körülbelül 1800 µg / mL Az egyszeri 500 mg-os orális adagot követő időszakban. A dózis növelése általában a Duricef (cefadroxil-monohidrát, USP) vizeletkoncentrációjának arányos növekedését eredményezi. Az 1 g-os adagot követően a vizelet antibiotikum-koncentrációját 20-22 órán keresztül jóval a fogékony húgyúti kórokozók MIC-je felett tartották.
mikrobiológia
In vitro vizsgálatok azt mutatják, hogy a cefalosporinok baktericidek, mivel gátolják a sejtfal szintézisét. A Cefadroxil aktívnak bizonyult a következő organizmusokkal szemben mind in vitro, mind klinikai fertőzések esetén (lásd a javallatokat és a felhasználást):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. A Pseudomonas fajokkal és az Acinetobacter calcoaceticus fajokkal (korábban Mima és Herellea fajokkal) szemben nincs aktivitása.
érzékenységi tesztek: diffúziós technikák
az antibiotikum lemezérzékenységi vizsgálati módszerek alkalmazása, amelyek a zóna átmérőjét mérik, pontos becslést adnak az antibiotikum érzékenységére. Az egyik ilyen standard eljárás1, amelyet a cefalosporin osztály (cefalotin) lemezt használják a cefadroxil organizmusok érzékenységének tesztelésére. Az értelmezés magában foglalja a lemezvizsgálatban kapott átmérők korrelációját a cefadroxil minimális gátló koncentrációjával (MIC).
a 30 µg cefalotin lemezzel végzett standard egylemezes érzékenységi vizsgálat eredményeit tartalmazó laboratóriumi jelentéseket a következő kritériumok szerint kell értelmezni:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of A “fogékony” azt jelzi, hogy a kórokozót valószínűleg gátolja az általánosan elérhető vérszint. Jelentés a “köztes érzékenység” arra utal, hogy a szervezet lenne fogékony, ha nagy adagot használt, vagy ha a fertőzés korlátozódik szövet, folyadékot (pl. vizelet), ahol a magas antibiotikum szint elérését. A “rezisztens” jelentés azt jelzi, hogy az antibiotikum elérhető koncentrációja valószínűleg nem lesz gátló, és más terápiát kell kiválasztani.
a szabványosított eljárások laboratóriumi ellenőrző szervezetek használatát igénylik. A 30 µg cephalothin lemeznek a következő zónaátmérőket kell adnia:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (beleértve a microdilution) method2 vagy azzal egyenértékű, a bakteriális izolátum érzékenynek tekinthető, ha a cefalotin MIC (minimális gátló koncentráció) értéke 8 µg/mL vagy annál kisebb. Az organizmusokat rezisztensnek tekintik, ha a MIC 32 µg/mL vagy annál nagyobb. A 32 µg/mL-nél kisebb, de 8 µg/mL-nél nagyobb MIC-értékkel rendelkező szervezetek közbensőek.
a standard diffúziós módszerekhez hasonlóan a hígítási eljárások laboratóriumi ellenőrző szervezetek használatát igénylik. A standard cefalotin pornak 0,12 µg/mL és 0,5 µg/mL MIC értékeket kell adnia a Staphylococcus aureus ATCC 29213 esetében. Az Escherichia coli ATCC 25922 esetében a MIC tartománynak 4, 0 µg/mL és 16, 0 µg/mL között kell lennie. A Streptococcus faecalis ATCC 29212 esetében a MIC tartománynak 8,0-32,0 µg/mL között kell lennie.
A Duricef
a Duricef javallata az E. coli, P. mirabilis és Klebsiella fajok által okozott, a kijelölt organizmusok fogékony törzsei által okozott fertőzésben szenvedő betegek kezelésére javallott a következő betegségekben:
húgyúti fertőzések.
staphylococcusok és / vagy streptococcusok által okozott bőr-és bőrszerkezeti fertőzések.
Pharyngitis és / vagy tonsillitis okozta Streptococcus pyogenes (a csoport béta-hemolitikus streptococcusok).
Megjegyzés: Csak a penicillin bizonyult hatékonynak a reumás láz profilaxisában az intramuscularis alkalmazás során. A Duricef általában hatékony a streptococcusok felszámolásában az oropharynxből. A Duricef hatásosságát a későbbi reumás láz megelőzésére szolgáló adatok azonban nem állnak rendelkezésre.
megjegyzés: a tenyészet-és érzékenységi vizsgálatokat a kezelés előtt és alatt meg kell kezdeni. A vesefunkciós vizsgálatokat szükség esetén el kell végezni.
a gyógyszerrezisztens baktériumok kialakulásának csökkentése és a Duricef és más antibakteriális szerek hatékonyságának fenntartása érdekében a Duricef-et csak olyan fertőzések kezelésére vagy megelőzésére szabad alkalmazni, amelyeket bizonyítottan vagy erősen gyaníthatóan fogékony baktériumok okoznak. Ha a tenyészetre és az érzékenységre vonatkozó információk rendelkezésre állnak, mérlegelni kell az antibakteriális terápia kiválasztásánál vagy módosításánál. Ilyen adatok hiányában a helyi epidemiológiai és érzékenységi minták hozzájárulhatnak a terápia empirikus kiválasztásához.
ellenjavallatok
a Duricef ellenjavallt az antibiotikumok cefalosporin csoportjára ismert allergiában szenvedő betegeknél.
figyelmeztetések
a Duricef-kezelés megkezdése előtt alapos vizsgálatot kell végezni annak megállapítására, hogy a betegnek korábban túlérzékenységi reakciói voltak-e CEFADROXILLAL, cefalosporinokkal, penicillinekkel vagy más gyógyszerekkel szemben. HA EZT A KÉSZÍTMÉNYT PENICILLINRE ÉRZÉKENY BETEGEKNEK KELL ADNI, ÓVATOSAN KELL ELJÁRNI, MIVEL A BÉTA-LAKTÁM ANTIBIOTIKUMOK KÖZÖTTI KERESZTÉRZÉKENYSÉGET EGYÉRTELMŰEN DOKUMENTÁLTÁK, ÉS A PENICILLIN-ALLERGIÁBAN SZENVEDŐ BETEGEK LEGFELJEBB 10% – ÁNÁL FORDULHAT ELŐ.
Ha a Duricefre allergiás reakció lép fel, hagyja abba a gyógyszert. A SÚLYOS AKUT TÚLÉRZÉKENYSÉGI REAKCIÓK SZÜKSÉGESSÉ TEHETIK AZ EPINEFRIN-KEZELÉST ÉS EGYÉB SÜRGŐSSÉGI INTÉZKEDÉSEKET, BELEÉRTVE AZ OXIGÉNT, AZ INTRAVÉNÁS FOLYADÉKOKAT, AZ INTRAVÉNÁS ANTIHISZTAMINOKAT, A KORTIKOSZTEROIDOKAT, A PRESSZOR-AMINOKAT ÉS A LÉGUTAK KEZELÉSÉT, AMINT AZ KLINIKAILAG INDOKOLT.
Clostridium difficile társuló hasmenésről (CDAD) számoltak be szinte minden antibakteriális szer, köztük a Duricef alkalmazásakor, és súlyossága az enyhe hasmenéstől a halálos vastagbélgyulladásig terjedhet. Az antibakteriális szerekkel végzett kezelés megváltoztatja a vastagbél normál növényzetét, ami a C. difficile túlnövekedéséhez vezet.
C. difficile A és B toxinokat termel, amelyek hozzájárulnak a CDAD kialakulásához. A C. difficile hypertoxint termelő törzsei fokozott morbiditást és mortalitást okoznak, mivel ezek a fertőzések rezisztensek lehetnek az antimikrobiális terápiára, és kolektómiát igényelhetnek. A CDAD-t minden olyan betegnél figyelembe kell venni, aki az antibiotikum alkalmazását követően hasmenést szenved. Gondos kórelőzményre van szükség, mivel a CDAD-ről az antibakteriális szerek alkalmazását követő két hónapon belül számoltak be.
ha CDAD gyanúja merül fel, vagy megerősítést nyer, a C. difficile elleni folyamatos antibiotikum-kezelést abba kell hagyni. Megfelelő folyadék-és elektrolitkezelés, proteinpótlás, C. difficile antibiotikum-kezelés, és a klinikai indikációk szerint sebészeti vizsgálat szükséges.
óvintézkedések
Általános
a Duricef-et óvatosan kell alkalmazni jelentősen károsodott vesefunkció esetén (kreatinin-clearance aránya kevesebb, mint 50 mL/perc/1, 73 M2). (Lásd adagolás és alkalmazás.) Ismert vagy feltételezett vesekárosodásban szenvedő betegeknél a kezelés előtt és alatt gondos klinikai megfigyelést és megfelelő laboratóriumi vizsgálatokat kell végezni.
A Duricef felírása bizonyított vagy erősen gyanítható bakteriális fertőzés vagy profilaktikus indikáció hiányában nem valószínű, hogy előnyös lenne a beteg számára, és növeli a gyógyszerrezisztens baktériumok kialakulásának kockázatát.
A Duricef hosszantartó alkalmazása a nem fogható organizmusok túlnövekedését eredményezheti. A beteg gondos megfigyelése elengedhetetlen. Ha a terápia során szuperinfekció lép fel, megfelelő intézkedéseket kell tenni.
A Duricef-et óvatosan kell előírni olyan betegeknél, akiknek kórtörténetében gastrointestinalis betegség, különösen colitis szerepel.
a betegeknek azt kell tanácsolni, hogy a Duricef-et tartalmazó antibakteriális gyógyszereket csak bakteriális fertőzések kezelésére szabad alkalmazni. Nem kezelik a vírusfertőzéseket (például a közönséges hideget). Amikor a Duricef-et bakteriális fertőzés kezelésére írják fel, a betegeknek azt kell mondani, hogy bár a terápia korai szakaszában általában jobban érzik magukat, a gyógyszert pontosan az utasításoknak megfelelően kell bevenni. Az adagok kihagyása vagy a teljes terápia befejezése (1) csökkentheti az azonnali kezelés hatékonyságát, és (2) növelheti annak valószínűségét, hogy a baktériumok rezisztenciát alakítanak ki, és a Duricef vagy más antibakteriális gyógyszerek a jövőben nem kezelhetők.
a hasmenés az antibiotikumok által okozott gyakori probléma, amely általában az antibiotikum abbahagyásakor ér véget. Néha az antibiotikum-kezelés megkezdése után a betegek vizes és véres széklet alakulhatnak ki (gyomorgörcsökkel vagy lázzal vagy anélkül), akár két vagy több hónappal az antibiotikum utolsó adagjának bevétele után. Ha ez bekövetkezik, a betegeknek a lehető leghamarabb kapcsolatba kell lépniük orvosukkal.
gyógyszer/laboratóriumi vizsgálati interakciók
pozitív közvetlen Coombs-tesztekről számoltak be a cefalosporin antibiotikumokkal végzett kezelés során. Hematológiai vizsgálatokban vagy transzfúziós keresztmegfelelő eljárásokban, amikor az antiglobulin teszteket kisebb oldalon vagy a Coombs újszülöttjeinek tesztelésében végzik, akiknek anyái a szülés előtt cefalosporin antibiotikumokat kaptak, fel kell ismerni, hogy a pozitív Coombs-teszt a gyógyszernek tudható be.
karcinogenezis, Mutagenesis és a fertilitás károsodása
karcinogenezis, karcinogén potenciál meghatározására nem végeztek hosszú távú vizsgálatokat. Genetikai toxicitási vizsgálatokat nem végeztek.
terhesség: B terhességi kategória
reprodukciós vizsgálatokat végeztek egereken és patkányokon a humán dózis 11-szereséig terjedő adagok mellett, és nem mutattak ki bizonyítékot a cefadroxil-monohidrát okozta fertilitásra vagy a magzatra gyakorolt káros hatásra. Terhes nőkön azonban nem végeztek megfelelő és jól kontrollált vizsgálatokat. Mivel az állatok reprodukciós vizsgálata nem mindig prediktív az emberi válaszra, ezt a gyógyszert terhesség alatt csak akkor szabad alkalmazni, ha egyértelműen szükséges.
Labor and Delivery
a Duricef-et nem vizsgálták a szülés és a szülés során történő alkalmazásra. A kezelést csak akkor szabad alkalmazni, ha egyértelműen szükséges.
szoptató anyák
óvatosan kell eljárni, ha a cefadroxil-monohidrátot szoptató anyáknak adják.
gyermekgyógyászati alkalmazás
(lásd adagolás és alkalmazás.)
geriátriai alkalmazás
körülbelül 650, húgyúti fertőzések kezelésére cefadroxilt kapó beteg közül három klinikai vizsgálatban 28% 60 éves és idősebb volt, míg 16% 70 éves és idősebb. A 14 klinikai vizsgálatban a bőr-és bőrszerkezeti fertőzés kezelésére cefadroxilt kapó mintegy 1000 beteg közül 12% – uk 60 éves vagy annál idősebb, míg 4% – uk 70 éves vagy annál idősebb volt. Ezekben a vizsgálatokban nem figyeltek meg általános biztonságossági különbségeket az idős betegek és a fiatalabb betegek között. A cefadroxil pharyngitis vagy tonsillitis kezelésére vonatkozó klinikai vizsgálatok nem tartalmaztak elegendő számú 65 éves vagy annál idősebb beteget annak meghatározására, hogy a fiatalabb betegektől eltérően reagálnak-e. A cefadroxillal kapcsolatos egyéb jelentett klinikai tapasztalatok nem mutattak ki különbségeket az idősek és a fiatalabb betegek válaszai között, de egyes idősebb személyek nagyobb érzékenysége nem zárható ki.
a Cefadroxil lényegében a vesén keresztül választódik ki, és az adagolás módosítása vesekárosodásban szenvedő betegek esetében javasolt (lásd adagolás és alkalmazás: vesekárosodás). Mivel az idős betegek nagyobb valószínűséggel csökkent vesefunkcióval rendelkeznek, ügyelni kell az adag kiválasztására, és hasznos lehet a vesefunkció monitorozása.
mellékhatások
gastrointestinalis
a pseudomembranosus colitis tünetei az antibiotikumos kezelés alatt vagy után jelentkezhetnek (lásd a figyelmeztetéseket). Ritkán dyspepsiát, hányingert és hányást jelentettek. Hasmenés is történt.
túlérzékenység
allergiát (kiütés, urticaria, angioödéma és pruritus formájában) figyeltek meg. Ezek a reakciók általában a gyógyszer abbahagyásakor csökkentek. Anafilaxiát is jelentettek.
Egyéb
Egyéb reakciók tartalmazza májműködési zavar, beleértve a cholestasis, illetve akiknél a szérum transzamináz, nemi viszketés, nemi moniliasis, hüvelygyulladás, mérsékelt átmeneti neutropenia, láz. Ritkán agranulocytosisról, thrombocytopeniáról, idioszinkratikus májelégtelenségről, erythema multiforme-ról, Stevens-Johnson szindrómáról, szérumbetegségről és arthralgiáról számoltak be.
a fent felsorolt, cefadroxillal kezelt betegeknél megfigyelt mellékhatások mellett a cefalosporin-osztályú antibiotikumokkal kapcsolatban a következő mellékhatásokról és megváltozott laboratóriumi vizsgálatokról számoltak be:
toxikus epidermális nekrolízis, hasi fájdalom, felülfertőzés, veseműködési zavar, toxikus nephropathia, aplasztikus anaemia, hemolitikus anémia, vérzés, elhúzódó protrombin idő, pozitív Coombs-teszt, fokozott BUN, emelkedett kreatininszint, emelkedett alkalikus foszfatáz, emelkedett aszpartát-aminotranszferáz (AST), emelkedett alanin-aminotranszferáz (ALT), emelkedett bilirubinszint, emelkedett LDH, eosinophilia, pancytopenia, neutropenia.
Több cefalosporin is szerepet játszott görcsrohamok kiváltásában, különösen vesekárosodásban szenvedő betegeknél, amikor az adag nem csökkent (lásd az adagot, az adagolást és a túladagolást). Ha a gyógyszeres terápiával kapcsolatos rohamok fordulnak elő, a gyógyszert fel kell függeszteni. Antikonvulzív terápia adható, ha klinikailag indokolt.
Túladagolás
A tanulmány a gyermekek hat éven aluli azt javasolta, hogy a bevétel kevesebb, mint 250 mg/kg cefalosporinok nem jár jelentős eredményeket. Az Általános támogatáson és megfigyeléseken kívül más intézkedésre nincs szükség. A 250 mg/kg-nál nagyobb mennyiségben gyomorürülést okoz.
öt anurikus betegnél kimutatták, hogy az 1 g orális adag átlagosan 63% – át kivonják a testből egy 6-8 órás hemodialízis során.
Duricef Adagolás és alkalmazás
a Duricef sav-stabil, és szájon át, étkezéstől függetlenül alkalmazható. Az étellel történő alkalmazás hasznos lehet az orális cefalosporin-terápiával kapcsolatos esetleges gastrointestinalis panaszok csökkentésében.
felnőttek
húgyúti fertőzések: Szövődménymentes alsó húgyúti fertőzések (azaz cystitis) esetén a szokásos adag napi 1 vagy 2 g egyetlen (Q.d.) vagy osztott dózisban (b.I.d.).
minden egyéb húgyúti fertőzés esetén a szokásos adag napi 2 g osztott dózisban (b. I. d.).
bőr-és Bőrszerkezeti fertőzések: bőr-és bőrszerkezeti fertőzések esetén a szokásos adag napi 1 g egyszeri (Q.d.) vagy osztott adagban (b.I.d.).
Pharyngitis és Tonsillitis: béta-hemolitikus streptococcus pharyngitis és tonsillitis kezelése-napi 1 g egyszeri (Q.d.) vagy osztott dózisban (b.I.d.) 10 napig.
gyermekek
húgyúti fertőzések esetén a gyermekek ajánlott napi adagja 30 mg/kg/nap, 12 óránként osztott adagokban. Torokgyulladás, mandulagyulladás, impetigo ajánlott napi dózis a gyermekek számára 30 mg / kg / nap egy adagban, vagy egyenlő arányban osztott dózisban 12 óránként. Más bőr-és bőrszerkezeti fertőzések esetén az ajánlott napi adag 30 mg/ttkg/nap egyenlő adagban, 12 óránként. A béta-hemolitikus streptococcus fertőzések kezelésében a Duricef terápiás dózisát legalább 10 napig kell beadni.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8 + | — | 2 tk |
vesekárosodás
vesekárosodásban szenvedő betegeknél a cefadroxil-monohidrát adagját a kreatinin-clearance aránynak megfelelően kell beállítani a gyógyszer akkumulációjának megelőzése érdekében. A következő ütemezés javasolt. Felnőtteknél a kezdeti dózis 1000 mg Duricef, a fenntartó dózis (a kreatinin-clearance arány alapján) 500 mg az alább felsorolt időközönként.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients 50 mL/perc feletti kreatinin-clearance-szel úgy kezelhetők, mintha normális vesefunkciójú betegek lennének.
| Üveg Mérete | Feloldás Irányban |
| 100 mL |
Felfüggeszti, összesen 67 mL vizet. módszer: enyhén érintse meg a palackot a por lazításához. adjunk hozzá 67 mL vizet két részletben. minden hozzáadás után jól rázza fel. |
| 75 mL |
összesen 51 mL vízben. módszer: enyhén érintse meg a palackot a por lazításához. adjunk hozzá 51 mL vizet két részletben. minden hozzáadás után jól rázza fel. |
| 50 mL |
összesen 34 mL vízben. módszer: enyhén érintse meg a palackot a por lazításához. adjunk hozzá 34 mL vizet két részletben. minden hozzáadás után jól rázza fel. |
|
feloldás után hűtőszekrényben tárolandó. Használat előtt alaposan rázza fel. a tartály szorosan lezárva tartandó. 14 nap elteltével dobja ki a fel nem használt adagot. |
|
hogyan szállítják a Duricef-et
Duricef® (cefadroxil-monohidrát, USP) 500 mg kapszula: átlátszatlan, gesztenyebarna-és fehér kemény zselatin kapszula, egyik végén “PPP” és “784” felirattal és a másik végén “Duricef” és “500 mg”.
A kapszulák a következők szerint kerülnek forgalomba:
N 0430-0780-19 palack 50
tárolandó ellenőrzött szobahőmérsékleten 15°-30° C (59°-86° F).
Duricef® 1 grammos tabletta: fehér vagy törtfehér, felső feleződött, ovális alakú, a metszet egyik oldalán “PPP”, a másik oldalán “785” felirattal. A tabletták a következők szerint kerülnek forgalomba:
N 0430-0781-19 palack 50
tárolandó ellenőrzött szobahőmérsékleten 15°-30° C (59°-86° F).
A Duricef® belsőleges szuszpenzióhoz narancs-ananász ízű, és az alábbiak szerint kerül forgalomba:
250 mg/5 mL N 0430-2782-15 50 mL-es üveg
N 0430-2782-17 100 mL-es üveg
500 mg/5 mL N 0430-2783-16 75 mL-es üveg
N 0430-2783-17 100 mL-es üveg
feloldás előtt tárolandó szabályozott szobahőmérséklet 15°-30° C (59°-86° F).
1. Nemzeti Bizottság klinikai laboratóriumi szabványok, jóváhagyott szabvány, teljesítmény szabványok antimikrobiális lemez érzékenységi teszt, 4. kiadás, Vol. 10 (7): M2-A4, Villanova, PA, április, 1990.
2. Nemzeti klinikai laboratóriumi szabványok Bizottsága, jóváhagyott szabvány: Hígítási módszerek antimikrobiális érzékenységi tesztek a baktériumok számára, amelyek Aerobikusan nőnek, 2. kiadás, Vol. 10 (8): M7-A2, Villanova, PA, április, 1990.
gyártó: Bristol-Myers Squibb Co.
Princeton, NJ 08543
a Warner Chilcott Company, Inc.
Fajardo, PR 00738
a Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: első generációs cefalosporinok
a Fogyasztói források
- Speciális Olvasási
Szakmai források
- Felírása Információk
- Cefadroxil Belsőleges Szuszpenzió (FDA)
Kapcsolódó kezelési útmutatók
- Bakteriális Szívbelhártya-gyulladás Megelőzésére
- Bőr Szerkezet Fertőzés
- Impetigo
- Vese Fertőzések
- … + 4 további
orvosi nyilatkozat
Leave a Reply