Duricef
Nombre genérico: cefadroxilo
Forma de dosificación: polvo para suspensión
Revisado médicamente por Drugs.com. Última actualización: 21 de abril de 2020.
- Descripción General
- Efectos secundarios
- Dosis
- Profesional
- Interacciones
- Más
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de Duricef® y otros medicamentos antibacterianos, Duricef debe usarse solo para tratar o prevenir infecciones que se haya demostrado o se sospeche que son causadas por bacterias.
Duricef Descripción
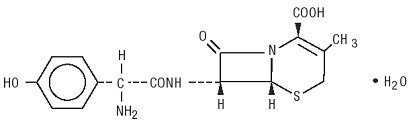
Duricef es un antibiótico semisintético de cefalosporina destinado a la administración oral. Es un polvo cristalino de color blanco a blanco amarillento. Es soluble en agua y es estable a los ácidos. Se designa químicamente como ácido 5-Tia-1-azabiciclooct-2-eno-2-carboxílico, 7-amino]-3-metil-8-oxo -, monohidrato] -. Tiene la fórmula C16H17N3O5S * H2O y el peso molecular de 381,40. Tiene la siguiente fórmula estructural:
Los comprimidos recubiertos con película Duricef, 1 g, contienen los siguientes ingredientes inactivos: celulosa microcristalina, hidroxipropilmetilcelulosa, estearato de magnesio, polietilenglicol, polisorbato 80, emulsión de simeticona y dióxido de titanio.
Duricef para Suspensión Oral contiene los siguientes ingredientes inactivos: FD&C Amarillo n ° 6, sabores naturales y artificiales), polisorbato 80, benzoato de sodio, sacarosa, goma xantana.
Duricef cápsulas contienen los siguientes ingredientes inactivos: D&C Rojo Nº 28, FD&C Azul n ° 1, FD&C Rojo Nº 40, gelatina, estearato de magnesio y dióxido de titanio.
Duricef-Farmacología clínica
Duricef se absorbe rápidamente tras la administración oral. Tras dosis únicas de 500 mg y 1000 mg, las concentraciones séricas máximas medias fueron de aproximadamente 16 y 28 µg/ml, respectivamente. Los niveles medibles estuvieron presentes 12 horas después de la administración. Más del 90% del medicamento se excreta sin cambios en la orina dentro de las 24 horas. Las concentraciones máximas en orina son de aproximadamente 1800 µg / ml durante el período posterior a una dosis oral única de 500 mg. Los aumentos en la dosis generalmente producen un aumento proporcional en la concentración urinaria de Duricef (monohidrato de cefadroxilo, USP). La concentración de antibióticos en orina, tras una dosis de 1 g, se mantuvo muy por encima de la CMI de patógenos urinarios susceptibles durante 20 a 22 horas.
Microbiología
Las pruebas in vitro demuestran que las cefalosporinas son bactericidas debido a su inhibición de la síntesis de la pared celular. Se ha demostrado que el cefadroxilo es activo contra los siguientes organismos tanto in vitro como en infecciones clínicas (ver INDICACIONES Y USO):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. No tiene actividad contra especies de Pseudomonas y Acinetobacter calcoaceticus (anteriormente especies de Mima y Herellea).
Pruebas de susceptibilidad: Técnicas de difusión
El uso de métodos de prueba de susceptibilidad de disco antibiótico que miden el diámetro de la zona proporciona una estimación precisa de la susceptibilidad a los antibióticos. Uno de estos procedimientos normales1, que se ha recomendado para su uso con discos para probar la susceptibilidad de los organismos al cefadroxilo, utiliza el disco de la clase de cefalosporina (cefalotina). La interpretación implica la correlación de los diámetros obtenidos en la prueba de disco con la concentración inhibitoria mínima (CMI) para el cefadroxilo.
Los informes del laboratorio que dan los resultados de la prueba estándar de sensibilidad a un solo disco con un disco de cefalotina de 30 µg deben interpretarse de acuerdo con los siguientes criterios:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of «Susceptible» indica que es probable que el patógeno se inhiba por los niveles sanguíneos generalmente alcanzables. Un informe de» susceptibilidad intermedia » sugiere que el organismo sería susceptible si se usan dosis altas o si la infección se limita a tejidos y fluidos (por ejemplo, orina) en los que se alcanzan altos niveles de antibióticos. Un informe de «Resistente» indica que es poco probable que las concentraciones alcanzables del antibiótico sean inhibitorias y se debe seleccionar otro tratamiento.
Los procedimientos estandarizados requieren el uso de organismos de control de laboratorio. El disco de cefalotina de 30 µg debe dar los siguientes diámetros de zona:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution método (incluida la microdilución) 2 o equivalente, un aislado bacteriano puede considerarse sensible si el valor de CMI (concentración inhibitoria mínima) para cefalotina es igual o inferior a 8 µg/ml. Los organismos se consideran resistentes si la CIM es de 32 µg / mL o superior. Los organismos con un valor de CMI inferior a 32 µg/ml pero superior a 8 µg/ml son intermedios.
Al igual que con los métodos de difusión estándar, los procedimientos de dilución requieren el uso de organismos de control de laboratorio. El polvo de cefalotina estándar debe dar valores de CMI en el rango de 0,12 µg/mL y 0,5 µg / mL para Staphylococcus aureus ATCC 29213. Para Escherichia coli ATCC 25922, el rango de CMI debe estar entre 4,0 µg/mL y 16,0 µg / mL. Para Streptococcus faecalis ATCC 29212, el rango de CMI debe estar entre 8,0 y 32,0 µg/mL.
Indicaciones y uso de Duricef
Duricef está indicado para el tratamiento de pacientes con infecciones causadas por cepas susceptibles de los organismos designados en las siguientes enfermedades:
Infecciones del tracto urinario causadas por especies de E. coli, P. mirabilis y Klebsiella.
Infecciones de la piel y de la estructura de la piel causadas por estafilococos y/o estreptococos.
Faringitis y / o amigdalitis causadas por estreptococos piógenos (estreptococos beta-hemolíticos del Grupo A).
Nota: Solo se ha demostrado que la penicilina por vía intramuscular es eficaz en la profilaxis de la fiebre reumática. Duricef es generalmente eficaz en la erradicación de estreptococos de la orofaringe. Sin embargo, no se dispone de datos que establezcan la eficacia de Duricef para la profilaxis de la fiebre reumática posterior.
Nota: Se deben iniciar pruebas de cultivo y sensibilidad antes y durante el tratamiento. Se deben realizar estudios de la función renal cuando esté indicado.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de Duricef y otros medicamentos antibacterianos, Duricef debe usarse solo para tratar o prevenir infecciones que se haya demostrado o se sospeche que son causadas por bacterias susceptibles. Cuando se disponga de información sobre cultivos y susceptibilidad, se deben tener en cuenta al seleccionar o modificar el tratamiento antibacteriano. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica del tratamiento.
Contraindicaciones
Duricef está contraindicado en pacientes con alergia conocida al grupo de antibióticos cefalosporinas.
Advertencias
ANTES DE INICIAR EL TRATAMIENTO CON Duricef, SE DEBE REALIZAR UNA INVESTIGACIÓN CUIDADOSA PARA DETERMINAR SI EL PACIENTE HA TENIDO REACCIONES DE HIPERSENSIBILIDAD PREVIAS A CEFADROXILO, CEFALOSPORINAS, PENICILINAS U OTROS MEDICAMENTOS. SI SE VA A ADMINISTRAR ESTE PRODUCTO A PACIENTES SENSIBLES A LA PENICILINA, SE DEBE TENER PRECAUCIÓN PORQUE LA SENSIBILIDAD CRUZADA ENTRE LOS ANTIBIÓTICOS BETALACTÁMICOS HA SIDO CLARAMENTE DOCUMENTADA Y PUEDE OCURRIR EN HASTA EL 10% DE LOS PACIENTES CON ANTECEDENTES DE ALERGIA A LA PENICILINA.
SI SE PRODUCE UNA REACCIÓN ALÉRGICA AL Duricef, SUSPENDA EL MEDICAMENTO. LAS REACCIONES DE HIPERSENSIBILIDAD AGUDA GRAVES PUEDEN REQUERIR TRATAMIENTO CON EPINEFRINA Y OTRAS MEDIDAS DE EMERGENCIA, COMO OXÍGENO, LÍQUIDOS INTRAVENOSOS, ANTIHISTAMÍNICOS INTRAVENOSOS, CORTICOSTEROIDES, AMINAS PRESORAS Y TRATAMIENTO DE LAS VÍAS RESPIRATORIAS, SEGÚN ESTÉ CLÍNICAMENTE INDICADO.
Se ha informado de diarrea asociada a Clostridium difficile (DACD) con el uso de casi todos los agentes antibacterianos, incluido el Duricef, y su gravedad puede variar desde diarrea leve hasta colitis mortal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que provoca un crecimiento excesivo de C. difficile.
C. difficile produce las toxinas A y B que contribuyen al desarrollo de la DACD. Las cepas productoras de hipertoxina de C. difficile causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antimicrobiana y pueden requerir colectomía. La DACD se debe considerar en todos los pacientes que presentan diarrea después del uso de antibióticos. Historia clínica cuidadosa es necesaria ya que CDAD se producen más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o confirma la DAVD, es posible que deba interrumpirse el uso continuo de antibióticos no dirigidos contra C. difficile. Se debe instaurar un tratamiento adecuado de líquidos y electrolitos, suplementación de proteínas, tratamiento antibiótico de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
Precauciones
General
Duricef debe utilizarse con precaución en presencia de una función renal marcadamente deteriorada (tasa de aclaramiento de creatinina inferior a 50 ml/min / 1,73 M2). (Ver DOSIFICACIÓN Y ADMINISTRACIÓN.) En pacientes con insuficiencia renal conocida o sospechada, se debe realizar una observación clínica cuidadosa y estudios de laboratorio apropiados antes y durante el tratamiento.
La prescripción de Duricef en ausencia de una infección bacteriana probada o fuertemente sospechada o de una indicación profiláctica es poco probable que proporcione beneficio al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
El uso prolongado de Duricef puede resultar en el crecimiento excesivo de organismos no absorbibles. La observación cuidadosa del paciente es esencial. Si se produce una sobreinfección durante el tratamiento, se deben tomar las medidas adecuadas.
Duricef debe recetarse con precaución en personas con antecedentes de enfermedad gastrointestinal, en particular colitis.
Información para pacientes
Se debe aconsejar a los pacientes que los medicamentos antibacterianos, incluido Duricef, solo se deben usar para tratar infecciones bacterianas. No tratan infecciones virales (por ejemplo, el resfriado común). Cuando se prescribe Duricef para tratar una infección bacteriana, se debe decir a los pacientes que, aunque es común sentirse mejor al principio del tratamiento, el medicamento debe tomarse exactamente como se indica. Omitir dosis o no completar el ciclo completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con Duricef u otros medicamentos antibacterianos en el futuro.
La diarrea es un problema común causado por los antibióticos que generalmente termina cuando se suspende el antibiótico. A veces, después de comenzar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres estomacales y fiebre) incluso dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben ponerse en contacto con su médico lo antes posible.
Interacciones entre medicamentos y Pruebas de laboratorio
Se han notificado pruebas positivas de Coombs directos durante el tratamiento con antibióticos de cefalosporina. En estudios hematológicos o en procedimientos de emparejamiento cruzado de transfusiones cuando se realizan pruebas de antiglobulina en el lado menor o en pruebas de Coombs de recién nacidos cuyas madres han recibido antibióticos de cefalosporina antes del parto, se debe reconocer que una prueba de Coombs positiva puede deberse al medicamento.
Carcinogénesis, Mutagénesis y Alteración de la fertilidad
No se han realizado estudios a largo plazo para determinar el potencial carcinogénico. No se han realizado pruebas de toxicidad genética.
Embarazo: Se han realizado estudios de reproducción de categoría B
durante el embarazo en ratones y ratas a dosis de hasta 11 veces la dosis humana y no se han revelado indicios de alteración de la fertilidad o daño al feto debido al monohidrato de cefadroxilo. Sin embargo, no hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción animal no siempre predicen la respuesta humana, este medicamento debe usarse durante el embarazo solo si es claramente necesario.
Trabajo de parto
Duricef no se ha estudiado para su uso durante el trabajo de parto y el parto. El tratamiento sólo debe administrarse si es claramente necesario.
Madres lactantes
Se debe tener precaución cuando se administre cefadroxilo monohidrato a una madre lactante.
Uso pediátrico
( Ver DOSIS Y ADMINISTRACIÓN.)
Uso geriátrico
De aproximadamente 650 pacientes que recibieron cefadroxilo para el tratamiento de infecciones del tracto urinario en tres ensayos clínicos, el 28% tenían 60 años o más, mientras que el 16% tenían 70 años o más. De aproximadamente 1000 pacientes que recibieron cefadroxilo para el tratamiento de infecciones de la piel y de la estructura de la piel en 14 ensayos clínicos, el 12% tenían 60 años o más, mientras que el 4% tenían 70 años o más. No se observaron diferencias generales en la seguridad entre los pacientes de edad avanzada en estos estudios y los pacientes más jóvenes. Los estudios clínicos de cefadroxilo para el tratamiento de la faringitis o amigdalitis no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. Otras experiencias clínicas notificadas con cefadroxilo no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos de edad avanzada.
Cefadroxilo se excreta sustancialmente por el riñón, y el ajuste de dosis está indicado en pacientes con insuficiencia renal (ver DOSIS Y ADMINISTRACIÓN: Insuficiencia renal). Debido a que los pacientes de edad avanzada tienen más probabilidades de tener una función renal disminuida, se debe tener cuidado en la selección de la dosis, y puede ser útil monitorizar la función renal.
Reacciones adversas
Gastrointestinales
Pueden aparecer síntomas de colitis seudomembranosa durante o después del tratamiento con antibióticos (ver ADVERTENCIAS). Se han notificado casos raros de dispepsia, náuseas y vómitos. También se ha producido diarrea.
Hipersensibilidad
Se han observado alergias (en forma de erupción cutánea, urticaria, angioedema y prurito). Estas reacciones generalmente disminuyeron al interrumpir el medicamento. También se ha notificado anafilaxia.
Otras
Otras reacciones han incluido disfunción hepática incluyendo colestasis y elevación de las transaminasas séricas, prurito genital, moniliasis genital, vaginitis, neutropenia transitoria moderada, fiebre. En raras ocasiones se han notificado agranulocitosis, trombocitopenia, insuficiencia hepática idiosincrásica, eritema multiforme, síndrome de Stevens-Johnson, enfermedad del suero y artralgia.
Además de las reacciones adversas enumeradas anteriormente que se han observado en pacientes tratados con cefadroxilo, se han notificado las siguientes reacciones adversas y alteraciones de las pruebas de laboratorio para antibióticos de la clase de las cefalosporinas:
Necrólisis epidérmica tóxica, dolor abdominal, sobreinfección, disfunción renal, nefropatía tóxica, anemia aplásica, anemia hemolítica, hemorragia, tiempo prolongado de protrombina, prueba de Coombs positiva, aumento de BUN, aumento de creatinina, aumento de fosfatasa alcalina, aumento de aspartato aminotransferasa (AST), aumento de alanina aminotransferasa (ALT), aumento de bilirrubina, aumento de LDH, eosinofilia, pancitopenia, neutropenia.
Se han implicado varias cefalosporinas en el desencadenamiento de convulsiones, especialmente en pacientes con insuficiencia renal, cuando la dosis no se redujo (ver DOSIFICACIÓN y ADMINISTRACIÓN y SOBREDOSIFICACIÓN). Si se producen convulsiones asociadas con la terapia farmacológica, se debe suspender el medicamento. Se puede administrar terapia anticonvulsiva si está clínicamente indicado.
Sobredosis
Un estudio con niños menores de seis años de edad sugirió que la ingestión de menos de 250 mg / kg de cefalosporinas no se asocia con resultados significativos. No se requiere otra acción que el apoyo general y la observación. Para cantidades superiores a 250 mg/kg, induzca el vaciado gástrico.
En cinco pacientes anúricos, se demostró que un promedio del 63% de una dosis oral de 1 g se extrae del cuerpo durante una sesión de hemodiálisis de 6-8 horas.
Dosis y administración de Duricef
Duricef es estable a los ácidos y se puede administrar por vía oral sin tener en cuenta las comidas. La administración con alimentos puede ser útil para disminuir las posibles molestias gastrointestinales asociadas ocasionalmente al tratamiento con cefalosporinas orales.
Adultos
Infecciones del Tracto urinario: Para infecciones del tracto urinario inferior sin complicaciones (es decir, cistitis), la dosis habitual es de 1 o 2 g al día en una dosis única (una vez al día) o dividida (dos veces al día).
Para todas las demás infecciones del tracto urinario, la dosis habitual es de 2 g al día en dosis divididas (dos veces al día).
Infecciones de la piel y de la estructura de la piel: Para infecciones de la piel y de la estructura de la piel, la dosis habitual es de 1 g al día en dosis únicas (una vez al día) o divididas (dos veces al día).
Faringitis y Amigdalitis: Tratamiento de faringitis estreptocócica beta-hemolítica del grupo A y amigdalitis-1 g al día en dosis únicas (una vez al día) o divididas (dos veces al día) durante 10 días.
Niños
Para infecciones del tracto urinario, la dosis diaria recomendada para niños es de 30 mg/kg/día en dosis divididas cada 12 horas. Para faringitis, amigdalitis e impétigo, la dosis diaria recomendada para niños es de 30 mg/kg/día en una sola dosis o en dosis divididas en partes iguales cada 12 horas. Para otras infecciones de la piel y de la estructura de la piel, la dosis diaria recomendada es de 30 mg/kg/día en dosis divididas a partes iguales cada 12 horas. En el tratamiento de infecciones estreptocócicas beta-hemolíticas, se debe administrar una dosis terapéutica de Duricef durante al menos 10 días.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | 2 cucharadita | |
insuficiencia Renal
En pacientes con insuficiencia renal, la dosis de cefadroxilo monohidrato debe ajustarse según el aclaramiento de creatinina tasas para evitar la acumulación del fármaco. Se sugiere el siguiente calendario. En adultos, la dosis inicial es de 1000 mg de Duricef y la dosis de mantenimiento (basada en la tasa de aclaramiento de creatinina ) es de 500 mg en los intervalos de tiempo indicados a continuación.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients con tasas de aclaramiento de creatinina superiores a 50 ml/min pueden tratarse como si se tratase de pacientes con función renal normal.
| Tamaño de la Botella | Reconstitución de las Direcciones |
| 100 mL |
Suspender en un total de 67 mL de agua. Método: Golpee ligeramente la botella para aflojar el polvo. Añadir 67 mL de agua en dos porciones. Agitar bien después de cada adición. |
| 75 mL |
Suspender en un total de 51 mL de agua. Método: Golpee ligeramente la botella para aflojar el polvo. Añadir 51 mL de agua en dos porciones. Agitar bien después de cada adición. |
| 50 mL |
Suspender en un total de 34 mL de agua. Método: Golpee ligeramente la botella para aflojar el polvo. Añadir 34 mL de agua en dos porciones. Agitar bien después de cada adición. |
|
Después de la reconstitución, conservar en nevera. Agitar bien antes de usar. Mantener el envase perfectamente cerrado. Deseche la porción no utilizada después de 14 días. |
|
Cómo se suministra Duricef
Duricef® (monohidrato de cefadroxilo, USP) Cápsulas de 500 mg: cápsulas de gelatina dura opacas, granate y blancas, impresas con «PPP» y «784» en una final y con «Duricef» y «500 mg» en el otro extremo.
Las cápsulas se suministran de la siguiente manera:
N 0430-0780-19 Frasco de 50
Conservar a temperatura ambiente controlada de 15°-30° C (59°-86° F).
Duricef® 1 g Comprimidos: blanco a blanco, parte superior atravesada, ovalados, marcados con «PPP» en un lado de la bisecar y «785» en el otro lado de la bisecar. Los comprimidos se suministran de la siguiente manera:
N 0430-0781-19 Frasco de 50
Conservar a temperatura ambiente controlada de 15°-30° C (59°-86° F).
Duricef® para Suspensión oral tiene sabor a naranja y piña y se suministra de la siguiente manera:
250 mg/5 ml N 0430-2782-15 Frasco de 50 mL
N 0430-2782-17 Frasco de 100 mL
500 mg/5 mL N 0430-2783-16 Frasco de 75 mL
N 0430-2783-17 Frasco de 100 mL
Antes de la reconstitución: Conservar en temperatura ambiente controlada 15°-30° C (59°-86° F).
1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk Susceptibility Test, 4a Edición, Vol. 10 (7): M2-A4, Villanova, PA, abril de 1990.
2. Comité Nacional de Normas de Laboratorio Clínico, Norma Aprobada: Métodos para Pruebas de Sensibilidad Antimicrobiana de Dilución para Bacterias que Crecen Aeróbicamente, 2a Edición, Vol. 10 (8): M7-A2, Villanova, PA, abril de 1990.Fabricado por Bristol-Myers Squibb Co.Princeton, NJ 08543
Para Warner Chilcott Company, Inc.
Fajardo, PR 00738
Comercializado por Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: cefalosporinas de primera generación
Recursos para el consumidor
- Lectura avanzada
Recursos profesionales
- Información de prescripción
- Suspensión Oral de Cefadroxilo (FDA)
Guías de tratamiento relacionadas
- Prevención de Endocarditis bacteriana
- Infección de la piel y la estructura
- Impétigo
- Infecciones renales
- … + 4 más
Descargo de responsabilidad médico
Leave a Reply