Duricef
Nom générique: cefadroxil
Forme posologique: poudre, pour suspension
Revue médicale par Drugs.com . Dernière mise à jour le 21 avril 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l’efficacité de Duricef® et d’autres médicaments antibactériens, Duricef doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté d’être causées par des bactéries.
Duricef Description
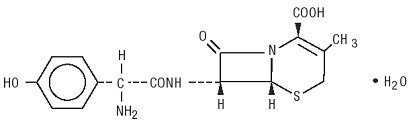
Duricef est un antibiotique céphalosporine semi-synthétique destiné à l’administration orale. C’est une poudre cristalline blanche à blanc jaunâtre. Il est soluble dans l’eau et stable à l’acide. Il est chimiquement désigné comme acide 5-Thia-1-azabicyclooct-2-e-2-carboxylique, 7-amino]-3-méthyl-8-oxo-, monohydraté]-. Il a la formule C16H17N3O5S * H2O et le poids moléculaire de 381,40. Il a la formule structurelle suivante:
Les comprimés pelliculés de Duricef, 1 g, contiennent les ingrédients inactifs suivants: cellulose microcristalline, hydroxypropylméthylcellulose, stéarate de magnésium, polyéthylène glycol, polysorbate 80, émulsion de siméthicone et dioxyde de titane.
Duricef pour suspension buvable contient les ingrédients inactifs suivants: FD &C Jaune No 6, arômes (naturels et artificiels), polysorbate 80, benzoate de sodium, saccharose et gomme xanthane.
Les capsules de Duricef contiennent les ingrédients inactifs suivants: D &C Red No. 28, FD &C Blue No. 1, FD &C Red No. 40, gélatine, stéarate de magnésium et dioxyde de titane.
Duricef – Pharmacologie clinique
Duricef est rapidement absorbé après administration orale. Après des doses uniques de 500 mg et 1000 mg, les concentrations sériques maximales moyennes étaient d’environ 16 et 28 µg/mL, respectivement. Des niveaux mesurables étaient présents 12 heures après l’administration. Plus de 90% du médicament est excrété sous forme inchangée dans l’urine dans les 24 heures. Les concentrations urinaires maximales sont d’environ 1800 µg/ mL pendant la période suivant une dose orale unique de 500 mg. L’augmentation de la posologie entraîne généralement une augmentation proportionnelle de la concentration urinaire de Duricef (cefadroxil monohydraté, USP). La concentration d’antibiotiques dans l’urine, après une dose de 1 g, a été maintenue bien au-dessus de la CMI des agents pathogènes urinaires sensibles pendant 20 à 22 heures.
Microbiologie
Des tests in vitro démontrent que les céphalosporines sont bactéricides en raison de leur inhibition de la synthèse de la paroi cellulaire. Il a été démontré que le cefadroxil est actif contre les organismes suivants à la fois in vitro et dans les infections cliniques (voir INDICATIONS ET UTILISATION):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Il n’a aucune activité contre les espèces Pseudomonas et Acinetobacter calcoaceticus (anciennement espèces Mima et Herellea).
Tests de sensibilité:Techniques de diffusion
L’utilisation de méthodes de test de sensibilité aux disques antibiotiques qui mesurent le diamètre de la zone donne une estimation précise de la sensibilité aux antibiotiques. Une de ces procédures normales1 qui a été recommandée pour une utilisation avec des disques pour tester la sensibilité des organismes au céfadroxil utilise le disque de la classe des céphalosporines (céphalothines). L’interprétation implique la corrélation des diamètres obtenus dans le test de disque avec la concentration inhibitrice minimale (CMI) pour le cefadroxil.
Les rapports du laboratoire donnant les résultats du test de sensibilité standard à disque unique avec un disque de céphalothine de 30 µg doivent être interprétés selon les critères suivants:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of « Sensible » indique que l’agent pathogène est susceptible d’être inhibé par des taux sanguins généralement réalisables. Un rapport de « sensibilité intermédiaire » suggère que l’organisme serait sensible si une dose élevée est utilisée ou si l’infection est confinée aux tissus et aux liquides (p. ex., l’urine) dans lesquels des niveaux élevés d’antibiotiques sont atteints. Un rapport de « Résistant » indique que les concentrations réalisables de l’antibiotique sont peu susceptibles d’être inhibitrices et qu’un autre traitement doit être choisi.
Les procédures normalisées nécessitent l’utilisation d’organismes de contrôle en laboratoire. Le disque de céphalothine de 30 µg doit donner les diamètres de zone suivants:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution méthode (y compris la microdilution)2 ou équivalent, un isolat bactérien peut être considéré comme sensible si la valeur de la CMI (concentration inhibitrice minimale) pour la céphalothine est de 8 µg/mL ou moins. Les organismes sont considérés comme résistants si la CMI est de 32 µg/mL ou plus. Les organismes dont la valeur CMI est inférieure à 32 µg/mL mais supérieure à 8 µg/mL sont intermédiaires.
Comme pour les méthodes de diffusion standard, les procédures de dilution nécessitent l’utilisation d’organismes témoins de laboratoire. La poudre de céphalothine standard devrait donner des valeurs de CMI de l’ordre de 0,12 µg / mL et de 0,5 µg / mL pour Staphylococcus aureus ATCC 29213. Pour Escherichia coli ATCC 25922, la plage de CMI doit être comprise entre 4,0 µg / mL et 16,0 µg/mL. Pour Streptococcus faecalis ATCC 29212, la plage MIC doit être comprise entre 8,0 et 32,0 µg / mL.
Indications et utilisation de Duricef
Duricef est indiqué pour le traitement des patients présentant une infection causée par des souches sensibles des organismes désignés dans les maladies suivantes:
Infections des voies urinaires causées par les espèces E. coli, P. mirabilis et Klebsiella.
Infections de la peau et de la structure de la peau causées par des staphylocoques et / ou des streptocoques.
Pharyngite et / ou amygdalite causées par Streptococcus pyogenes (streptocoques bêta-hémolytiques du groupe A).
Remarque: Seule la pénicilline par voie intramusculaire s’est avérée efficace dans la prophylaxie du rhumatisme articulaire aigu. Duricef est généralement efficace dans l’éradication des streptocoques de l’oropharynx. Cependant, les données établissant l’efficacité de Duricef pour la prophylaxie du rhumatisme articulaire aigu subséquent ne sont pas disponibles.
Remarque: Des tests de culture et de sensibilité doivent être initiés avant et pendant le traitement. Des études de la fonction rénale doivent être effectuées lorsque cela est indiqué.
Pour réduire le développement de bactéries pharmacorésistantes et maintenir l’efficacité de Duricef et d’autres médicaments antibactériens, Duricef doit être utilisé uniquement pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté d’être causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte dans le choix ou la modification du traitement antibactérien. En l’absence de telles données, l’épidémiologie locale et les schémas de susceptibilité peuvent contribuer à la sélection empirique du traitement.
Contre-indications
Duricef est contre-indiqué chez les patients présentant une allergie connue au groupe des antibiotiques céphalosporines.
Mises En garde
AVANT L’INSTAURATION D’UN TRAITEMENT PAR Duricef, UNE ENQUÊTE MINUTIEUSE DOIT ÊTRE EFFECTUÉE POUR DÉTERMINER SI LE PATIENT A DÉJÀ EU DES RÉACTIONS D’HYPERSENSIBILITÉ AU CÉFADROXIL, AUX CÉPHALOSPORINES, AUX PÉNICILLINES OU À D’AUTRES MÉDICAMENTS. SI CE PRODUIT DOIT ÊTRE ADMINISTRÉ À DES PATIENTS SENSIBLES À LA PÉNICILLINE, IL CONVIENT DE FAIRE PREUVE DE PRUDENCE CAR LA SENSIBILITÉ CROISÉE ENTRE LES ANTIBIOTIQUES BÊTA-LACTAMINES A ÉTÉ CLAIREMENT DOCUMENTÉE ET PEUT SURVENIR CHEZ JUSQU’À 10% DES PATIENTS AYANT DES ANTÉCÉDENTS D’ALLERGIE À LA PÉNICILLINE.
EN CAS DE RÉACTION ALLERGIQUE AU Duricef, ARRÊTEZ LE MÉDICAMENT. LES RÉACTIONS D’HYPERSENSIBILITÉ AIGUË GRAVES PEUVENT NÉCESSITER UN TRAITEMENT À L’ÉPINÉPHRINE ET D’AUTRES MESURES D’URGENCE, NOTAMMENT DE L’OXYGÈNE, DES LIQUIDES INTRAVEINEUX, DES ANTIHISTAMINIQUES INTRAVEINEUX, DES CORTICOSTÉROÏDES, DES AMINES PRESSEUSES ET UNE GESTION DES VOIES RESPIRATOIRES, SELON LES INDICATIONS CLINIQUES.
Une diarrhée associée à Clostridium difficile (DCD) a été rapportée avec l’utilisation de presque tous les agents antibactériens, y compris Duricef, et sa gravité peut aller d’une diarrhée légère à une colite mortelle. Le traitement avec des agents antibactériens modifie la flore normale du côlon, ce qui entraîne une prolifération de C. difficile.
C. difficile produit des toxines A et B qui contribuent au développement du CDAD. Les souches de C. difficile productrices d’hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires au traitement antimicrobien et nécessiter une colectomie. Le DCD doit être envisagé chez tous les patients présentant une diarrhée après l’utilisation d’antibiotiques. Des antécédents médicaux prudents sont nécessaires car il a été rapporté que le DSCD survenait plus de deux mois après l’administration d’agents antibactériens.
En cas de suspicion ou de confirmation d’une DCC, il peut être nécessaire d’arrêter l’utilisation continue d’antibiotiques non dirigés contre C. difficile. Une gestion appropriée des fluides et des électrolytes, une supplémentation en protéines, un traitement antibiotique de C. difficile et une évaluation chirurgicale doivent être mis en place selon les indications cliniques.
Précautions
Généralités
Duricef doit être utilisé avec prudence en présence d’une insuffisance rénale marquée (taux de clairance de la créatinine inférieur à 50 mL/min/ 1,73 M2). (Voir POSOLOGIE ET ADMINISTRATION.) Chez les patients présentant une insuffisance rénale connue ou suspectée, une observation clinique attentive et des études de laboratoire appropriées doivent être effectuées avant et pendant le traitement.
La prescription de Duricef en l’absence d’une infection bactérienne avérée ou fortement suspectée ou d’une indication prophylactique est peu susceptible d’apporter des avantages au patient et augmente le risque de développement de bactéries pharmacorésistantes.
L’utilisation prolongée de Duricef peut entraîner la prolifération d’organismes non sensibles. Une observation attentive du patient est essentielle. En cas de surinfection pendant le traitement, des mesures appropriées doivent être prises.
Duricef doit être prescrit avec prudence chez les personnes ayant des antécédents de maladie gastro-intestinale, en particulier de colite.
Information pour les patients
Les patients doivent être informés que les médicaments antibactériens, y compris le Duricef, ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque Duricef est prescrit pour traiter une infection bactérienne, les patients doivent être informés que, bien qu’il soit courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l’efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne puissent pas être traitées par Duricef ou d’autres médicaments antibactériens à l’avenir.
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l’antibiotique est arrêté. Parfois, après le début du traitement par antibiotiques, les patients peuvent développer des selles aqueuses et sanglantes (avec ou sans crampes d’estomac et fièvre) même deux mois ou plus après avoir pris la dernière dose de l’antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
Interactions Médicament/Laboratoire
Des tests de Coombs directs positifs ont été rapportés pendant le traitement par les antibiotiques céphalosporines. Dans les études hématologiques ou dans les procédures d’appariement croisé transfusionnel lorsque des tests d’antiglobuline sont effectués sur le côté mineur ou dans les tests de Coombs sur les nouveau-nés dont les mères ont reçu des antibiotiques à base de céphalosporines avant la parturition, il faut reconnaître qu’un test de Coombs positif peut être dû au médicament.
Carcinogenèse, Mutagénèse et Altération de la fertilité
Aucune étude à long terme n’a été réalisée pour déterminer le potentiel cancérogène. Aucun test de toxicité génétique n’a été effectué.
Grossesse: Grossesse Catégorie B
Des études de reproduction ont été réalisées chez des souris et des rats à des doses allant jusqu’à 11 fois la dose humaine et n’ont révélé aucun signe d’altération de la fertilité ou de dommages au fœtus dus au monohydrate de céfadroxil. Il n’existe cependant pas d’études adéquates et bien contrôlées chez la femme enceinte. Étant donné que les études sur la reproduction animale ne sont pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
Travail et accouchement
Duricef n’a pas été étudié pour une utilisation pendant le travail et l’accouchement. Le traitement ne doit être administré que si cela est clairement nécessaire.
Mères allaitantes
Des précautions doivent être prises lorsque le monohydrate de cefadroxil est administré à une mère allaitante.
Utilisation pédiatrique
(Voir POSOLOGIE ET ADMINISTRATION.)
Utilisation gériatrique
Sur environ 650 patients ayant reçu du céfadroxil pour le traitement d’infections des voies urinaires dans trois essais cliniques, 28 % avaient 60 ans et plus, tandis que 16 % avaient 70 ans et plus. Sur environ 1000 patients ayant reçu du céfadroxil pour le traitement de l’infection de la peau et de la structure de la peau dans 14 essais cliniques, 12% avaient 60 ans et plus, tandis que 4% avaient 70 ans et plus. Aucune différence globale de sécurité n’a été observée entre les patients âgés dans ces études et les patients plus jeunes. Les études cliniques du céfadroxil pour le traitement de la pharyngite ou de l’amygdalite n’ont pas inclus un nombre suffisant de patients de 65 ans et plus pour déterminer s’ils répondent différemment des patients plus jeunes. D’autres expériences cliniques rapportées avec le cefadroxil n’ont pas mis en évidence de différences de réponses entre les patients âgés et les patients plus jeunes, mais une sensibilité accrue de certaines personnes âgées ne peut être exclue.
Le cefadroxil est largement excrété par les reins et un ajustement posologique est indiqué chez les patients présentant une insuffisance rénale (voir POSOLOGIE ET ADMINISTRATION : Insuffisance rénale). Étant donné que les patients âgés sont plus susceptibles d’avoir une fonction rénale diminuée, des précautions doivent être prises lors de la sélection de la dose et il peut être utile de surveiller la fonction rénale.
Effets indésirables
Gastro-intestinal
Des symptômes de colite pseudomembraneuse peuvent apparaître pendant ou après un traitement antibiotique (voir MISES EN GARDE). Une dyspepsie, des nausées et des vomissements ont été rarement rapportés. Une diarrhée s’est également produite.
Hypersensibilité
Des allergies (sous forme d’éruption cutanée, d’urticaire, d’œdème de quincke et de prurit) ont été observées. Ces réactions ont généralement diminué à l’arrêt du médicament. Une anaphylaxie a également été rapportée.
Autres
D’autres réactions ont inclus un dysfonctionnement hépatique, y compris une cholestase et une élévation de la transaminase sérique, un prurit génital, une moniliase génitale, une vaginite, une neutropénie transitoire modérée, de la fièvre. Une agranulocytose, une thrombocytopénie, une insuffisance hépatique idiosyncratique, un érythème polymorphe, un syndrome de Stevens-Johnson, une maladie sérique et une arthralgie ont été rarement rapportés.
En plus des effets indésirables énumérés ci-dessus qui ont été observés chez des patients traités par le céfadroxil, les effets indésirables suivants et des tests de laboratoire modifiés ont été rapportés pour des antibiotiques de la classe des céphalosporines:
Nécrolyse épidermique toxique, douleurs abdominales, surinfection, dysfonctionnement rénal, néphropathie toxique, anémie aplasique, anémie hémolytique, hémorragie, temps de prothrombine prolongé, test de Coombs positif, augmentation du chignon, augmentation de la créatinine, élévation de la phosphatase alcaline, élévation de l’aspartate aminotransférase (ASAT), élévation de l’alanine aminotransférase (ALAT), élévation de la bilirubine, élévation de la LDH, éosinophilie, pancytopénie, neutropénie.
Plusieurs céphalosporines ont été impliquées dans le déclenchement de crises, en particulier chez les patients atteints d’insuffisance rénale, lorsque la posologie n’était pas réduite (voir POSOLOGIE ET ADMINISTRATION et SURDOSAGE). En cas de convulsions associées à un traitement médicamenteux, le médicament doit être arrêté. Un traitement anticonvulsivant peut être administré si cela est cliniquement indiqué.
Surdosage
Une étude sur des enfants de moins de six ans a suggéré que l’ingestion de moins de 250 mg / kg de céphalosporines n’est pas associée à des résultats significatifs. Aucune action n’est requise autre que le soutien général et l’observation. Pour des quantités supérieures à 250 mg / kg, induire une vidange gastrique.
Chez cinq patients anuriques, il a été démontré qu’une moyenne de 63% d’une dose orale de 1 g est extraite du corps au cours d’une séance d’hémodialyse de 6 à 8 heures.
Posologie et administration Duricef
Duricef est stable à l’acide et peut être administré par voie orale sans égard aux repas. L’administration avec de la nourriture peut être utile pour diminuer les troubles gastro-intestinaux potentiels parfois associés à un traitement par céphalosporine par voie orale.
Adultes
Infections des voies urinaires: Pour les infections des voies urinaires inférieures non compliquées (c.-à-d. la cystite), la posologie habituelle est de 1 ou 2 g par jour en une seule (q.d.) ou en doses fractionnées (b.i.d.).
Pour toutes les autres infections des voies urinaires, la posologie habituelle est de 2 g par jour en doses fractionnées (b.i.d.).
Infections de la peau et de la structure de la peau: Pour les infections de la peau et de la structure de la peau, la posologie habituelle est de 1 g par jour en doses simples (q.d.) ou fractionnées (b.i.d.).Pharyngite et amygdalite: Traitement de la pharyngite streptococcique bêta-hémolytique du groupe A et de l’amygdalite — 1 g par jour en doses uniques (q.d.) ou divisées (b.i.d.) pendant 10 jours.
Enfants
Pour les infections des voies urinaires, la posologie quotidienne recommandée pour les enfants est de 30 mg / kg / jour en doses fractionnées toutes les 12 heures. Pour la pharyngite, l’amygdalite et l’impétigo, la posologie quotidienne recommandée pour les enfants est de 30 mg / kg / jour en une seule dose ou en doses égales toutes les 12 heures. Pour les autres infections de la peau et de la structure de la peau, la posologie quotidienne recommandée est de 30 mg / kg / jour en doses égales toutes les 12 heures. Dans le traitement des infections streptococciques bêta-hémolytiques, une dose thérapeutique de Duricef doit être administrée pendant au moins 10 jours.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 c. à thé |
Insuffisance rénale
Chez les patients présentant une insuffisance rénale, la posologie du monohydrate de céfadroxil doit être ajustée en fonction des taux de clairance de la créatinine pour éviter l’accumulation de médicament. Le calendrier suivant est suggéré. Chez l’adulte, la dose initiale est de 1000 mg de Duricef et la dose d’entretien (basée sur le taux de clairance de la créatinine) est de 500 mg aux intervalles de temps énumérés ci-dessous.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients avec des taux de clairance de la créatinine supérieurs à 50 mL / min peuvent être traités comme s’il s’agissait de patients ayant une fonction rénale normale.
| Taille du flacon | Instructions de reconstitution |
| 100 mL |
Suspendre dans un total de 67 mL d’eau. Méthode : Tapoter légèrement le flacon pour desserrer la poudre. Ajouter 67 mL d’eau en deux portions. Bien agiter après chaque ajout. |
| 75 mL |
Suspendre dans un total de 51 mL d’eau. Méthode : Tapoter légèrement le flacon pour desserrer la poudre. Ajouter 51 mL d’eau en deux portions. Bien agiter après chaque ajout. |
| 50 mL |
Suspendre dans un total de 34 mL d’eau. Méthode : Tapoter légèrement le flacon pour desserrer la poudre. Ajouter 34 mL d’eau en deux portions. Bien agiter après chaque ajout. |
|
Après reconstitution, conserver au réfrigérateur. Bien agiter avant utilisation. Garder le contenant bien fermé. Jeter la portion inutilisée après 14 jours. |
|
Comment est fourni Duricef
Capsules de Duricef® (cefadroxil monohydraté, USP) 500 mg: capsules de gélatine dure opaques, marron et blanches, imprimées avec « PPP’ et « 784’ sur une extrémité et avec « Duricef’ et « 500 mg’ à l’autre extrémité.
Les capsules sont fournies comme suit:
N 0430-0780-19 Flacon de 50
Conserver à température ambiante contrôlée de 15 à 30 ° C (59 à 86 °F).
Comprimés de Duricef® de 1 gramme : blancs à blanc cassé, coupés en deux, de forme ovale, portant l’inscription » PPP » d’un côté de la bissectrice et ’ 785 » de l’autre côté de la bissectrice. Les comprimés sont fournis comme suit:
N 0430-0781-19 Flacon de 50
Conserver à température ambiante contrôlée de 15 à 30 ° C (59 à 86 ° F).
Duricef® pour suspension buvable est aromatisé à l’orange et à l’ananas et est fourni comme suit:
250 mg / 5 mL N 0430-2782-15 Flacon de 50 mL
N 0430-2782-17 Flacon de 100 mL
500 mg/ 5 mL N 0430-2783-16 Flacon de 75 mL
N 0430-2783-17 Flacon de 100 mL
Avant reconstitution : Conserver à température ambiante contrôlée de 15 à 30 ° C (59 à 86 ° F).
1. Comité National des Normes de Laboratoire Clinique, Norme Approuvée, Normes de performance pour le Test de sensibilité aux Disques Antimicrobiens, 4e Édition, Vol. 10 (7): M2-A4, Villanova, Pennsylvanie, avril 1990.
2. Comité National des Normes de Laboratoire Clinique, Norme Approuvée: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 2e Édition, Vol. 10 (8): M7-A2, Villanova, Pennsylvanie, avril 1990.
Fabriqué par Bristol-Myers Squibb Co.
Princeton, NJ 08543
Pour Warner Chilcott Company, Inc.
Fajardo, PR 00738
Commercialisé par Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: céphalosporines de première génération
Ressources pour les consommateurs
- Lecture avancée
Ressources professionnelles
- Informations sur la prescription
- Suspension buvable de Cefadroxil (FDA)
Guides de traitement connexes
- Prévention de l’Endocardite bactérienne
- Infection cutanée et structurale
- Infections rénales
- … +4 de plus
mpétigo
Avertissement médical
Leave a Reply