Duricef
일반적인 이름:cefadroxil
노출량 모양:분말,서스펜션
의학적으로 검토 Drugs.com. Last updated on April21,2020.
- 개요
- 부작
- 투여
- 전문
- 상호 작용
- 더 보기
을 개발하기 위해서는 약물의 저항하는 박테리아 및 유지 관리의 효율성 Duricef®및 다른 항균 약물 Duricef 만 사용해야 합 치료하거나 방지하는 감염을 입증 또는 강하게 의심을 박테리아에 의해 발생합니다.
Duricef 묘사
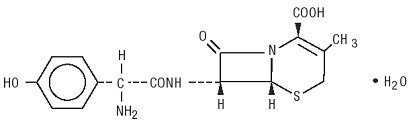
Duricef 는 경구 투여를 위해 예정된 반합성 세 팔로 스포린 항생제입니다. 그것은 흰색에서 황백색의 결정 성 분말입니다. 그것은 물 및 산 안정에 녹습니다. 화학적으로 5-Thia-1-azabicyclooct-2-ene-2-carboxylic acid,7-amino]-3-methyl-8-oxo-,monohydrate]-로 지정됩니다. 그것은 화학식 C16H17N3O5S*H2O 와 381.40 의 분자량을 가지고 있습니다. 그것은 다음과 같은 구조식:
Duricef 코팅,1g,다음을 포함 비활성 성분:셀룰로오스,히드록시프로필메틸셀룰로오스,마그네슘 스테아레이트,폴리에틸렌 글리콜 폴리소르베이트 80,작은 자연 에멀젼,및 티타늄 이산화탄소.
Duricef 에 대한 구두 서스펜션 포함되어 다음과 같은 비활성 성분:FD&C Yellow No.6,조미료(천연 및 인공지),80 폴리소르베이트,나트륨 안식향산염,자당,그리고 xanthan gum.
Duricef 캡슐은 다음을 포함 비활성 성분:D&C Red No.28,FD&C 파랑 1 호 FD&C Red No.40,젤라틴,마그네슘 스테아레이트,그리고 이산화 티타늄.
Duricef-임상 약리학
Duricef 빠르게 흡수된 후에 경구 투여. 500mg 과 1000mg 의 단일 용량에 이어 평균 피크 혈청 농도는 각각 약 16 및 28μg/mL 였다. 측정 가능한 수준은 투여 12 시간 후에 존재 하였다. 약물의 90%이상이 24 시간 이내에 소변에서 변하지 않게 배설됩니다. 최고봉 소변 농도는 단 하나 500mg 구두 복용량을 따르는 기간 도중 대략 1800μg/mL 입니다. 복용량의 증가는 일반적으로 Duricef(cefadroxil monohydrate,USP)비뇨기 농도의 비례 증가를 생성합니다. 1g 복용량을 따르는 소변 항생제 농도는 20 시간에서 22 시간 동안 감수성이있는 요로 병원균의 MIC 위에 잘 유지되었다.
미생물학
체외한 테스트 보여주는 세팔로스포린은 살균기 때문에 그들의 억제의 셀 벽 합니다. Cefadroxil 은 시험 관내 및 임상 감염 모두에서 다음 유기체에 대해 활성 인 것으로 나타났습니다(적응증 및 사용법 참조):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. 슈도모나스 종 및 아시네토박터칼코아세티쿠스(이전의 미마 및 헤렐레아 종)에 대하여 활성이 없다.
민감성 테스트를 확산 기법
항생제 디스크에 민감성 테스트 방법을 측정하는 영역 직경을 제공한 정확한 예측의 항생제를 민감. 하나의 표준 procedure1 는 추천에 대한 사용할 디스크를 테스트 민감성의 생물 cefadroxil 사용하여 세팔로스포린스 클래스(cephalothin)디스크에 있습니다. 해석은 cefadroxil 에 대한 최소 억제 농도(MIC)와 디스크 테스트에서 얻은 직경의 상관 관계를 포함합니다.
보고서에서 실험실 주고 결과를 표준 단일 디스크에 민감성 테스트와 30µg cephalothin 디스크 해석해야 한 다음 기준에 따라:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of “감수성”은 병원체가 일반적으로 달성 가능한 혈중 농도에 의해 억제 될 가능성이 있음을 나타냅니다. 보고서는”중간에 민감성”제안하는 유기체 것에 취약한 경우 높은 용량을 사용하거나면 감염을 제한하는 조직 및 액체(예:소변)에서는 높은 항생제 수준에 도달하 게 된다는 것입니다. 보고서의”강”나타내는 성취 농도의 항생제가 될 가능성이 억제와 기타 치료 선택해야 합니다.
표준화 된 절차에는 실험실 제어 유기체의 사용이 필요합니다. 30μg 세 팔로 틴 디스크는 다음 구역 직경을 제공해야합니다:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (를 포함하여 microdilution)방법 2 또는 이와 동등한,세균 분리될 수 있으로 간주에 취약한 경우 MIC(최소 억제 농도 값)을 cephalothin8µg/mL 이하이다. Mic 가 32μg/mL 이상인 경우 유기체는 내성으로 간주됩니다. MIC 값이 32μg/mL 미만이지만 8μg/mL 보다 큰 유기체는 중간체입니다.
표준 확산 방법과 마찬가지로 희석 절차에는 실험실 제어 유기체의 사용이 필요합니다. 표준 세 팔로 틴 분말은 포도상 구균 ATCC29213 에 대해 0.12μg/mL 및 0.5μg/mL 범위의 MIC 값을 제공해야합니다. 대장균 ATCC25922 의 경우 MIC 범위는 4.0μg/mL 와 16.0μg/mL 사이 여야합니다. Streptococcus faecalis ATCC29212 의 경우 MIC 범위는 8.0 에서 32.0μg/mL 사이 여야합니다.
표시 및 사용법에 대한 Duricef
Duricef 표시에 대한 환자의 치료에 의한 감염에 민감 변종의 지정된 유기체로서 다음과 같은 질병:
요로 감염에 의해 발생하는 대장균,P.mirabilis 및 Klebsiella 종합니다.
포도상 구균 및/또는 연쇄상 구균에 의한 피부 및 피부 구조 감염.
연쇄상 구균 pyogenes(그룹 a 베타 용혈성 연쇄상 구균)에 의한 인두염 및/또는 편도선염.
참고:근육 내 투여 경로에 의한 페니실린 만이 류마티스 열의 예방에 효과가있는 것으로 나타났습니다. Duricef 는 일반적으로 구강 인두에서 연쇄상 구균 박멸에 효과적입니다. 그러나,후속 류마티스 열의 예방을 위해 Duricef 의 효능을 확립하는 데이터는 이용 가능하지 않다.
참고:배양 및 감수성 검사는 치료 전과 치료 중에 시작되어야합니다. 지시 될 때 신장 기능 연구를 수행해야합니다.
을 개발하기 위해서는 약물의 저항하는 박테리아 및 유지 관리의 효율성 Duricef 과 다른 항균 마약,Duricef 만 사용해야 합 치료하거나 방지하는 감염된 강에 의한 것으로 의심되는 민감 박테리아. 문화 및 감수성 정보를 사용할 수있는 경우 항균 요법을 선택하거나 수정하는 데 고려해야합니다. 이러한 데이터가없는 경우,지역 역학 및 감수성 패턴은 치료의 경험적 선택에 기여할 수있다.
금기 사항
duricef 는 세 팔로 스포린 항생제 그룹에 알레르기가 알려진 환자에게는 금기입니다.
경고
전에 치료 Duricef 제정은,신중 조회해야하는지 여부를 결정 환자가 이전에 대한 과민반응 CEFADROXIL,세팔로스포린,페니실린 또는 기타 약물입니다. 이 제품에 부여하는 것입니다 페니실린 민감한 환자,주의해야하기 때문에 십자 감도 사이에서 베타-락탐 항생제를 명확하게 문서화되어있고가 발생할 수 있습에서 10%의 환자의 역사를 가진 페니실린 알레르기가 있습니다.
Duricef 에 대한 알레르기 반응이 발생하면 약물을 중단하십시오. 심각한 심각한 과민성 반응이 필요할 수 있 처리와 에피네프린 기타 비상 조치는 포함하여,산소,정맥 유체,정맥 항히스타민제,호르몬 PRESSOR 아민,그리고 기도 관리,임상적으로 표시됩니다.
Clostridium 체 관련 설사(CDAD)되었습보고와 함께 사용하여 거의 모든 항균제를 포함하여 Duricef 및 수 있습 범위에 심각도에서는 가벼운 설사를 치명적인 대장염. 항균제를 사용한 치료는 C.difficile 의 과증식으로 이어지는 결장의 정상적인 식물상을 변화시킵니다.
C.difficile 은 CDAD 의 발달에 기여하는 독소 A 와 B 를 생성합니다. Hypertoxin 생산 균주 C. 디피의 원인이 증가 질병과 사망으로 이러한 감염될 수 있는 내화하여 항균성 치료가 필요할 수 있습 절제술. CDAD 는 항생제 사용 후 설사와 함께 존재하는 모든 환자에서 고려되어야합니다. 항균제 투여 후 2 개월에 걸쳐 CDAD 가 발생하는 것으로보고 되었기 때문에 신중한 병력이 필요합니다.
CDAD 가 의심되거나 확인 된 경우 C.difficile 에 대해 지시되지 않은 지속적인 항생제 사용을 중단해야 할 수도 있습니다. 적절한 액체 전해질을 관리,단백질을 보충,항생제 처리의 C. 디피고,수술로 평가되어야 한 같이 임상적으로 표시됩니다.
주의사항
일반
Duricef 주의해서 사용해야에서 존재의 현저하게 장애인 신장 기능을(크레아티닌 청소율의 비율이 50mL/min/1.73M2). (복용량 및 투여를 참조하십시오.)환자에서 알려지거나 의심되는 신장 손상,주의 임상은 관찰하고 적절한 실험실에 연구를 만들어야 한 동안 전 치료입니다.
처방 Duricef 의 부재에서 입증 또는 강하게 세균 감염 또는 예방을 표시하지 않을 제공한 혜택을 환자에게 그의 위험을 증가 개발의 약물성 박테리아.
Duricef 의 장기간 사용은 nonsusceptible 유기체의 과증식을 초래할 수 있습니다. 환자를주의 깊게 관찰하는 것이 필수적입니다. 치료 중과 감염이 발생하면 적절한 조치를 취해야합니다.
Duricef 는 위장병 특히 대장염의 병력이있는 개인에게주의해서 처방되어야합니다.
환자에 대한 정보
환자는 duricef 를 포함한 항균제가 세균 감염 치료에만 사용되어야한다고 권고해야합니다. 그들은 바이러스 감염(예:일반적인 감기)을 치료하지 않습니다. 때 Duricef 규정 세균 감염을 치료하기 위해,환자에게 말했지만 그것은 일반적인 느낌을 더 나은 초기 치료의 과정에서,약물 치료해야 정확하게 의사의 지시를 따릅니다. 건너뛰용량 또는 완료되지 않는 전체 과정의 치료할 수 있습(1)감소의 효과를 즉시 처리고(2)가능성을 증가하는 박테리아 개발할 것입 저항과되지 않습에 의하여 치료할 수 있 Duricef 또는 다른 항균에 있는 약의 미래입니다.
설사는 일반적으로 항생제가 중단 될 때 끝나는 항생제에 의해 발생하는 일반적인 문제입니다. 때로는 치료를 시작한 후에 항생제,환자 개발할 수 있는 물과 피 의자(또는 위경련 및열)도로 두 개 또는 더 개월 후에 마지막 투여의 항생제입니다. 이런 일이 발생하면 환자는 가능한 빨리 의사에게 연락해야합니다.
약/실험실 테스트의 상호 작용
긍정적인 직접 쿰’테스트 보고되었을 치료 하는 동안으로 세팔로스포린 항생제입니다. 에서 혈액학 연구에 수혈 크로스-일치하는 절차를 때 antiglobulin 테스트에서 수행되는 작은 쪽 또는 쿰’의 테스트는 신생아는 누구의 어머니가 받은 세팔로스포린 항생제를 출산 전에,그것은 인정되어야한다는 긍정적인 쿰’테스트 때문일 수 있습니다.
발암 성,돌연변이 유발 및 다산의 손상
발암 가능성을 결정하기위한 장기적인 연구는 수행되지 않았다. 유전 독성 검사는 수행되지 않았습니다.
임신: 임신 Category B
재생 연구에서 수행 되었습니다 쥐고 쥐에 투여 최대 11 시 인간의 복용량과 밝혀졌다는 증거의 장애 또는 생식능력에 피해를 태아 때문에 cefadroxil 수화물. 그러나 임산부에 대한 적절하고 잘 통제 된 연구는 없습니다. 기 때문에 동물성 재생 연구는 항상의 예측 인간의 반응,이 약은 임신 중에 사용되어야한 경우에만 분명히 필요합니다.
노동 및 배달
Duricef 는 노동 및 배달 중에 사용하기 위해 연구되지 않았습니다. 치료는 분명히 필요한 경우에만 주어져야합니다.
수유부
수유부에게 cefadroxil monohydrate 를 투여 할 때는주의를 기울여야합니다.
소아 사용
(복용량 및 투여 참조.)
성인용
의 약 650 받은 환자 cefadroxil 에 대한 요로 감염의 치료에서 세 임상 시험 28%가 60 세 이상의 동 16%던 70 년 이상입니다. 14 건의 임상 시험에서 피부 및 피부 구조 감염 치료를 위해 세 파드록실을 투여받은 약 1000 명의 환자 중 12%가 60 세 이상인 반면 4%는 70 세 이상이었다. 이 연구에서 노인 환자와 젊은 환자간에 안전성의 전반적인 차이는 관찰되지 않았다. 임상 연구의 cefadroxil 의 처리를 위한 인 또는 염을 포함하지 않았는 충분한 숫자 환자의 65 세 이상 여부를 확인들은 다르게 응답에서 젊은 환자. 다른 보고한 임상 경험과 cefadroxil 가 확인되지 않는 차이는 응답에 사는 노인과 젊은 환자,하지만 더 감도가 일부 오래된 개인 배제할 수 없습니다.
Cefadroxil 은 실질적으로 배설하여,신장과 노출량 조절을 위해 나타납 신장애 환자(보 복용량과 관리:신장애). 기 때문에 노인 환자들이 더 많은 가능성이 감소했 신장 기능을 해야에 복용량은 선택과 유용할 수 있습니터 신장 기능이다.
반응
장
발병을 막성 대장염의 증상이 발생할 수 있습니다 중이나 후에 항생 처리(경고를 참조하십시오). 소화 불량,메스꺼움 및 구토가 드물게보고되었습니다. 설사도 발생했습니다.
과민성
알레르기(발진,두드러기,혈관 부종 및 소양증의 형태로)가 관찰되었습니다. 이러한 반응은 대개 약물 중단시 가라 앉았습니다. 아나필락시스도보고되었습니다.
기타
기타 반응을 포함한 간기능 장애 등의 담즙고 고도에 혈청 transaminase,생식기 pruritus,생식기 moniliasis,질염,적당한 일시적인 호중구,발열이다. 무과립구증,혈소판,특이한 간의 실패,다형 홍반,스티븐-존슨 증후군,세럼병,관절통되는 거의 보고합니다.
이외에 불리한 반응은 위에 나열되어 있는 관찰되는 환자에서 처리 cefadroxil,다음과 같은 부작용과 변경 실험실 테스트 보고되었을 위한 세팔로스포린이 클리는 항생제:
독성 상피 necrolysis,복통,의 superinfection,신부전,독성 신장병,무력성 빈혈,용혈빈혈,뇌출혈,장기 프로트롬빈시간,긍정적인 쿰’테스트,증가 BUN,크레아티닌 증가,고 알칼리인산화효소,높은 aspartate aminotransferase(AST),높은 알라닌 aminotransferase(ALT),높은 빌리루빈,상승을 알아낼,호산구,죄,호중구.
여러 세팔로스포린 내포되었습니다 트리거링에 포착,특히 신장애 환자에서 때,노출량은 감소하지 않는(참조하십시오 노출량 관리와 과량 투여). 약물 요법과 관련된 발작이 발생하면 약물을 중단해야합니다. 임상 적으로 지시 된 경우 항 경련제 치료가 주어질 수 있습니다.
과량 투여
연구의 어린이는 여섯 살의 나이 제안하는 섭취의 미만 250mg/kg 의 세팔로스포린과 연결되지 않은 중요한 결과입니다. 일반적인 지원 및 관찰 이외의 조치는 필요하지 않습니다. 250mg/kg 보다 큰 양의 경우 위 비우기를 유도하십시오.
에서 다섯 anuric 환자,그것을 증명하는 평균의 63%1g 경구 투여 추출하는 몸에서 동안 6-8 시간 혈액 투석니다.
Duricef 투여 량 및 투여
Duricef 는 산-안정적이며 식사와 무관하게 경구 투여 될 수있다. 관리 음식에 도움이 될 수 있습니다 감소하는 잠재적인 위장 불만이 가끔 와 관련된 구강 세팔로스포린 치료입니다.
성인
요로 감염: 에 대한 단순한 낮은 요로 감염을(즉,방광염)일반적인 용량이 1 또는 2g 에서 하루에 하나의(q.d.) 또는 나누어(b.i.d.).
에 대한 다른 모든 요로 감염을 일반적인 용량이 2g 당일에 나누어(b.i.d.).
피부 및 피부 구조 감염:피부 및 피부 구조 감염이 일반적인 용량이 1g 에서 하루에 하나의(q.d.) 또는 나누어(b.i.d.).
인와 편도염 치료의 그룹 베타-연쇄상 구균 용혈성 인와 염—1g 에서 하루에 하나의(q.d.) 또는 나누어(b.i.d.) 10 일입니다.
어린이
요로감염에 대한 권장되는 매일 어린이를위한 복용량이 30mg/kg/day 에서 나누어 12 시간마다. 에 대한 인두염,염,그리고 농가진,권장하는 매일 어린이를위한 복용량이 30mg/kg/day 에서 단일 용량 또는 동등하게 나누어 12 시간마다. 기타 피부 및 피부 구조 감염을 추천한 매일 노출량은 30mg/kg/day 에서 동등하게 나누어 12 시간마다. 베타-용혈성 연쇄상 구균 감염의 치료에서,Duricef 의 치료 용량은 적어도 10 일 동안 투여되어야한다.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2tsp |
신장애
신장애 환자에서, 의 용량이 cefadroxil 물 조정해야에 따라 크레아티닌 청소율 요금을 방지하는 약물 축적. 다음 일정이 제안됩니다. 성인에서는,초기 용량이 1000mg Duricef 및 유지 용량(에 따라 크레아티닌 청소율)은 500mg 시간 간격으로 아래와 같습니다.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients 50mL/min 이상의 크레아티닌 청소율로 정상적인 신장 기능을 가진 환자 인 것처럼 치료할 수 있습니다.
| 병 크기 | 재구성 방향 |
| 100mL |
일시 중지에서의 총 67mL 물. 방법:병을 가볍게 두드려 분말을 느슨하게하십시오. 두 부분에 물 67ml 를 넣으십시오. 각 추가 후에 잘 흔들어주십시오. |
| 75mL |
일시 중지에서의 총 51mL 물. 방법:병을 가볍게 두드려 분말을 느슨하게하십시오. 두 부분에 물 51ml 를 넣으십시오. 각 추가 후에 잘 흔들어주십시오. |
| 50mL |
일시 중지에서의 총 34mL 물. 방법:병을 가볍게 두드려 분말을 느슨하게하십시오. 두 부분에 물 34ml 를 넣으십시오. 각 추가 후에 잘 흔들어주십시오. |
|
재구성 후 냉장고에 보관하십시오. 사용하기 전에 잘 흔들어주십시오. 용기를 단단히 닫아 두십시오. 14 일 후에 사용하지 않은 부분을 버리십시오. |
|
는 방법은 Duricef 공급
Duricef®(cefadroxil 수화물,USP)500mg 캡슐:불투명하고,적갈색과 흰색 단단한 젤라틴 캡슐,로 각인”PPP”및”784″한쪽 끝에는”Duricef”및”500mg”다른 쪽 끝에서.
캡슐은 제공된 다음과 같다:
N0430-0780-19 병 50
스토어에서 제어온 15°-30°C(59°-86°F).
Duricef®1g 태블릿:백색 백색,최 bisected,타원형 모양의와 함께 각 인”PPP”의 한쪽에 계획하고”785″다른 측면에서의 계획. 정제 공급 다음과 같다:
N0430-0781-19 병 50
스토어에서 제어온 15°-30°C(59°-86°F).
구강 현탁액 용 Duricef®는 오렌지-파인애플 향이 있으며 다음과 같이 공급됩니다:
250mg/5mL N0430-2782-15 50mL 병
N0430-2782-17 100mL 병
500mg/5mL N0430-2783-16 75mL 병
N0430-2783-17 100mL 병
이전에 재구성:점에서 제어온 15°-30°C(59°-86°F).2. 임상 실험실 표준을위한 국가위원회,승인 된 표준: 에어로빅으로 자라는 박테리아에 대한 항균 감수성 시험 희석 방법,제 2 판,Vol. 그러나,이 경우,이 약물의 투여 량은 약물의 투여 량에 따라 달라진다.
Bristol-Myers Squibb Co.제조
PRINCETON,NJ08543
For Warner Chilcott Company,Inc.
Fajardo,PR00738
Warner Chilcott,Inc.에 의해 시판 됨.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: 첫 번째 세대 세팔로스포린
소비자는 자원
- 고급 읽기
전문적인 자원
- 정보 처방
- Cefadroxil 구두 서스펜션(FDA)
관련 처리는 안내
- 세균 심내막염 예방
- 피부과 구조 감염
- Impetigo
- 신장 감염
- … +4 더
의료 면책 조항
Leave a Reply