Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Chemický název je ( ± ) – – 1 – piperazinyl] ethoxy] octová kyselina, dihydrochlorid. Cetirizin hydrochlorid je racemická sloučenina s empirickým vzorcem C21H25ClN2O3 * 2HCl. Molekulární hmotnost je 461.82 a chemické struktury je uveden níže:
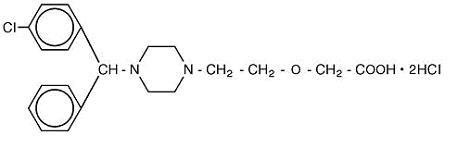
Cetirizin-dihydrochlorid je bílý nebo téměř bílý prášek a je snadno rozpustný ve vodě, prakticky nerozpustný v acetonu a v dichlormethanu. Cetirizin Hydrochlorid Perorální Roztok, USP je bezbarvý až světle žlutý perorální roztok obsahující Cetirizin hydrochlorid o koncentraci 1 mg/mL (5 mg/5 mL) pro orální podávání. PH je mezi 4 a 5. Neaktivní složky perorálního roztoku jsou: ledová kyselina octová, hroznová příchuť, glycerin, methylparaben, propylenglykol, propylparaben, octan sodný, sacharóza a čištěná voda.
Cetirizin – Klinická Farmakologie
Mechanismus Akce: Cetirizin, lidský metabolit hydroxyzinu je antihistaminikum; jeho hlavní účinky jsou zprostředkovány selektivní inhibicí periferních H1 receptorů. Antihistaminická aktivita cetirizinu byla jasně zdokumentována v různých zvířecích a lidských modelech. In vivo a ex vivo zvířecí modely prokázaly zanedbatelnou anticholinergní a anti-serotonergní aktivitu. V klinických studiích však byla sucho v ústech častější u cetirizinu než u placeba. Studie vazby na receptory in vitro neprokázaly žádnou měřitelnou afinitu k jiným než H1 receptorům. Autoradiografické studie s radioaktivně značeným cetirizinem u potkanů prokázaly zanedbatelnou penetraci do mozku. Experimenty Ex vivo na myších ukázaly, že systémově podávaný Cetirizin významně nezabírá mozkové H1 receptory.
Farmakokinetika:
Absorpce: Cetirizin byl rychle absorbován, čas k dosažení maximální koncentrace (T max) přibližně 1 hodinu po perorálním podání tablet nebo perorálního roztoku u dospělých. Srovnatelná biologická dostupnost byla zjištěna mezi lékovými formami tablety a perorálního roztoku. Při podávání opakovaných dávek cetirizinu zdravým dobrovolníkům (10 mg tablety jednou denně po dobu 10 dnů) byla pozorována průměrná maximální plazmatická koncentrace (C max) 311 ng / ml. Nebyla pozorována žádná akumulace. Farmakokinetika cetirizinu byla lineární pro perorální dávky v rozmezí od 5 do 60 mg. Jídlo nemělo žádný vliv na rozsah expozice Cetirizinu (AUC), ale T max byl zpožděn o 1,7 hodiny a cmax snížena o 23%, v přítomnosti potravy.
distribuce: Střední plazmatické bílkoviny Cetirizinu je 93%, nezávisle na koncentraci v rozmezí 25-1000 ng/mL, která zahrnuje terapeutické plazmatické hladiny pozorované.
Metabolismus: bilanční studie u 6 zdravých dobrovolníků mužského pohlaví uvedli, že 70% podané radioaktivity bylo nalezeno v moči a 10% ve stolici. Přibližně 50% radioaktivity bylo identifikováno v moči jako nezměněné léčivo. Většina rychlého zvýšení maximální radioaktivity v plazmě byla spojena s mateřským lékem, což naznačuje nízký stupeň metabolismu prvního průchodu. Cetirizin je v omezené míře metabolizován oxidační o-dealkylací na metabolit se zanedbatelnou antihistaminickou aktivitou. Enzym nebo enzymy zodpovědné za tento metabolismus nebyly identifikovány.
Eliminace: průměrný eliminační poločas u 146 zdravých dobrovolníků ve více farmakokinetické studie byla 8,3 hodin a zjevná celková tělesná clearance Cetirizinu přibližně 53 mL/min.
Studie Interakce
Farmakokinetické interakční studie s Cetirizinem u dospělých byly provedeny s pseudoefedrinem, antipyrin, ketokonazol, erythromycin a azithromycin.
nebyly pozorovány žádné interakce. V opakovaném podání theofyllinu (400 mg jednou denně po dobu 3 dnů) a Cetirizinu (20 mg jednou denně po dobu 3 dnů), 16% pokles clearance Cetirizinu byla pozorována. Dispozice teofylinu nebyla současným podáváním cetirizinu změněna.
zvláštní populace
Pediatričtí pacienti: U dětských pacientů ve věku 2 až 5 let, kteří dostávali 5 mg cetirizinu, byla průměrná C max 660 ng / ml. Na základě srovnání mezi studiemi byla zdánlivá celková tělesná clearance normalizovaná o 81-111% vyšší a eliminační poločas byl u pediatrické populace o 33 až 41% kratší než u dospělých. U dětských pacientů ve věku 6 až 23 měsíců, kteří dostávali jednorázovou dávku 0, 25 mg/kg perorálního roztoku cetirizinu (průměrná dávka 2, 3 mg), byla průměrná C max 390 ng/ml. Na základě zkřížené studie srovnání, váhy-normalizovaný, zjevná celková tělesná clearance byla 304% vyšší a eliminační poločas byl 63% kratší v této pediatrické populace ve srovnání s dospělými. Průměrná AUC(0-t) u dětí od 6 měsíců do < 2 let užívajících maximální dávku Cetirizinu roztoku (2,5 mg dvakrát denně) se očekává, že bude dva-krát vyšší než u dospělých léčených dávkou 10 mg Cetirizin tablety jednou denně.
vliv pohlaví: vliv pohlaví na farmakokinetiku cetirizinu nebyl dostatečně studován.
vliv rasy: nebyly pozorovány žádné rozdíly v kinetice cetirizinu související s rasou.
Farmakodynamika: Cetirizin hydrochlorid v dávkách 5 a 10 mg silně inhibuje „wheal and flare“ způsobené intradermální injekce histaminu v 19 dětských dobrovolníků (ve věku od 5 do 12 let) a aktivita přetrvávala po dobu alespoň 24 hodin. V 35denní studii u dětí ve věku 5 až 12 let nebyla zjištěna žádná tolerance k antihistaminickým účinkům (potlačení wheal a flare response) hydrochloridu cetirizinu. V 10 dětí 7 až 25 měsíců věku, kteří obdrželi 4 až 9 dní Cetirizinu v perorálního roztoku (0,25 mg/kg bid), bylo 90% inhibici histaminem indukované (10 mg/mL), kožní dolu a 87% inhibice signální 12 hodin po podání poslední dávky. Klinický význam této suprese histaminem indukované odpovědi wheal a flare při kožních testech není znám.
účinky intradermální injekce různých jiných mediátorů nebo uvolňovače histaminu byla také inhibována Cetirizin, jako byla reakce na studené napadnout u pacientů s chladem indukovanou kopřivku. U mírně astmatických subjektů zablokoval hydrochlorid cetirizinu v dávce 5 až 20 mg bronchokonstrikci v důsledku nebulizovaného histaminu s prakticky úplnou blokádou po dávce 20 mg. Ve studiích po dobu až 12 hodin po kožní antigen challenge, pozdní fázi průniku eosinofilů, neutrofilů a bazofilů, komponenty alergické zánětlivé reakce, byla inhibována Cetirizin hydrochlorid v dávce 20 mg. Ve čtyřech klinických studiích u zdravých dospělých mužů nebylo u subjektů léčených cetirizinem hydrochloridem pozorováno žádné klinicky významné průměrné zvýšení QTc. V první studii, placebem kontrolované zkřížené studii, Cetirizin hydrochlorid byl podáván v dávkách až do 60 mg za den, 6 krát maximální klinické dávce, po dobu 1 týdne, a žádné významné znamenat prodloužení QTc intervalu došlo. Ve druhé studii, zkřížené studii, byly cetirizin hydrochlorid 20 mg a erythromycin (500 mg každých 8 hodin) podávány samostatně a v kombinaci. U kombinace nebo u samotného cetirizin-hydrochloridu nebyl žádný významný účinek na QTc. Ve třetí studii, také zkřížené studii, byly cetirizin hydrochlorid 20 mg a ketokonazol (400 mg denně) podávány samostatně a v kombinaci.
cetirizin hydrochlorid způsobil po 10 dnech léčby průměrné zvýšení QTc o 9,1 MS oproti výchozí hodnotě. Ketokonazol také zvýšil QTc o 8,3 ms. Kombinace způsobila zvýšení o 17, 4 ms, což se rovná součtu jednotlivých účinků. Nedošlo tedy k žádné významné lékové interakci na QTc s kombinací Cetirizin hydrochloridu a ketokonazolu. Ve čtvrté studii, placebem kontrolované paralelní studii, Cetirizin hydrochlorid 20 mg byl podán samostatně nebo v kombinaci s azithromycin (500 mg v jedné dávce první den a následně 250 mg jednou denně). U samotného cetirizin hydrochloridu 20 mg nebo v kombinaci s azithromycinem nedošlo k významnému zvýšení QTc. V čtyři-týdenní klinické studii u dětských pacientů ve věku 6 až 11 let, výsledky náhodně získané EKG měření před léčbou a po 2 týdnech léčby ukázaly, že Cetirizin hydrochlorid 5 nebo 10 mg není zvýšení QTc oproti placebu. V jednom týdnu klinické studii (N=86) Cetirizin Hydrochlorid Perorální Roztok, USP (0,25 mg/kg dvakrát denně) ve srovnání s placebem u pediatrických pacientů od 6 do 11 měsíců věku, EKG, měření užíván během 3 hodin po poslední dávce neprokázaly žádné abnormality v EKG nebo nárůsty QTc intervalu v obou skupiny ve srovnání s výchozí úrovní hodnocení. Údaje z jiných studií, ve kterých byl cetirizin-hydrochlorid podáván pacientům ve věku 6-23 měsíců, byly v souladu se zjištěními v této studii.
účinky cetirizin-hydrochloridu na QTc interval při dávkách vyšších než 10 mg nebyly studovány u dětí mladších 12 let. V šestitýdenní placebem kontrolované studii u 186 pacientů (ve věku 12 až 64 let) s alergickou rýmou a mírným až středně těžkým astmatem, Cetirizin hydrochlorid 10 mg jednou denně ke zlepšení symptomů rýmy a neovlivnila plicní funkce. Ve dvou-týdenní placebem kontrolované klinické hodnocení, dílčí analýzy 65 dětských (ve věku 6 až 11 let) alergické rýmy u pacientů s astmatem ukázala, Cetirizin hydrochlorid neovlivnila plicní funkce. Tyto studie podporují bezpečnost podávání hydrochloridu cetirizinu pediatrickým a dospělým pacientům s alergickou rýmou s mírným až středně závažným astmatem.
Klinické Studie: Multicentrická, randomizovaná, dvojitě slepá, klinická studie porovnávající Cetirizin 5 až 20 mg s placebem u pacientů od 12 let a starší s celoroční alergickou rýmou byly provedeny ve Spojených Státech. Dva z nich vykazovaly významné snížení příznaků celoroční alergické rýmy po dobu až 8 týdnů. Dva 4-týdenní multicentrické, randomizované, dvojitě zaslepené klinické studie porovnávající Cetirizin 5 až 20 mg s placebem u pacientů s chronickou idiopatickou kopřivkou byla také provedla a ukázala významné zlepšení symptomů chronické idiopatické kopřivky. Obecně byla dávka 10 mg účinnější než dávka 5 mg a dávka 20 mg nepřinesla žádný další účinek. Některé z těchto studií zahrnovaly pediatrické pacienty ve věku 12 až 16 let. Kromě toho byly ve Spojených státech provedeny čtyři multicentrické, randomizované, placebem kontrolované dvojitě zaslepené 2-4 týdenní studie u 534 dětských pacientů ve věku 6 až 11 let se sezónní alergickou rýmou v dávkách do 10 mg.
OZNAČENÍ & POUŽITÍ
Celoroční Alergické Rýmy: Cetirizin Hydrochlorid Perorální Roztok, USP je indikován pro úlevu od příznaků souvisejících s celoroční alergické rýmy způsobené alergeny, jako jsou roztoči, zvířecí alergeny a plísně v děti ve věku 6 až 23 měsíců věku. Mezi příznaky léčené účinně patří kýchání, rhinorea, postnasální výtok, nosní pruritus, oční pruritus a trhání.
Chronická Kopřivka: Cetirizin Hydrochlorid Perorální Roztok, USP je indikován pro léčbu nekomplikované kožní projevy chronické idiopatické kopřivky u dětí od 6 měsíců do 5 let věku. Významně snižuje výskyt, závažnost a trvání kopřivky a významně snižuje pruritus.
Kontraindikace
Cetirizin Hydrochlorid Perorální Roztok, USP je kontraindikován u pacientů se známou přecitlivělostí nebo některou z jeho složek nebo hydroxyzin.
bezpečnostní Opatření
Činnosti, které Vyžadují Duševní Bdělost: V klinických studiích, výskyt somnolence byl hlášen u některých pacientů užívajících Cetirizin hydrochlorid; vzhledem opatrnost by proto měla být věnována, pokud je řídit auto nebo obsluhovat potenciálně nebezpečné stroje. Je třeba se vyhnout současnému užívání cetirizin-hydrochloridu s alkoholem nebo jinými látkami tlumícími CNS, protože může dojít k dalšímu snížení bdělosti a dalšímu zhoršení výkonu CNS.
lékové interakce: nebyly zjištěny žádné klinicky významné lékové interakce s teofylinem v nízké dávce, azithromycinem, pseudoefedrinem, ketokonazolem nebo erythromycinem. Došlo k malému poklesu clearance cetirizinu způsobenému dávkou teofylinu 400 mg; je možné, že větší dávky teofylinu by mohly mít větší účinek.
Karcinogeneze, Mutageneze a poruchy Plodnosti: V 2-leté studii kancerogenity u potkanů, Cetirizin nebyl karcinogenní v potravinových dávkách až do 20 mg/kg (přibližně 15 krát maximální doporučenou denní perorální dávka u dospělých na mg/m 2 základ, nebo přibližně 7 krát maximální doporučenou denní perorální dávka u kojenců na mg/m 2 základ). V 2-leté studii kancerogenity u myší, Cetirizin způsobil zvýšený výskyt benigních tumorů jater u samců při dietní dávka 16 mg/kg (přibližně 6 krát maximální doporučenou denní perorální dávka u dospělých na mg/m 2 základ, nebo přibližně 3 krát maximální doporučenou denní perorální dávka u kojenců na mg/m 2 základ). U myší při dietární dávce 4 mg/kg (přibližně 2násobek maximální doporučené denní perorální dávky u dospělých na základě mg/m2 nebo přibližně ekvivalentní maximální doporučené denní perorální dávce u kojenců na základě mg/m2) nebylo pozorováno zvýšení incidence jaterních nádorů. Klinický význam těchto nálezů při dlouhodobém užívání cetirizin-hydrochloridu není znám.
Cetirizin nebyl mutagenní v amesově testu a nebyl klastogenní v testu lidských lymfocytů, testu myších lymfomů a in vivo mikronukleárním testu u potkanů.
ve studii fertility a celkové reprodukční výkonnosti u myší Cetirizin nezhoršoval fertilitu při perorální dávce 64 mg / kg(přibližně 25násobek maximální doporučené denní perorální dávky u dospělých na základě mg / m2).
pediatrické použití: bezpečnost hydrochloridu cetirizinu byla prokázána u dětských pacientů ve věku 6 až 5 let. Bezpečnost cetirizinu byla prokázána u 168 pacientů ve věku 2 až 5 let v placebem kontrolovaných studiích trvajících až 4 týdny. V dávce mg/kg dostávala většina ze 168 pacientů mezi 0, 2 a 0, 4 mg/kg cetirizinu HCl. Bezpečnost cetirizinu u 399 pacientů ve věku 12 až 24 měsíců byla prokázána v placebem kontrolované 18měsíční studii, ve které byla průměrná dávka
0, 25 mg / kg dvakrát denně, což odpovídá rozmezí 4 až 11 mg / den. Bezpečnost Cetirizin hydrochloridu perorální roztok, USP byla prokázána u 42 pacientů ve věku 6 až 11 měsíců v placebem kontrolované 7denní studii. Předepsaná dávka byla 0, 25 mg / kg dvakrát denně, což odpovídalo průměru 4, 5 mg/den, s rozmezím 3, 4 až 6, 2 mg/den.
účinnost Cetirizin hydrochlorid pro léčbu alergické rýmy a chronické idiopatické kopřivky u pediatrických pacientů ve věku 6 až 5 let je založena na extrapolaci prokázána účinnost přípravku Cetirizin hydrochlorid u dospělých s těmito podmínkami a pravděpodobnost, že průběh onemocnění, patofyziologie a účinku drogy jsou v podstatě podobné mezi těmito dvěma populacemi. Účinnost je extrapolována na 6 měsíců věku pro celoroční alergickou rýmu, protože se předpokládá, že se toto onemocnění vyskytuje až do tohoto věku u dětí. Doporučené dávky pro pediatrickou populaci jsou založeny na křížovém srovnání farmakokinetiky a farmakodynamiky cetirizinu u dospělých a pediatrických subjektů a na bezpečnostním profilu cetirizinu u dospělých i pediatrických pacientů v dávkách rovných nebo vyšších než doporučené dávky. AUC a C max cetirizinu u pediatrických subjektů ve věku 6 až 23 měsíců, kteří dostávali průměr 2.3 mg v jedné dávce a u pacientů ve věku od 2 do 5 let, kteří dostávali jednorázové dávky 5 mg Cetirizinu perorální roztok, byla odhadnuta na přechodný mezi pozorovanou u dospělých, kteří dostávali jednorázové dávky 10 mg Cetirizin tablety a ti, kteří dostávali jednorázové dávky 20 mg Cetirizin tablety.
bezpečnost a účinnost Cetirizinu u dětských pacientů mladších 6 měsíců nebyla stanovena.
nežádoucí účinky
pediatrické studie byly provedeny s cetirizin hydrochloridem. Více než 1300 dětských pacientů ve věku 6 až 11 let s více než 900 léčeni Cetirizin hydrochlorid v dávkách 1,25 až 10 mg za den bylo zařazeno v kontrolovaných a nekontrolovaných klinických studiích prováděných ve Spojených Státech. Doba trvání léčby se pohybovala od 2 do 12 týdnů. Placebem kontrolovaných studiích až 4 týdny trvání zahrnuty 168 dětských pacientů ve věku 2 až 5 let, kteří dostávali Cetirizin, z nichž většina obdržela jedné denní dávce 5 mg. Placebem kontrolovaná studie trvající 18 měsíců zahrnovala 399 pacientů ve věku 12 až 24 měsíců léčených cetirizinem (0 .A další placebem kontrolovaná studie trvající 7 dní zahrnovala 42 pacientů ve věku 6 až 11 měsíců, kteří byli léčeni cetirizinem (0, 25 mg / kg dvakrát denně).
většina nežádoucích účinků hlášených u dětských pacientů ve věku 2 až 11 let s cetirizin-hydrochloridem byla mírná nebo středně závažná. V placebem kontrolovaných studiích byla incidence přerušení léčby z důvodu nežádoucích účinků u pediatrických pacientů užívajících až 10 mg cetirizin-hydrochloridu méně častá (0,4% u cetirizin-hydrochloridu oproti 1,0% u placeba).
Tabulka 1 uvádí nežádoucí účinky, které byly hlášeny pro Cetirizin hydrochlorid 5 a 10 mg u pediatrických pacientů ve věku 6 až 11 let v placebem kontrolovaných klinických studiích ve Spojených Státech a byly častější s Cetirizin hydrochlorid než placebo. Z těchto, bolest břicha byla považována za související s léčbou a somnolenci, zdá být dávce, 1,3% v placebem, a to o 1,9% na 5 mg a 4,2% u 10 mg. Nežádoucí účinky hlášené u pediatrických pacientů ve věku 2 až 5 let v placebem kontrolovaných studiích byly kvalitativně podobné povahy a obecně podobné četnosti jako nežádoucí účinky hlášené ve studiích s dětmi ve věku 6 až 11 let.
v placebem kontrolovaných studiích u dětských pacientů ve věku 6 až 24 měsíců byl výskyt nežádoucích účinků v každé studii podobný ve skupinách léčených cetirizinem a placebem. Somnolence se vyskytla v podstatě se stejnou frekvencí u pacientů, kteří dostávali cetirizin, a u pacientů, kteří dostávali placebo. Ve studii trvající 1 týden u dětí ve věku 6-11 měsíců vykazovali pacienti, kteří dostávali Cetirizin, větší podrážděnost / nervozitu než pacienti užívající placebo. Ve studii trvající 18 měsíců u pacientů starších 12 měsíců se nespavost vyskytovala častěji u pacientů, kteří dostávali Cetirizin, než u pacientů, kteří dostávali placebo (9,0% vs. 5,3%). V těch pacientů, kteří dostávali 5 mg nebo více za den Cetirizinu ve srovnání s pacienty, kteří dostávali placebo, únava (3.6% vs. 1,3%) a nevolnost (o 3,6% versus 1.8%) se vyskytovaly častěji.
Tabulka 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Bronchospasmus | 1.9% | 3.1% | 1.9% |
| Nevolnost | 1.9% | 1.9% | 2.8% |
| Zvracení | 1.0% | 2.5% | 2.3% |
následující příhody byly pozorovány zřídka (méně než 2%), v obou 3982 dospělí a děti od 12 let a starší nebo v 659 pediatrických pacientů ve věku 6 až 11 let, kteří dostávali Cetirizin hydrochlorid v AMERICKÝCH studiích, včetně otevřených erotických studium šest měsíců. Příčinná souvislost těchto vzácných příhod s podáním cetirizin-hydrochloridu nebyla stanovena.
autonomní nervový systém: anorexie, návaly horka, zvýšené slinění, retence moči.
kardiovaskulární: srdeční selhání, hypertenze, palpitace, tachykardie.
Centrální a Periferní Nervový systém: abnormální koordinace, ataxie, zmatenost, dysfonie, hyperestézie, hyperkineze, hypertonie, hypestézie, křeče, migréna, zánět míchy, ochrnutí, parestézie, ptóza, synkopa, třes, záškuby, závratě, poruchy zorného pole.
gastrointestinální: abnormální funkce jater, zhoršení zubního kazu, zácpa, dyspepsie, říhání, flatulence, gastritida, hemoroidů, zvýšená chuť k jídlu, melena, rektální krvácení, stomatitida, včetně ulcerózní stomatitida, jazyk, změna barvy, otok jazyka.
genitourinární: cystitida, dysurie, hematurie, frekvence močení, polyurie, močová inkontinence, infekce močových cest.
sluch a vestibulární: hluchota, bolesti uší, ototoxicita, tinnitus.
metabolické / nutriční: dehydratace, diabetes mellitus, žízeň.
muskuloskeletální: artralgie, artritida, artróza, svalová slabost, myalgie.
Psychiatrické: abnormální myšlení, agitovanost, amnézie, úzkost, snížené libido, depersonalizace, deprese, emoční labilita, euforie, poruchy koncentrace, nespavost, nervozita, paroniria, poruchy spánku.
respirační systém: bronchitida, dušnost, hyperventilace, zvýšené sputum, pneumonie, respirační porucha, rýma, sinusitida, infekce horních cest dýchacích.
reprodukční: dysmenorea, bolest ženských prsou, intermenstruační krvácení, leukorea, menoragie, vaginitida.
retikuloendoteliální: lymfadenopatie.
Kůže: akné, alopecie, angioedém, bulózní erupce, ekzém, suchá kůže, ekzém, erytematózní vyrážka, furunkulóza, hyperkeratóza, hypertrichóza, zvýšené pocení, makulopapulární vyrážka, fotosenzitivní reakce, fotosenzitivita toxická reakce, svědění, purpura, vyrážka, seborrhea, kožní poruchy, kožní noduly, urtikárie.
zvláštní smysly: parosmie, ztráta chuti, zvrácenost chuti.
vidění: slepota, konjunktivitida, bolest očí, glaukom, ztráta ubytování, oční krvácení, xeroftalmie.
tělo jako celek: úraz, astenie, bolest zad, bolest na hrudi, zvětšené břicho, otok obličeje, horečka, generalizované otoky, návaly horka, zvýšení tělesné hmotnosti, otoky nohou, nevolnost, překrvení nosní polyp, bolest, bledost, periorbitální edém, periferní edém, ztuhlost.
během léčby cetirizinem se občas vyskytly přechodné, reverzibilní zvýšení jaterních transamináz. V souvislosti s užíváním cetirizin-hydrochloridu byla hlášena hepatitida s významným zvýšením transaminázy a zvýšeným bilirubinem.
Post-Marketingových Zkušeností
V post-marketingového období, následující dodatečné vzácné, ale potenciálně závažné nežádoucí účinky byly hlášeny: agresivní reakce, anafylaxe, cholestáza, křeče, glomerulonefritidy, halucinace, hemolytická anémie, hepatitida, orofaciální dyskineze, závažná hypotenze, narození mrtvého dítěte, sebevražedné myšlenky, sebevražda, trombocytopenie a akutní generalizovaná pustulosis pustulosis (AGEP).
Chcete-li nahlásit podezření na nežádoucí účinky, kontaktujte Torrent Pharma Inc. na 800-912-9561 nebo FDA na 1-800-FDA-1088 nebo www.fda.gov/medwatch.
zneužívání a závislost na drogách
neexistují žádné informace, které by naznačovaly, že k zneužívání nebo závislosti dochází u hydrochloridu cetirizinu.
předávkování
bylo hlášeno předávkování cetirizin-hydrochloridem. U jednoho dospělého pacienta, který si vzal 150 mg Cetirizin hydrochlorid, pacient byl ospalý, ale ani zobrazovat žádné další klinické příznaky nebo abnormální krevní biochemie nebo hematologie výsledky. U 18měsíčního pediatrického pacienta, který užíval předávkování hydrochloridem cetirizinu (přibližně 180 mg), byl zpočátku pozorován neklid a podrážděnost; následovala ospalost. Pokud dojde k předávkování, léčba by měla být symptomatická nebo podpůrná, s přihlédnutím k případné současném požití léků. Specifické antidotum k cetirizin hydrochloridu není známo. Cetirizin hydrochlorid není účinně odstraněn dialýzou a dialýza bude neúčinná, pokud nebylo současně požito dialyzovatelné činidlo. Akutní minimální letální perorální dávka byli 237 mg/kg u myší (cca 95 krát maximální doporučenou denní perorální dávka u dospělých na základě mg/m2, nebo přibližně 40 krát maximální doporučenou denní perorální dávka u kojenců na základě mg/m2) a 562 mg/kg u potkanů (přibližně 460 krát maximální doporučenou denní perorální dávka u dospělých na základě mg/m2, nebo přibližně 190 krát maximální doporučenou denní perorální dávka u kojenců na mg/m2. U hlodavců byl cílem akutní toxicity centrální nervový systém a cílem toxicity po opakovaných dávkách byla játra.
dávkování & podání
cetirizin hydrochlorid perorální roztok, USP lze užívat bez ohledu na spotřebu potravin.
Děti od 2 do 5 Let pro Chronickou Kopřivkou: doporučená počáteční dávka přípravku Cetirizin Hydrochlorid Perorální Roztok, USP u dětí ve věku 2 až 5 let je 2,5 mg (½ lžičky) perorálního roztoku jednou denně. Dávkování v této věkové skupině může být zvýšena na maximální dávku 5 mg denně, podávaná jako 1 čajovou lžičku perorální roztok jednou denně, nebo jedna ½ lžičky perorální roztok podáván každých 12 hodin.
Děti od 6 měsíců do < 2 roky pro Celoroční Alergická Rýma a Chronická Kopřivka: doporučená dávka přípravku Cetirizin Hydrochlorid Perorální Roztok, USP u dětí od 6 měsíců do 23 měsíců věku je 2,5 mg (½ lžičky) jednou denně. Dávka u dětí ve věku 12 až 23 měsíců může být zvýšena na maximální dávku 5 mg denně, podávaná jako ½ čajové lžičky (2, 5 mg) každých 12 hodin.
jak se cetirizin dodává
cetirizin hydrochlorid perorální roztok, USP 5 mg/5 mL (1 mg / mL)je bezbarvý až slabě žlutý perorální roztok dodávaný v lahvičkách o objemu 120 ml.
Láhve 120 mL NDC 13668-029-07
Cetirizin Hydrochlorid Perorální Roztok, USP 5 mg/5 mL (1 mg/mL) je bezbarvý až světle žlutý perorální roztok se dodává v lahvičkách o objemu 480 mL.
Láhve 480 mL NDC 13668-029-11
SKLADOVÁNÍ
Skladujte při 20°-25°C (68°-77°F); exkurze povoleno 15°-30°C (59°-86°F) .
Rx Only
výrobce:
Bio-Pharm, Inc.
Levittown, PA 19057
vyrobeno pro:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? A před nebo po nějakém konkrétním jídle?
Více o cetirizin
- Nežádoucí Účinky
- Během Těhotenství nebo Kojení
- Dávkování Informací
- Pacient Tipy
- Léku Obrázky
- lékové Interakce
- Porovnat Alternativy
- Podpůrné Skupiny
- Ceny & Kupóny
- 225 Recenze
- třídy Drog: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 další
související průvodce léčbou
- alergická rýma
- kopřivka
- dysfunkce Eustachovy trubice
- fyzická kopřivka
lékařské upozornění
Leave a Reply