Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. A Denominação química é ácido ( ± ) – 1-piperazinil] etoxi] acético, dicloridrato. O cloridrato de cetirizina é um composto racêmico com uma fórmula empírica de C21H25ClN2O3 * 2HCl. O peso molecular é 461.82 e a estrutura química é mostrada abaixo:
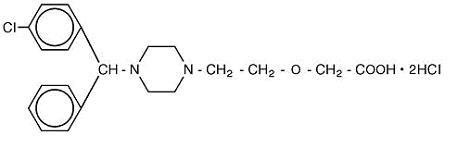
Cetirizine dihydrochloride é um branco ou quase branco de pó e é solúvel em água, praticamente insolúvel em acetona e em cloreto de metileno. Solução Oral de cloridrato de cetirizina, USP é uma solução oral incolor a ligeiramente amarelada contendo cloridrato de cetirizina numa concentração de 1 mg/mL (5 mg/5 mL) para administração oral. O pH está entre 4 e 5. Os ingredientes inactivos da solução oral são: ácido acético glacial, sabor de uva, glicerina, metilparabeno, propilenoglicol, propilparabeno, acetato de sódio, sacarose e água purificada.mecanismo de acção: a cetirizina, um metabolito humano da hidroxizina, é um anti-histamínico.; os seus principais efeitos são mediados através da inibição selectiva dos receptores H1 periféricos. A actividade anti-histamínica da cetirizina foi claramente documentada numa variedade de modelos animais e humanos. Modelos animais In vivo e ex vivo demonstraram uma actividade anticolinérgica e anti-serotoninérgica negligenciável. Em estudos clínicos, no entanto, a boca seca foi mais comum com cetirizina do que com placebo. Os estudos in vitro de ligação aos receptores não demonstraram afinidade mensurável para outros receptores que não os receptores H1. Estudos autoradiográficos com cetirizina marcada radioactivamente no rato revelaram uma penetração negligenciável no cérebro. Experiências Ex vivo no rato demonstraram que a cetirizina administrada sistemicamente não ocupa significativamente os receptores H1 cerebrais.absorção: a cetirizina foi rapidamente absorvida com um tempo até à concentração máxima (t max) de aproximadamente 1 hora após a administração oral de comprimidos ou solução oral em adultos. Verificou-se uma biodisponibilidade comparável entre as formas de dosagem do comprimido e da solução oral. Quando se administrou a voluntários saudáveis doses múltiplas de cetirizina (comprimidos de 10 mg uma vez por dia durante 10 dias), observou-se uma concentração plasmática máxima média (C max) de 311 ng/mL. Não foi observada acumulação. A farmacocinética da cetirizina foi linear para doses orais que variaram entre 5 e 60 mg. Os alimentos não tiveram efeito na extensão da exposição à cetirizina (AUC), mas a T max foi atrasada 1, 7 horas e A C max diminuiu 23% na presença de alimentos.distribuição: A ligação média da cetirizina às proteínas plasmáticas é de 93%, independentemente da concentração no intervalo de 25-1000 ng/mL, o que inclui os níveis plasmáticos terapêuticos observados.metabolismo: um estudo de balanço de massa em 6 voluntários saudáveis do sexo masculino indicou que 70% da radioactividade administrada foi recuperada na urina e 10% nas fezes. Aproximadamente 50% da radioactividade foi identificada na urina como fármaco inalterado. A maior parte do aumento rápido do Pico de radioactividade plasmática foi associada ao fármaco original, sugerindo um baixo grau de metabolismo de primeira passagem. A cetirizina é metabolizada de forma limitada por o-desalquilação oxidativa a um metabolito com actividade anti-histamínica negligenciável. A enzima ou enzimas responsáveis por este metabolismo não foram identificadas.eliminação: a semi-vida de eliminação média em 146 voluntários saudáveis durante vários estudos farmacocinéticos foi de 8, 3 horas e a depuração corporal total aparente da cetirizina foi de aproximadamente 53 mL/min.os estudos de interacção farmacocinética com cetirizina em adultos foram realizados com pseudoefedrina, antipirina, cetoconazol, eritromicina e azitromicina.não se observaram interacções. Num estudo de dose múltipla de teofilina (400 mg uma vez por dia durante 3 dias) e cetirizina (20 mg uma vez por dia durante 3 dias), observou-se uma diminuição de 16% na depuração da cetirizina. A disposição da teofilina não foi alterada pela administração concomitante de cetirizina.Populações Especiais doentes pediátricos: Em doentes pediátricos com idades compreendidas entre os 2 e os 5 anos que receberam 5 mg de cetirizina, A C média máxima foi de 660 ng/mL. Com base em comparações de estudos cruzados, a depuração corporal total aparente normalizada e aparente foi 81-111% maior e a semi-vida de eliminação foi 33 a 41% mais Curta na população pediátrica do que nos adultos. Em doentes pediátricos com idades compreendidas entre os 6 e os 23 meses que receberam uma dose única de 0, 25 mg/kg de Solução oral de cetirizina (dose média de 2, 3 mg), A C máxima média foi de 390 ng/mL. Com base em comparações de estudos cruzados, a depuração corporal total aparente normalizada em peso foi 304% maior e a semi-vida de eliminação foi 63% mais Curta nesta população pediátrica em comparação com adultos. A AUC média(0-t) em crianças de 6 meses a
2 anos de idade a receber a dose máxima de solução de cetirizina (2, 5 mg duas vezes por dia) deverá ser duas vezes superior à observada em adultos a receber uma dose de 10 mg de comprimidos de cetirizina uma vez por dia.efeito do género: o efeito do género na farmacocinética da cetirizina não foi adequadamente estudado.efeito da raça: não foram observadas diferenças na cinética da cetirizina relacionadas com a raça.
farmacodinâmica: o cloridrato de cetirizina, em doses de 5 e 10 mg, inibiu fortemente a pústula e a exacerbação causadas pela injecção intradérmica de histamina em 19 voluntários pediátricos (com idades entre os 5 e os 12 anos) e a actividade persistiu durante pelo menos 24 horas. Num estudo de 35 dias realizado em crianças com idades compreendidas entre os 5 e os 12 anos, não foi observada tolerância aos efeitos anti-histamínicos (supressão da resposta wheal e flare) do cloridrato de cetirizina. Em 10 de bebês de 7 a 25 meses de idade que receberam de 4 a 9 dias de Cetirizine em uma solução oral (0,25 mg/kg bid), houve 90% de inibição da induzida por histamina (10 mg/mL) cutânea pápula e 87% de inibição dos reflexos 12 horas após a administração da última dose. Desconhece-se a relevância clínica desta supressão da resposta de flare e de wheal induzida pela histamina nos testes cutâneos.os efeitos da injecção intradérmica de vários outros mediadores ou releasers de histamina também foram inibidos pela cetirizina, como foi a resposta a um desafio de constipação em doentes com urticária induzida a frio. Em indivíduos ligeiramente asmáticos, o cloridrato de cetirizina com 5 a 20 mg de broncoconstrição bloqueada devido a histamina nebulizada, com bloqueio virtualmente total após uma dose de 20 mg. Em estudos realizados até 12 horas após a provocação cutânea do antigénio, o recrutamento tardio de eosinófilos, neutrófilos e basófilos, Componentes da resposta inflamatória alérgica, foi inibido pelo cloridrato de cetirizina numa dose de 20 mg. Em quatro estudos clínicos em adultos saudáveis do sexo masculino, não foram observados aumentos médios clinicamente significativos da QTc em indivíduos tratados com cloridrato de cetirizina. No primeiro estudo, um ensaio cruzado controlado com placebo, o cloridrato de cetirizina foi administrado em doses até 60 mg por dia, 6 vezes a dose clínica máxima, durante 1 semana, e não ocorreu prolongamento QTc médio significativo. No segundo estudo, num ensaio cruzado, foram administrados 20 mg de cloridrato de cetirizina e eritromicina (500 mg de 8 em 8 horas) em monoterapia e em associação. Não houve efeito significativo no QTc com a associação ou apenas com cloridrato de cetirizina. No terceiro ensaio, também num estudo cruzado, foram administrados 20 mg de cloridrato de cetirizina e 400 mg de cetoconazol (400 mg por dia) em monoterapia e em associação.o cloridrato de cetirizina causou um aumento médio do QTc de 9, 1 mseg do valor basal após 10 dias de tratamento. O cetoconazol também aumentou o QTc em 8, 3 mseg. A combinação provocou um aumento de 17,4 mseg, igual à soma dos efeitos individuais. Assim, não houve interacção significativa do fármaco no QTc com a associação de cloridrato de cetirizina e cetoconazol. No quarto estudo, um ensaio paralelo controlado com placebo, o cloridrato de cetirizina 20 mg foi administrado isoladamente ou em associação com azitromicina (500 mg numa dose única no primeiro dia seguido de 250 mg uma vez por dia). Não houve aumento significativo no intervalo QTc com 20 mg de cloridrato de cetirizina em monoterapia ou em associação com azitromicina. Num ensaio clínico de quatro semanas em doentes pediátricos com idades compreendidas entre os 6 e os 11 anos, os resultados de medições de ECG obtidas aleatoriamente antes do tratamento e após 2 semanas de tratamento demonstraram que o cloridrato de cetirizina 5 ou 10 mg não aumentou o QTc versus placebo. Em uma semana de ensaios clínicos (N=86) de Cloridrato de Cetirizina Solução Oral, USP (0,25 mg/kg bid) em comparação com placebo em pacientes pediátricos de 6 a 11 meses de idade, ECG medidas tomadas dentro de 3 horas da última dose não mostraram anormalidades no ECG ou aumento do intervalo QTc em qualquer grupo, em comparação com avaliações de base. Os dados de outros estudos em que o cloridrato de cetirizina foi administrado a doentes com 6-23 meses de idade foram consistentes com os resultados deste estudo.os efeitos do cloridrato de cetirizina no intervalo QTc em doses superiores a 10 mg não foram estudados em crianças com menos de 12 anos de idade. Num estudo de seis semanas, controlado com placebo, em 186 doentes (com idades compreendidas entre os 12 e os 64 anos) com rinite alérgica e asma ligeira a moderada, o cloridrato de cetirizina 10 mg uma vez por dia melhorou os sintomas da rinite e não alterou a função pulmonar. Num ensaio clínico de duas semanas, controlado com placebo, uma análise de um subgrupo de 65 doentes pediátricos (com idades compreendidas entre os 6 e os 11 anos) com rinite alérgica, com asma, demonstrou que o cloridrato de cetirizina não alterou a função pulmonar. Estes estudos apoiam a segurança da administração de cloridrato de cetirizina a doentes pediátricos e adultos com rinite alérgica ligeira a moderada.estudos clínicos
: foram realizados nos Estados Unidos ensaios clínicos multicêntricos, aleatorizados, em dupla ocultação, comparando a cetirizina 5 a 20 mg com placebo em doentes com idade igual ou superior a 12 anos com rinite alérgica perene. Dois destes apresentaram reduções significativas nos sintomas da rinite alérgica perene durante até 8 semanas de duração. Foram também realizados dois ensaios clínicos, multicêntricos, aleatorizados e em dupla ocultação, que compararam 5 a 20 mg de cetirizina com placebo em doentes com urticária idiopática crónica, e mostraram melhoria significativa nos sintomas de urticária idiopática crónica. De um modo geral, a dose de 10 mg foi mais eficaz do que a dose de 5 mg e a dose de 20 mg não produziu qualquer Efeito Adicional. Alguns destes ensaios incluíram doentes pediátricos com idades compreendidas entre os 12 e os 16 anos. Além disso, foram realizados nos Estados Unidos quatro ensaios multicêntricos, aleatorizados, controlados com placebo, de 2-4 semanas em 534 doentes pediátricos com idades compreendidas entre os 6 e os 11 anos com rinite alérgica sazonal em doses até 10 mg.
INDICAÇÕES & de USO
a Rinite Alérgica Perene: Cloridrato de Cetirizina Solução Oral, a USP é indicado para o alívio dos sintomas associados a rinite alérgica perene devido a alérgenos, como os ácaros, fungos e raiva animal em crianças de 6 a 23 meses de idade. Os sintomas tratados de forma eficaz incluem espirros, rinorreia, descarga pós-nasal, prurido nasal, prurido ocular e lacrimejar.urticária crónica: cloridrato de cetirizina Solução Oral, USP está indicado no tratamento das manifestações cutâneas não complicadas da urticária idiopática crónica em crianças dos 6 meses aos 5 anos de idade. Reduz significativamente a ocorrência, gravidade e duração das urticária e reduz significativamente o prurido.
contra-indicações
cloridrato de cetirizina Solução Oral, USP está contra-indicado nos doentes com hipersensibilidade conhecida a ele ou a qualquer um dos seus componentes ou hidroxizina.
precauções
actividades que requerem Estado de alerta Mental: em ensaios clínicos, foi notificada a ocorrência de sonolência em alguns doentes a tomar cloridrato de cetirizina; devem, portanto, ser tomadas precauções durante a condução de viaturas ou utilização de máquinas potencialmente perigosas. A utilização concomitante de cloridrato de cetirizina com álcool ou outros depressores do SNC deve ser evitada, uma vez que podem ocorrer reduções adicionais no estado de alerta e diminuição adicional do desempenho do SNC.Interacções medicamentosas: não foram observadas interacções medicamentosas clinicamente significativas com teofilina numa dose baixa, azitromicina, pseudoefedrina, cetoconazol ou eritromicina. Verificou-se uma pequena diminuição na depuração da cetirizina causada por uma dose de 400 mg de teofilina; é possível que doses maiores de teofilina possam ter um efeito maior.carcinogénese, mutagénese e diminuição da fertilidade: num estudo de carcinogenicidade de 2 anos em ratos, a cetirizina não foi carcinogénica em doses dietéticas até 20 mg/kg (aproximadamente 15 vezes a dose oral diária máxima recomendada em adultos numa base de mg/m 2, ou aproximadamente 7 vezes a dose oral diária máxima recomendada em lactentes numa base de mg/m 2). Num estudo de carcinogenicidade de 2 anos em ratinhos, a cetirizina causou um aumento da incidência de tumores hepáticos benignos em machos numa dose dietética de 16 mg/kg (aproximadamente 6 vezes a dose oral diária máxima recomendada em adultos numa base de mg/m 2, ou aproximadamente 3 vezes a dose oral diária máxima recomendada em lactentes numa base de mg/m 2). Não se observou aumento na incidência de tumores hepáticos em ratinhos com uma dose dietética de 4 mg/kg (aproximadamente 2 vezes a dose oral diária máxima recomendada em adultos com base em mg/m 2, ou aproximadamente equivalente à dose oral diária máxima recomendada em lactentes com base em mg/m 2). Desconhece-se o significado clínico destes resultados durante a utilização a longo prazo de cloridrato de cetirizina.a cetirizina não foi mutagénica no teste de Ames nem clastogénica no ensaio de linfócitos humanos, no ensaio de linfoma no ratinho e no teste de micronúcleos in vivo em ratos.num estudo de fertilidade e desempenho reprodutivo geral em ratinhos, a cetirizina não afectou a fertilidade numa dose oral de 64 mg/kg (aproximadamente 25 vezes a dose diária máxima recomendada em adultos com base em mg/m 2).Utilização Pediátrica: a segurança do cloridrato de cetirizina foi demonstrada em doentes pediátricos com idades compreendidas entre os 6 e os 5 anos. A segurança da cetirizina foi demonstrada em 168 doentes com idades entre 2 e 5 anos em ensaios controlados com placebo com duração até 4 semanas. Numa base de mg/kg, a maioria dos 168 doentes recebeu entre 0, 2 e 0, 4 mg / kg de HCl de cetirizina. A segurança da cetirizina em 399 doentes com idades compreendidas entre os 12 e os 24 meses foi demonstrada num ensaio de 18 meses controlado com placebo, no qual a dose média foi
0, 25 mg/kg duas vezes por dia, correspondendo a um intervalo de 4 a 11 mg/dia. A segurança da Solução Oral de cloridrato de cetirizina, USP foi demonstrada em 42 doentes com idades compreendidas entre os 6 e os 11 meses num ensaio de 7 dias controlado com placebo. A dose prescrita foi de 0,25 mg/kg bid, o que correspondeu a uma média de 4,5 mg/dia, com um intervalo de 3,4 6,2 mg/dia.
A eficácia do cloridrato de Cetirizina para o tratamento da rinite alérgica e urticária idiopática crónica em doentes pediátricos com idade entre 6 a 5 anos é com base na extrapolação dos demonstrado a eficácia do cloridrato de Cetirizina em adultos com estas condições e a probabilidade de que o curso da doença, a fisiopatologia e do efeito da droga, são substancialmente similares entre estas duas populações. A eficácia é extrapolada para os 6 meses de idade para a rinite alérgica perene, porque pensa-se que esta doença ocorre até estas idades em crianças. As doses recomendadas para a população pediátrica baseiam-se em comparações cruzadas entre a farmacocinética e farmacodinâmica da cetirizina em indivíduos adultos e pediátricos e no perfil de segurança da cetirizina em doentes adultos e pediátricos em doses iguais ou superiores às doses recomendadas. A AUC e a C max da cetirizina em indivíduos pediátricos com idades compreendidas entre os 6 e os 23 meses que receberam uma média de 2.3 mg em dose única e em indivíduos com idade entre 2 a 5 anos que receberam uma dose única de 5 mg de Cetirizina solução oral, foi estimada a ser intermediário entre o que a observada em adultos que receberam uma dose única de 10 mg de Cetirizine tablets e aqueles que receberam uma dose única de 20 mg de Cetirizine tablets.a segurança e eficácia da cetirizina em doentes pediátricos com idade inferior a 6 meses não foram estabelecidas.reacções adversas
foram realizados estudos pediátricos com cloridrato de cetirizina. Mais de 1300 doentes pediátricos com idades compreendidas entre os 6 e os 11 anos com mais de 900 tratados com cloridrato de cetirizina em doses de 1, 25 a 10 mg por dia foram incluídos em ensaios clínicos controlados e não controlados realizados nos Estados Unidos. A duração do tratamento variou entre 2 e 12 semanas. Os ensaios controlados com Placebo até 4 semanas de duração incluíram 168 doentes pediátricos com idades compreendidas entre os 2 e os 5 anos que receberam cetirizina, a maioria dos quais recebeu doses únicas diárias de 5 mg. Um ensaio controlado com placebo com a duração de 18 meses incluiu 399 doentes com idades compreendidas entre os 12 e os 24 meses tratados com cetirizina (0.25 mg / kg duas vezes por dia), e outro ensaio controlado com placebo com a duração de 7 dias incluiu 42 doentes com idades compreendidas entre os 6 e os 11 meses que foram tratados com cetirizina (0, 25 mg/kg duas vezes por dia).a maioria das reacções adversas notificadas em doentes pediátricos com idades compreendidas entre os 2 e os 11 anos com cloridrato de cetirizina foram ligeiras a moderadas. Em ensaios controlados com placebo, a incidência de interrupções devido a reacções adversas em doentes pediátricos que receberam até 10 mg de cloridrato de cetirizina foi pouco frequente (0, 4% com cloridrato de cetirizina vs. 1, 0% com placebo).
A Tabela 1 apresenta as reacções adversas que foram notificadas para 5 e 10 mg de cloridrato de cetirizina em doentes pediátricos com idades compreendidas entre os 6 e os 11 anos em ensaios clínicos controlados com placebo nos Estados Unidos e que foram mais frequentes com cloridrato de cetirizina do que com placebo. Destes, a dor abdominal foi considerada relacionada com o tratamento e a sonolência pareceu estar relacionada com a dose, 1, 3% no placebo, 1, 9% com 5 mg e 4, 2% com 10 mg. As experiências adversas notificadas em doentes pediátricos com idades compreendidas entre os 2 e os 5 anos em ensaios controlados com placebo foram qualitativamente semelhantes em natureza e geralmente semelhantes em frequência às notificadas em ensaios com crianças com idades compreendidas entre os 6 e os 11 anos.nos ensaios clínicos controlados com placebo em doentes pediátricos dos 6 aos 24 meses de idade, a incidência de reacções adversas foi semelhante nos grupos de tratamento com cetirizina e placebo em cada estudo. A sonolência ocorreu com essencialmente a mesma frequência em doentes que receberam cetirizina e em doentes que receberam placebo. Num estudo com a duração de 1 semana em crianças entre os 6 e os 11 meses de idade, os doentes que receberam cetirizina apresentaram maior irritabilidade/Irritabilidade do que os doentes que receberam placebo. Num estudo com a duração de 18 meses em doentes com idade igual ou superior a 12 meses, a insónia ocorreu mais frequentemente em doentes que receberam cetirizina do que em doentes que receberam placebo (9, 0% v. 5, 3%). Naqueles pacientes que receberam 5 mg ou mais por dia de Cetirizine em comparação com os pacientes que receberam placebo, fadiga (3.6% versus 1,3%) e mal-estar (3.6% v. 1.8%) ocorreu com mais frequência.Tabela 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Broncoespasmo | 1.9% | 3.1% | 1.9% |
| Náuseas | 1.9% | 1.9% | 2.8% |
| Vômitos | 1.0% | 2.5% | 2.3% |
Os seguintes eventos foram observados com pouca frequência (menos de 2%), em 3982 adultos e crianças com 12 anos e mais velhos ou em 659 pacientes pediátricos de 6 a 11 anos que receberam cloridrato de Cetirizina nos EUA ensaios, incluindo um abrir de adultos estudo de seis meses de duração. Não foi estabelecida uma relação causal destes acontecimentos pouco frequentes com a administração de cloridrato de cetirizina.Sistema Nervoso Autónomo: anorexia, rubor, aumento da salivação, retenção urinária.Cardiovascular: insuficiência cardíaca, hipertensão, palpitações, taquicardia.
sistema Nervoso Central e Periférico: coordenação anormal, ataxia, confusão, disfonia, hyperesthesia, hipercinesia, hipertonia, hipoestesia, cãibras nas pernas, enxaqueca, mielite, paralisia, parestesia, ptose, síncope, tremor, convulsões, vertigem, campo visual defeito.
gastrointestinais: função hepática anormal, cáries dentárias agravadas, obstipação, dispepsia, eructação, flatulência, gastrite, hemorróidas, aumento do apetite, melena, hemorragia rectal, estomatite incluindo estomatite ulcerativa, descoloração da língua, edema da língua.Genitourinary: cistite, disúria, hematúria, frequência de micção, poliúria, incontinência urinária, infecção do tracto urinário.audição e Vestibular: surdez, dores de ouvido, ototoxicidade, zumbido.metabólico / nutricional: desidratação, diabetes mellitus, sede.afecções musculosqueléticas e dos tecidos conjuntivos: artralgia, artrite, artrose, fraqueza muscular, mialgia.perturbações do foro psiquiátrico: pensamentos anormais, agitação, amnésia, ansiedade, diminuição da libido, despersonalização, depressão, instabilidade emocional, euforia, diminuição da concentração, insónia, nervosismo, paroniria, perturbação do sono.doenças respiratórias: bronquite, dispneia, hiperventilação, aumento do expectoração, pneumonia, alterações respiratórias, rinite, sinusite, infecção do tracto respiratório superior.dismenorreia, dor mamária feminina, hemorragia inter-menstrual, leucorreia, menorragia, vaginite.reticuloendotelial: linfadenopatia.
Pele: acne, alopecia, angioedema, erupção bolhosa, dermatite, pele seca, eczema, erupção cutânea eritematosa, furunculose, hiperqueratose, hipertricose, aumento da transpiração, erupção cutânea maculopapular, reação de fotossensibilidade, fotossensibilidade reação tóxica, prurido, púrpura, urticária, seborréia, doença de pele, nódulo cutâneo, urticária.sentidos especiais: parosmia, perda do paladar, Alteração do paladar.visão: cegueira, conjuntivite, dor ocular, glaucoma, perda de acomodação, hemorragia ocular, xeroftalmia.corpo no seu todo: lesão acidental, astenia, dor nas costas, dor no peito, aumento do abdómen, edema facial, febre, edema generalizado, afrontamentos, aumento de peso, edema da perna, mal-estar, pólipo nasal, dor, palidez, edema periorbital, edema periférico, rigidez.durante a terapêutica com cetirizina ocorreram casos ocasionais de elevações transitórias e reversíveis das transaminases hepáticas. Foi notificada hepatite com elevação significativa das transaminases e bilirrubina elevada associada à utilização de cloridrato de cetirizina.
a Experiência Pós-Marketing
Em período pós-comercialização, os seguintes adicionais rara, mas potencialmente graves eventos adversos foram relatados: reação agressiva, anafilaxia, colestase, convulsões, glomerulonefrite, alucinações, anemia hemolítica, hepatite, discinesia orofacial, hipotensão grave, parto de natimorto, ideação suicida, suicídio, trombocitopenia e pustulose exantemática generalizada aguda (AGEP).para notificar suspeitas de reacções adversas, contacte a Torrent Pharma Inc. a 800-912-9561 ou FDA a 1-800-FDA-1088 ou www.fda.gov/medwatch.
abuso e dependência de drogas
não há informação que indique que o abuso ou dependência ocorre com cloridrato de cetirizina.foi notificada sobredosagem com cloridrato de cetirizina. Num doente adulto que tomou 150 mg de cloridrato de cetirizina, o doente foi sonolento mas não apresentou quaisquer outros sinais clínicos ou resultados anormais de hemoterapia ou Hematologia. Num doente pediátrico com 18 meses de idade que tomou uma sobredosagem com cloridrato de cetirizina (aproximadamente 180 mg), observou-se inicialmente inquietação e irritabilidade.; isto foi seguido por sonolência. Caso ocorra sobredosagem, o tratamento deve ser sintomático ou de suporte, tendo em conta qualquer medicação ingerida concomitantemente. Não existe antídoto específico conhecido para o cloridrato de cetirizina. O cloridrato de cetirizina não é eficazmente removido por diálise, e a diálise será ineficaz a menos que um agente dialisável tenha sido ingerido concomitantemente. A aguda mínima letal oral de doses foram 237 mg/kg em ratos (cerca de 95 vezes a diária máxima recomendada em dose oral, em adultos, em mg/m2), ou cerca de 40 vezes a diária máxima recomendada em dose oral em crianças em mg/m2) e 562 mg/kg em ratos (aproximadamente 460 vezes a diária máxima recomendada em dose oral, em adultos, em mg/m2), ou cerca de 190 vezes a diária máxima recomendada em dose oral em crianças em mg/m2. Em roedores, o alvo de toxicidade aguda foi o sistema nervoso central, e o alvo de toxicidade de dose múltipla foi o fígado.dose& administração
solução Oral de cloridrato de cetirizina, USP pode ser tomado independentemente do consumo de alimentos.
Crianças dos 2 aos 5 anos para urticária crónica: a dose inicial recomendada de Solução Oral de cloridrato de cetirizina, USP em crianças dos 2 aos 5 anos de idade é de 2, 5 mg (½ colher de chá) solução oral uma vez por dia. A dose neste grupo etário pode ser aumentada para uma dose máxima de 5 mg por dia, administrada como uma solução oral de colher de chá uma vez por dia, ou uma solução oral de ½ colher de chá administrada de 12 em 12 horas.
crianças com 6 meses a
2 anos para rinite alérgica perene e urticária crónica: a dose recomendada de Solução Oral de cloridrato de cetirizina, USP em crianças dos 6 meses aos 23 meses de idade é de 2, 5 mg (½ colher de chá) uma vez por dia. A dose em crianças dos 12 aos 23 meses de idade pode ser aumentada para uma dose máxima de 5 mg por dia, administrada como ½ colher de chá (2, 5 mg) de 12 em 12 horas.solução Oral de cloridrato de cetirizina, USP 5 mg/5 mL (1mg / mL) é uma solução oral incolor a ligeiramente amarelada fornecida em frascos de 120 mL.frascos de 120 mL NDC 13668-029-07 solução Oral de cloridrato de cetirizina, USP 5 mg/5 mL (1 mg / mL) é uma solução oral incolor a ligeiramente amarela fornecida em frascos de 480 mL.frascos de 480 mL NDC 13668-029-11
armazenamento
armazenamento a 20 ° -25 ° C( 68 ° -77 ° F); excursões Permitidas a 15°-30°C (59°-86°F).
Rx apenas
fabricado por:
Bio-Pharm, Inc.Levittown, PA 19057 fabricado para TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? E antes ou depois de alguma refeição em particular?
Mais sobre o cetirizine
- Efeitos Colaterais
- Durante a Gravidez ou a Amamentação
- Informação sobre a Dosagem
- Paciente Dicas
- Droga Imagens
- Interações Medicamentosas
- Comparar Alternativas
- Grupo de Apoio
- Preço & Cupons
- 225 Comentários
- classe de Drogas: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … +Mais 3
Relacionados guias de tratamento
- Rinite Alérgica
- Urticária
- Disfunção da trompa de Eustáquio
- Urticária Física
Medical Disclaimer
Leave a Reply