Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Det kemiska namnet är (kub) – – 1-piperazinyl] etoxi] ättiksyra, dihydroklorid. Cetirizinhydroklorid är en racemisk förening med en empirisk formel av C21H25ClN2O3 •2HCl. Molekylvikten är 461,82 och den kemiska strukturen visas nedan:
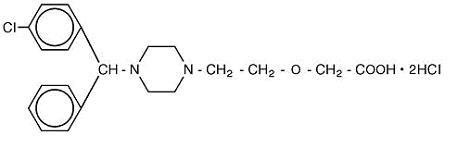
Cetirizindihydroklorid är ett vitt eller nästan vitt pulver och är fritt lösligt i vatten, praktiskt taget olösligt i aceton och i metylenklorid. Cetirizinhydroklorid Oral lösning, USP är en färglös till svagt gul oral lösning innehållande cetirizinhydroklorid i en koncentration av 1 mg/mL (5 mg/5 mL) för oral administrering. PH är mellan 4 och 5. De inaktiva ingredienserna i den orala lösningen är: isättika, druvsmak, glycerin, metylparaben, propylenglykol, propylparaben, natriumacetat, sackaros och renat vatten.
cetirizin – klinisk farmakologi
verkningsmekanism: cetirizin, en human metabolit av hydroxyzin, är en antihistamin; dess huvudsakliga effekter förmedlas via selektiv hämning av perifera H1-receptorer. Den antihistaminiska aktiviteten hos cetirizin har tydligt dokumenterats i en mängd olika djur-och mänskliga modeller. In vivo och ex vivo djurmodeller har visat försumbar antikolinerg och anti-serotonerg aktivitet. I kliniska studier var muntorrhet dock vanligare med cetirizin än med placebo. In vitro-receptorbindningsstudier har inte visat någon mätbar affinitet för andra än H1-receptorer. Autoradiografiska studier med radiomärkt cetirizin hos råtta har visat försumbar penetration i hjärnan. Ex vivo-experiment i musen har visat att systemiskt administrerat cetirizin inte signifikant upptar cerebrala H1-receptorer.
farmakokinetik:
Absorption: cetirizin absorberades snabbt med en tid till maximal koncentration (t max) på cirka 1 timme efter oral administrering av tabletter eller oral lösning hos vuxna. Jämförbar biotillgänglighet hittades mellan doseringsformerna tablett och oral lösning. När friska frivilliga gavs flera doser cetirizin (10 mg tabletter en gång dagligen i 10 dagar) observerades en genomsnittlig maximal plasmakoncentration (C max) på 311 ng/mL. Ingen ackumulering observerades. Cetirizins farmakokinetik var linjär för orala doser från 5 till 60 mg. Livsmedel hade ingen effekt på omfattningen av Cetirizinexponeringen (AUC) men T max fördröjdes med 1,7 timmar och c max minskade med 23% i närvaro av livsmedel.
Distribution: Den genomsnittliga plasmaproteinbindningen av cetirizin är 93%, oberoende av koncentrationen i intervallet 25-1000 ng/mL, vilket inkluderar de observerade terapeutiska plasmanivåerna.
Metabolism: en massbalansstudie på 6 friska manliga frivilliga visade att 70% av den administrerade radioaktiviteten återfanns i urinen och 10% i avföringen. Cirka 50% av radioaktiviteten identifierades i urinen som oförändrat läkemedel. Det mesta av den snabba ökningen av maximal plasmaradioaktivitet var associerad med moderläkemedel, vilket tyder på en låg grad av första passage-metabolism. Cetirizin metaboliseras i begränsad utsträckning genom oxidativ o-dealkylering till en metabolit med försumbar antihistaminaktivitet. Enzymet eller enzymerna som är ansvariga för denna metabolism har inte identifierats.
eliminering: den genomsnittliga halveringstiden för eliminering hos 146 friska frivilliga i flera farmakokinetiska studier var 8,3 timmar och den skenbara totala clearance för cetirizin var cirka 53 mL/min.
interaktionsstudier
farmakokinetiska interaktionsstudier med cetirizin hos vuxna utfördes med pseudoefedrin, antipyrin, ketokonazol, erytromycin och azitromycin.
inga interaktioner observerades. I en flerdosstudie av teofyllin (400 mg en gång dagligen i 3 dagar) och cetirizin (20 mg en gång dagligen i 3 dagar) observerades en minskning av clearance av cetirizin med 16%. Dispositionen av teofyllin ändrades inte vid samtidig administrering av cetirizin.
särskilda populationer
pediatriska patienter: Hos pediatriska patienter i åldern 2 till 5 år som fick 5 mg cetirizin var medelvärdet c max 660 ng/mL. Baserat på jämförelser mellan studier var vikten normaliserad, uppenbar Total kroppsclearance 81-111% större och eliminationshalveringstiden var 33 till 41% kortare i den pediatriska populationen än hos vuxna. Hos pediatriska patienter i åldern 6 till 23 månader som fick en enstaka dos på 0, 25 mg/kg cetirizin oral lösning (medeldos 2, 3 mg) var medelvärdet c max 390 ng/mL. Baserat på jämförelser mellan studier var den viktnormaliserade, uppenbara totala kroppsclearance 304% större och eliminationshalveringstiden var 63% kortare i denna pediatriska population jämfört med vuxna. Den genomsnittliga AUC (0-t) hos barn 6 månader till < 2 år som får maximal dos av Cetirizinlösning (2, 5 mg två gånger dagligen) förväntas vara dubbelt högre än den som observerats hos vuxna som får en dos på 10 mg Cetirizintabletter en gång dagligen.
effekt av kön: effekten av kön på cetirizins farmakokinetik har inte studerats tillräckligt.
effekt av ras: inga rasrelaterade skillnader i kinetiken för cetirizin har observerats.
farmakodynamik: cetirizinhydroklorid vid doser på 5 och 10 mg hämmade kraftigt wheal och flare orsakad av intradermal injektion av histamin hos 19 pediatriska frivilliga (i åldern 5 till 12 år) och aktiviteten kvarstod i minst 24 timmar. I en 35-dagars studie på barn i åldern 5 till 12 år hittades ingen tolerans mot de antihistaminiska (undertryckande av wheal och flare response) effekterna av cetirizinhydroklorid. Hos 10 spädbarn i åldern 7 till 25 månader som fick 4 till 9 dagars cetirizin i en oral lösning (0, 25 mg/kg två gånger dagligen) var det en 90% hämning av histamininducerad (10 mg/mL) kutan wheal och 87% hämning av flare 12 timmar efter administrering av den sista dosen. Den kliniska relevansen av detta undertryckande av histamininducerat wheal-och flare-svar vid hudtestning är okänd.
effekterna av intradermal injektion av olika andra mediatorer eller histaminfrisättande medel hämmades också av cetirizin, liksom svaret på en kall utmaning hos patienter med kallinducerad urtikaria. Hos milt astmatiska personer blockerade cetirizinhydroklorid vid 5 till 20 mg bronkokonstriktion på grund av nebuliserad histamin, med praktiskt taget total blockad efter en dos på 20 mg. I studier utförda i upp till 12 timmar efter kutan antigenutmaning hämmades senfasrekryteringen av eosinofiler, neutrofiler och basofiler, komponenter i det allergiska inflammatoriska svaret, av cetirizinhydroklorid i en dos av 20 mg. I fyra kliniska studier på friska vuxna män observerades inga kliniskt signifikanta genomsnittliga ökningar av QTc hos patienter behandlade med cetirizinhydroklorid. I den första studien, en placebokontrollerad crossover-studie, gavs cetirizinhydroklorid i doser upp till 60 mg per dag, 6 gånger den maximala kliniska dosen, i 1 vecka, och ingen signifikant Genomsnittlig QTc-förlängning inträffade. I den andra studien gavs en crossover-studie, cetirizinhydroklorid 20 mg och erytromycin (500 mg var 8: e timme) ensamt och i kombination. Det fanns ingen signifikant effekt på QTc med kombinationen eller med enbart cetirizinhydroklorid. I den tredje studien, även en crossover-studie, gavs cetirizinhydroklorid 20 mg och ketokonazol (400 mg per dag) ensamt och i kombination.
cetirizinhydroklorid orsakade en genomsnittlig ökning av QTc på 9, 1 MSEK från baslinjen efter 10 dagars behandling. Ketokonazol ökade också QTc med 8,3 MSEK. Kombinationen orsakade en ökning med 17,4 MSEK, lika med summan av de enskilda effekterna. Således fanns det ingen signifikant läkemedelsinteraktion på QTc med kombinationen av cetirizinhydroklorid och ketokonazol. I den fjärde studien, en placebokontrollerad parallell studie, gavs cetirizinhydroklorid 20 mg ensamt eller i kombination med azitromycin (500 mg som en engångsdos den första dagen följt av 250 mg en gång dagligen). Det fanns ingen signifikant ökning av QTc med cetirizinhydroklorid 20 mg ensamt eller i kombination med azitromycin. I en fyra veckors klinisk studie på pediatriska patienter i åldern 6 till 11 år visade resultat av slumpmässigt erhållna EKG-mätningar före behandling och efter 2 veckors behandling att cetirizinhydroklorid 5 eller 10 mg inte ökade QTc jämfört med placebo. I en klinisk studie på en vecka (N=86) av cetirizinhydroklorid Oral lösning, USP (0, 25 mg/kg bid) jämfört med placebo hos barn 6 till 11 månaders ålder, visade EKG-mätningar som gjordes inom 3 timmar efter den sista dosen inga EKG-avvikelser eller ökningar av QTc-intervallet i någon av grupperna jämfört med baslinjebedömningar. Data från andra studier där cetirizinhydroklorid administrerades till patienter i åldern 6-23 månader överensstämde med resultaten i denna studie.
effekterna av cetirizinhydroklorid på QTc-intervallet vid doser högre än 10 mg har inte studerats hos barn under 12 år. I en sex veckors placebokontrollerad studie på 186 patienter (i åldern 12 till 64 år) med allergisk rinit och mild till måttlig astma förbättrade cetirizinhydroklorid 10 mg en gång dagligen rinitsymtomen och förändrade inte lungfunktionen. I en tvåveckors placebokontrollerad klinisk studie visade en delmängd analys av 65 pediatriska (i åldern 6 till 11 år) allergiska rinitpatienter med astma att cetirizinhydroklorid inte förändrade lungfunktionen. Dessa studier stöder säkerheten vid administrering av cetirizinhydroklorid till pediatriska och vuxna allergiska rinitpatienter med mild till måttlig astma.kliniska studier: multicenter, randomiserade, dubbelblinda kliniska prövningar som jämför cetirizin 5 till 20 mg med placebo hos patienter 12 år och äldre med perenn allergisk rinit genomfördes i USA. Två av dessa visade signifikanta minskningar av symtom på perenn allergisk rinit i upp till 8 veckor. Två 4-veckors multicenter, randomiserade, dubbelblinda kliniska prövningar som jämförde cetirizin 5 till 20 mg med placebo hos patienter med kronisk idiopatisk urtikaria genomfördes också och visade signifikant förbättring av symtomen på kronisk idiopatisk urtikaria. I allmänhet var dosen 10 mg effektivare än dosen 5 mg och dosen 20 mg gav ingen ytterligare effekt. Några av dessa studier inkluderade pediatriska patienter i åldern 12 till 16 år. Dessutom genomfördes fyra multicenter, randomiserade, placebokontrollerade, dubbelblinda 2-4 veckors studier på 534 pediatriska patienter i åldern 6 till 11 år med säsongsbunden allergisk rinit i USA vid doser upp till 10 mg.
indikationer & användning
perenn allergisk rinit: cetirizinhydroklorid Oral lösning, USP är indicerat för lindring av symtom associerade med perenn allergisk rinit på grund av allergener som dammkvalster, djurdander och mögel hos barn 6 till 23 månaders ålder. Symtom som behandlas effektivt inkluderar nysning, rhinorrhea, postnasal urladdning, nasal klåda, okulär klåda och riva.
kronisk urtikaria: cetirizinhydroklorid Oral lösning, USP är indicerat för behandling av de okomplicerade hudmanifestationerna av kronisk idiopatisk urtikaria hos barn från 6 månader till 5 år. Det minskar signifikant förekomst, svårighetsgrad och varaktighet av nässelfeber och minskar klåda avsevärt.
kontraindikationer
cetirizinhydroklorid oral lösning, USP är kontraindicerat hos de patienter med känd överkänslighet mot den eller något av dess innehållsämnen eller hydroxyzin.
försiktighetsåtgärder
aktiviteter som kräver Mental vakenhet: i kliniska prövningar har förekomsten av somnolens rapporterats hos vissa patienter som tar cetirizinhydroklorid; försiktighet bör därför iakttas vid bilkörning eller användning av potentiellt farliga maskiner. Samtidig användning av cetirizinhydroklorid med alkohol eller andra CNS-depressiva medel bör undvikas eftersom ytterligare minskning av vakenhet och ytterligare försämring av CNS-prestanda kan uppstå.
läkemedelsinteraktioner: inga kliniskt signifikanta läkemedelsinteraktioner har hittats med teofyllin i låg dos, azitromycin, pseudoefedrin, ketokonazol eller erytromycin. Det var en liten minskning av clearance av cetirizin orsakad av en 400 mg dos teofyllin; det är möjligt att större teofyllindoser kan ha större effekt.
karcinogenes, mutagenes och nedsatt fertilitet: i en 2-årig karcinogenicitetsstudie på råtta var cetirizin inte cancerframkallande vid kostdoser upp till 20 mg/kg (cirka 15 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m 2-basis eller cirka 7 gånger den maximala rekommenderade dagliga orala dosen hos spädbarn på mg / m 2-basis). I en 2-årig karcinogenicitetsstudie på möss orsakade cetirizin en ökad förekomst av godartade levertumörer hos män i en dietdos på 16 mg/kg (ungefär 6 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m 2-basis, eller ungefär 3 gånger den maximala rekommenderade dagliga orala dosen hos spädbarn på mg/m 2-basis). Ingen ökning av incidensen av levertumörer observerades hos möss vid en dietdos på 4 mg / kg (ungefär 2 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m 2-basis, eller ungefär motsvarande den maximala rekommenderade dagliga orala dosen hos spädbarn på mg/m 2-basis). Den kliniska betydelsen av dessa fynd vid långvarig användning av cetirizinhydroklorid är inte känd.
cetirizin var inte mutagent i Ames-testet och inte klastogent i humant lymfocytanalys, muslymfomanalys och in vivo mikronukleustest på råtta.
i en fertilitets-och allmän reproduktionsstudie på möss försämrade cetirizin inte fertiliteten vid en oral dos på 64 mg/kg (cirka 25 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m 2-basis).
pediatrisk användning: säkerheten för cetirizinhydroklorid har visats hos pediatriska patienter i åldern 6 till 5 år. Säkerheten för cetirizin har visats hos 168 patienter i åldern 2 till 5 år i placebokontrollerade studier på upp till 4 veckors duration. På basis av mg / kg fick de flesta av de 168 patienterna mellan 0, 2 och 0, 4 mg/kg cetirizin HCl. Säkerheten för cetirizin hos 399 patienter i åldern 12 till 24 månader har visats i en placebokontrollerad 18-månaders studie, där den genomsnittliga dosen var
0, 25 mg/kg bid, motsvarande ett intervall på 4 till 11 mg/dag. Säkerheten för cetirizinhydroklorid Oral lösning, USP har visats hos 42 patienter i åldern 6 till 11 månader i en placebokontrollerad 7-dagars studie. Den föreskrivna dosen var 0,25 mg/kg bid, vilket motsvarade ett medelvärde på 4,5 mg / dag, med ett intervall på 3,4 till 6,2 mg / dag.
effektiviteten av cetirizinhydroklorid för behandling av allergisk rinit och kronisk idiopatisk urtikaria hos barn i åldern 6 till 5 år baseras på en extrapolering av den påvisade effekten av cetirizinhydroklorid hos vuxna med dessa tillstånd och sannolikheten för att sjukdomsförloppet, patofysiologin och läkemedlets effekt är väsentligen lika mellan dessa två populationer. Effekten extrapoleras ner till 6 månaders ålder för perenn allergisk rinit eftersom denna sjukdom tros uppstå ner till dessa åldrar hos barn. De rekommenderade doserna för den pediatriska populationen baseras på jämförelser mellan studier av cetirizins farmakokinetik och farmakodynamik hos vuxna och barn och på säkerhetsprofilen för cetirizin hos både vuxna och barn i doser som är lika med eller högre än de rekommenderade doserna. Cetirizin AUC och c max hos barn i åldern 6 till 23 månader som fick ett medelvärde på 2.3 mg i en engångsdos och hos personer i åldern 2 till 5 år som fick en engångsdos på 5 mg cetirizin oral lösning uppskattades vara mellanliggande mellan det som observerades hos vuxna som fick en engångsdos på 10 mg cetirizin tabletter och de som fick en engångsdos på 20 mg cetirizin tabletter.
säkerheten och effektiviteten hos cetirizin hos barn under 6 månader har inte fastställts.
biverkningar
pediatriska studier utfördes med cetirizinhydroklorid. Mer än 1300 pediatriska patienter i åldern 6 till 11 år med mer än 900 behandlade med cetirizinhydroklorid i doser på 1, 25 till 10 mg per dag inkluderades i kontrollerade och okontrollerade kliniska prövningar som genomfördes i USA. Behandlingstiden varierade från 2 till 12 veckor. Placebokontrollerade studier upp till 4 veckors varaktighet inkluderade 168 pediatriska patienter i åldern 2 till 5 år som fick cetirizin, varav majoriteten fick enstaka dagliga doser på 5 mg. En placebokontrollerad studie på 18 månader inkluderade 399 patienter i åldern 12 till 24 månader behandlade med cetirizin (0.25 mg/kg två gånger dagligen och en annan placebokontrollerad studie på 7 dagar inkluderade 42 patienter i åldern 6 till 11 månader som behandlades med cetirizin (0,25 mg/kg två gånger dagligen).
majoriteten av de biverkningar som rapporterats hos barn i åldern 2 till 11 år med cetirizinhydroklorid var milda eller måttliga. I placebokontrollerade studier var incidensen av avbrott på grund av biverkningar hos pediatriska patienter som fick upp till 10 mg cetirizinhydroklorid mindre vanlig (0,4% på cetirizinhydroklorid jämfört med 1,0% på placebo).
tabell 1 visar biverkningar som rapporterades för cetirizinhydroklorid 5 och 10 mg hos pediatriska patienter i åldern 6 till 11 år i placebokontrollerade kliniska prövningar i USA och var vanligare med cetirizinhydroklorid än placebo. Av dessa ansågs buksmärta vara behandlingsrelaterad och somnolens tycktes vara dosrelaterad, 1, 3% i placebo, 1, 9% vid 5 mg och 4, 2% vid 10 mg. De biverkningar som rapporterades hos pediatriska patienter i åldern 2 till 5 år i placebokontrollerade studier var kvalitativt lika till sin natur och i allmänhet lika i frekvens som de som rapporterades i studier med barn i åldern 6 till 11 år.
i placebokontrollerade studier av pediatriska patienter i åldern 6 till 24 månader var incidensen av biverkningar liknande i cetirizin-och placebobehandlingsgrupperna i varje studie. Somnolens inträffade med i huvudsak samma frekvens hos patienter som fick cetirizin och patienter som fick placebo. I en studie på 1 veckors varaktighet hos barn 6-11 månaders ålder uppvisade patienter som fick cetirizin större irritabilitet/krångel än patienter på placebo. I en studie på 18 månaders varaktighet hos patienter 12 månader och äldre förekom sömnlöshet oftare hos patienter som fick cetirizin jämfört med patienter som fick placebo (9,0% v.5,3%). Hos de patienter som fick 5 mg eller mer per dag cetirizin jämfört med patienter som fick placebo förekom trötthet (3,6% mot 1,3%) och sjukdomskänsla (3,6% mot 1,8%) oftare.
tabell 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| bronkospasm | 1,9% | 3,1% | 1,9% |
| illamående | 1,9% | 1,9% | 2,8% |
| kräkningar | 1, 0% | 2, 5% | 2, 3% |
följande händelser observerades sällan (mindre än 2%), i antingen 3982 vuxna och barn 12 år och äldre eller hos 659 pediatriska patienter i åldern 6 till 11 år som fick cetirizinhydroklorid i amerikanska försök, inklusive en öppen vuxenstudie med sex månaders varaktighet. Ett orsakssamband mellan dessa sällsynta händelser och administrering av cetirizinhydroklorid har inte fastställts.
autonomt nervsystem: anorexi, rodnad, ökad salivation, urinretention.
kardiovaskulär: hjärtsvikt, hypertoni, hjärtklappning, takykardi.
centrala och perifera nervsystemet: onormal koordination, ataxi, förvirring, dysfoni, hyperestesi, hyperkinesi, hypertoni, hypoestesi, benkramper, migrän, myelit, förlamning, parestesi, ptos, synkope, tremor, ryckningar, svindel, synfältfel.
magtarmkanalen: onormal leverfunktion, förvärrad tandkaries, förstoppning, dyspepsi, erctation, flatulens, gastrit, hemorrojder, ökad aptit, melena, rektal blödning, stomatit inklusive ulcerös stomatit, missfärgning av tungan, tungödem.
Genitourinary: cystit, dysuri, hematuri, micturition frekvens, polyuri, urininkontinens, urinvägsinfektion.
hörsel och vestibulär: dövhet, öronvärk, ototoxicitet, tinnitus.
metabolisk / näringsmässig: uttorkning, diabetes mellitus, törst.
muskuloskeletala systemet: artralgi, artrit, artros, muskelsvaghet, myalgi.
psykiatrisk: onormalt tänkande, agitation, amnesi, ångest, minskad libido, depersonalisering, depression, känslomässig labilitet, eufori, nedsatt koncentration, sömnlöshet, nervositet, paroniria, sömnstörning.
andningssystem: bronkit, andnöd, hyperventilation, ökad sputum, lunginflammation, andningsstörning, rinit, bihåleinflammation, övre luftvägsinfektion.
reproduktiv: dysmenorrhea, kvinnlig bröstsmärta, intermenstruell blödning, leukorrhea, menorrhagia, vaginit.
Retikuloendotelial: lymfadenopati.
hud: akne, alopeci, angioödem, bullous utbrott, dermatit, Torr hud, eksem, erytematös utslag, furunkulos, hyperkeratos, hypertrichos, ökad svettning, makulopapulärt utslag, ljuskänslighetsreaktion, ljuskänslighet toxisk reaktion, klåda, purpura, utslag, seborrhea, hudsjukdom, hudknut, urtikaria.
speciella sinnen: parosmi, smakförlust, smakperversion.syn: blindhet, konjunktivit, ögonsmärta, glaukom, förlust av boende, okulär blödning, xeroftalmi.
kroppen som helhet: oavsiktlig skada, asteni, ryggsmärta, bröstsmärta, förstorad buk, ansiktsödem, feber, generaliserat ödem, värmevallningar, ökad vikt, benödem, sjukdom, nasal polyp, smärta, pallor, periorbitalt ödem, perifert ödem, Rigor.
tillfälliga fall av övergående, reversibla levertransaminashöjningar har inträffat under Cetirizinbehandling. Hepatit med signifikant transaminashöjning och förhöjt bilirubin i samband med användning av cetirizinhydroklorid har rapporterats.
erfarenhet efter marknadsföring
under perioden efter marknadsföring har följande ytterligare sällsynta men potentiellt allvarliga biverkningar rapporterats: aggressiv reaktion, anafylaxi, kolestas, kramper, glomerulonefrit, hallucinationer, hemolytisk anemi, hepatit, orofacial dyskinesi, svår hypotoni, dödfödelse, självmordstankar, självmord, trombocytopeni och akut generaliserad exanthematös pustulos (AGEP).
för att rapportera misstänkta biverkningar, kontakta Torrent Pharma Inc. vid 800-912-9561 eller FDA vid 1-800-FDA-1088 eller www.fda.gov/medwatch.
drogmissbruk och beroende
det finns ingen information som tyder på att missbruk eller beroende uppstår med cetirizinhydroklorid.
överdosering
överdosering har rapporterats med cetirizinhydroklorid. Hos en vuxen patient som tog 150 mg cetirizinhydroklorid var patienten somnolent men visade inga andra kliniska tecken eller onormala blodkemi eller hematologiska resultat. I en 18 månader gammal pediatrisk patient som tog en överdos av cetirizinhydroklorid (cirka 180 mg) observerades rastlöshet och irritabilitet initialt; Detta följdes av dåsighet. Om överdosering inträffar ska behandlingen vara symptomatisk eller stödjande, med hänsyn till eventuella samtidigt intagna läkemedel. Det finns ingen känd specifik motgift mot cetirizinhydroklorid. Cetirizinhydroklorid avlägsnas inte effektivt genom dialys, och dialys kommer att vara ineffektiv om inte ett dialyserbart medel har intagits samtidigt. De akuta minimala dödliga orala doserna var 237 mg/kg hos möss (cirka 95 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m2-basis, eller cirka 40 gånger den maximala rekommenderade dagliga orala dosen hos spädbarn på mg/m2-basis) och 562 mg/kg hos råttor (cirka 460 gånger den maximala rekommenderade dagliga orala dosen hos vuxna på mg/m2-basis, eller cirka 190 gånger den maximala rekommenderade dagliga orala dosen hos spädbarn på mg / m2. Hos gnagare var målet för akut toxicitet centrala nervsystemet, och målet för toxicitet med flera doser var levern.
dosering & ADMINISTRATION
cetirizinhydroklorid Oral lösning, USP kan tas utan hänsyn till livsmedelskonsumtion.
barn 2 till 5 år för kronisk urtikaria: den rekommenderade initialdosen av cetirizinhydroklorid Oral lösning, USP hos barn i åldern 2 till 5 år är 2, 5 mg (tsk tesked) oral lösning en gång dagligen. Dosen i denna åldersgrupp kan ökas till en maximal dos på 5 mg per dag som ges som 1 tesked oral lösning en gång om dagen, eller en tesked oral lösning som ges var 12: e timme.
barn 6 månader till < 2 år för perenn allergisk rinit och kronisk urtikaria: den rekommenderade dosen av cetirizinhydroklorid Oral lösning, USP hos barn 6 månader till 23 månaders ålder är 2, 5 mg (tsk i tesked) en gång dagligen. Dosen hos barn i åldern 12 till 23 månader kan ökas till en maximal dos på 5 mg per dag, ges som en tesked i ml (2,5 mg) var 12: e timme.
hur levereras cetirizin
cetirizinhydroklorid oral lösning, USP 5 mg/5 mL (1 mg / mL) är en färglös till svagt gul oral lösning som levereras i flaskor om 120 mL.
flaskor med 120 mL NDC 13668-029-07
cetirizinhydroklorid oral lösning, USP 5 mg/5 mL (1 mg / mL) är en färglös till svagt gul oral lösning som levereras i flaskor om 480 mL.
Flaskor 480 mL NDC 13668-029-11
LAGRING
Butiken vid 20°-25°C (68°-77°F); utflykter tillåtet att 15°-30°C (59°-86°F) .
endast Rx
Tillverkad av:
Bio-Pharm, Inc.
Levittown, PA 19057
tillverkad för:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? Och före eller efter någon speciell måltid?
mer om cetirizin
- biverkningar
- under graviditet eller amning
- doseringsinformation
- Patienttips
- Drogbilder
- läkemedelsinteraktioner
- jämför alternativ
- stödgrupp
- prissättning& kuponger
- 225 recensioner
- läkemedelsklass: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 fler
relaterade behandlingsguider
- allergisk rinit
- urtikaria
- Eustachian Tube dysfunktion
- fysisk urtikaria
Medicinsk ansvarsfriskrivning
Leave a Reply