Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Der chemische Name ist (±) – -1- piperazinyl] ethoxy] Essigsäure, Dihydrochlorid. Cetirizinhydrochlorid ist eine racemische Verbindung mit einer empirischen Formel von C21H25ClN2O3 • 2HCl. Das Molekulargewicht beträgt 461,82 und die chemische Struktur ist unten dargestellt:
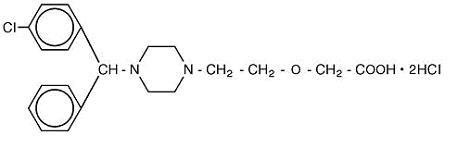
Cetirizindihydrochlorid ist ein weißes oder fast weißes Pulver und in Wasser frei löslich, in Aceton und Methylenchlorid praktisch unlöslich. Cetirizinhydrochlorid-Lösung zum Einnehmen, USP ist eine farblose bis leicht gelbe Lösung zum Einnehmen, die Cetirizinhydrochlorid in einer Konzentration von 1 mg / ml (5 mg / 5 ml) zur oralen Verabreichung enthält. Der pH-Wert liegt zwischen 4 und 5. Die inaktiven Bestandteile der Lösung zum Einnehmen sind: Eisessig, Traubengeschmack, Glycerin, Methylparaben, Propylenglykol, Propylparaben, Natriumacetat, Saccharose und gereinigtes Wasser.
Cetirizin – Klinische Pharmakologie
Wirkmechanismus: Cetirizin, ein menschlicher Metabolit von Hydroxyzin, ist ein Antihistaminikum; seine Hauptwirkungen werden durch selektive Hemmung der peripheren H1-Rezeptoren vermittelt. Die antihistaminische Aktivität von Cetirizin wurde in einer Vielzahl von Tier- und Humanmodellen eindeutig dokumentiert. In vivo und ex vivo Tiermodelle haben vernachlässigbare anticholinerge und antiserotonerge Aktivität gezeigt. In klinischen Studien war Mundtrockenheit unter Cetirizin jedoch häufiger als unter Placebo. In-vitro-Rezeptorbindungsstudien haben keine messbare Affinität für andere als H1-Rezeptoren gezeigt. Autoradiographische Studien mit radioaktiv markiertem Cetirizin bei Ratten haben eine vernachlässigbare Penetration in das Gehirn gezeigt. Ex-vivo-Experimente an der Maus haben gezeigt, dass systemisch verabreichtes Cetirizin die zerebralen H1-Rezeptoren nicht signifikant besetzt.
Pharmakokinetik:
Resorption: Cetirizin wurde nach oraler Verabreichung von Tabletten oder Lösung zum Einnehmen bei Erwachsenen mit einer Zeit bis zur maximalen Konzentration (T max) von etwa 1 Stunde schnell resorbiert. Eine vergleichbare Bioverfügbarkeit wurde zwischen den Darreichungsformen Tablette und Lösung zum Einnehmen gefunden. Wenn gesunden Probanden mehrere Dosen Cetirizin (10 mg Tabletten einmal täglich über 10 Tage) verabreicht wurden, wurde eine mittlere maximale Plasmakonzentration (Cmax) von 311 ng / ml beobachtet. Es wurde keine Akkumulation beobachtet. Die Pharmakokinetik von Cetirizin war für orale Dosen von 5 bis 60 mg linear. Lebensmittel hatten keinen Einfluss auf das Ausmaß der Cetirizin-Exposition (AUC), aber T max wurde um 1,7 Stunden verzögert und C max wurde um 23% in Gegenwart von Lebensmitteln verringert.
Verteilung: Die mittlere Plasmaproteinbindung von Cetirizin beträgt 93%, unabhängig von der Konzentration im Bereich von 25-1000 ng / ml, einschließlich der beobachteten therapeutischen Plasmaspiegel.Stoffwechsel: Eine Massenbilanzstudie an 6 gesunden männlichen Probanden ergab, dass 70% der verabreichten Radioaktivität im Urin und 10% im Kot wiedergefunden wurden. Ungefähr 50% der Radioaktivität wurden im Urin als unverändertes Arzneimittel identifiziert. Der größte Teil des raschen Anstiegs der maximalen Plasma-Radioaktivität war mit dem Arzneimittel assoziiert, was auf einen geringen First-Pass-Metabolismus hindeutet. Cetirizin wird in begrenztem Umfang durch oxidative O-Dealkylierung zu einem Metaboliten mit vernachlässigbarer antihistaminischer Aktivität metabolisiert. Das Enzym oder die Enzyme, die für diesen Metabolismus verantwortlich sind, wurden nicht identifiziert.Elimination: Die mittlere Eliminationshalbwertszeit betrug bei 146 gesunden Probanden in mehreren pharmakokinetischen Studien 8,3 Stunden und die scheinbare Gesamtkörperclearance für Cetirizin betrug etwa 53 ml/min.
Interaktionsstudien
Pharmakokinetische Interaktionsstudien mit Cetirizin bei Erwachsenen wurden mit Pseudoephedrin, Antipyrin, Ketoconazol, Erythromycin und Azithromycin durchgeführt.
Es wurden keine Wechselwirkungen beobachtet. In einer Mehrfachdosisstudie mit Theophyllin (400 mg einmal täglich über 3 Tage) und Cetirizin (20 mg einmal täglich über 3 Tage) wurde eine Abnahme der Clearance von Cetirizin um 16% beobachtet. Die Disposition von Theophyllin wurde durch gleichzeitige Anwendung von Cetirizin nicht verändert.
Spezielle Populationen
Pädiatrische Patienten: Bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren, die 5 mg Cetirizin erhielten, betrug die mittlere C max 660 ng / ml. Basierend auf Quervergleichen war die gewichtsnormalisierte, scheinbare Gesamtkörperclearance in der pädiatrischen Population 81-111% größer und die Eliminationshalbwertszeit war 33 bis 41% kürzer als bei Erwachsenen. Bei pädiatrischen Patienten im Alter von 6 bis 23 Monaten, die eine Einzeldosis von 0, 25 mg / kg Cetirizin-Lösung zum Einnehmen (mittlere Dosis 2, 3 mg) erhielten, betrug die mittlere Cmax 390 ng / ml. Basierend auf studienübergreifenden Vergleichen war die gewichtsnormalisierte, scheinbare Gesamtkörperclearance in dieser pädiatrischen Population im Vergleich zu Erwachsenen um 304% höher und die Eliminationshalbwertszeit um 63% kürzer. Es wird erwartet, dass die durchschnittliche AUC(0-t) bei Kindern im Alter von 6 Monaten bis < 2 Jahren, die die maximale Dosis Cetirizin-Lösung (2, 5 mg zweimal täglich) erhalten, zweifach höher ist als bei Erwachsenen, die einmal täglich eine Dosis von 10 mg Cetirizin-Tabletten erhalten.Wirkung des Geschlechts: Die Wirkung des Geschlechts auf die Pharmakokinetik von Cetirizin wurde nicht ausreichend untersucht.
Wirkung der Rasse: Es wurden keine rassenbedingten Unterschiede in der Kinetik von Cetirizin beobachtet.
Pharmakodynamik: Cetirizinhydrochlorid in Dosen von 5 und 10 mg hemmte bei 19 pädiatrischen Freiwilligen (im Alter von 5 bis 12 Jahren) stark die Quaddel und das Aufflackern, die durch intradermale Injektion von Histamin verursacht wurden, und die Aktivität hielt mindestens 24 Stunden an. In einer 35-tägigen Studie mit Kindern im Alter von 5 bis 12 Jahren wurde keine Toleranz gegenüber den antihistaminischen Wirkungen von Cetirizinhydrochlorid (Unterdrückung der Quaddel- und Flare-Reaktion) festgestellt. Bei 10 Säuglingen im Alter von 7 bis 25 Monaten, die 4 bis 9 Tage Cetirizin in einer Lösung zum Einnehmen (0, 25 mg / kg bid) erhielten, kam es zu einer 90% igen Hemmung der histamininduzierten (10 mg / ml) Quaddeln der Haut und 87% Hemmung der Flare 12 Stunden nach Verabreichung der letzten Dosis. Die klinische Relevanz dieser Unterdrückung der Histamin-induzierten Quaddel- und Flare-Reaktion bei Hauttests ist unbekannt.Die Wirkungen der intradermalen Injektion verschiedener anderer Mediatoren oder Histaminfreisetzer wurden ebenfalls durch Cetirizin gehemmt, ebenso wie die Reaktion auf eine Erkältungsherausforderung bei Patienten mit erkältungsinduzierter Urtikaria. Bei leicht asthmatischen Probanden blockierte Cetirizinhydrochlorid mit 5 bis 20 mg die Bronchokonstriktion aufgrund von vernebeltem Histamin, wobei nach einer Dosis von 20 mg eine praktisch vollständige Blockade auftrat. In Studien, die bis zu 12 Stunden nach kutaner Antigenbelastung durchgeführt wurden, wurde die Spätphasenrekrutierung von Eosinophilen, Neutrophilen und Basophilen, Komponenten der allergischen Entzündungsreaktion, durch Cetirizinhydrochlorid in einer Dosis von 20 mg gehemmt. In vier klinischen Studien an gesunden erwachsenen Männern wurden bei mit Cetirizinhydrochlorid behandelten Probanden keine klinisch signifikanten mittleren QTc-Erhöhungen beobachtet. In der ersten Studie, einer placebokontrollierten Crossover-Studie, wurde Cetirizinhydrochlorid in Dosen von bis zu 60 mg pro Tag, dem 6-fachen der maximalen klinischen Dosis, für 1 Woche verabreicht, und es trat keine signifikante mittlere QTc-Verlängerung auf. In der zweiten Studie, einer Crossover-Studie, wurden Cetirizinhydrochlorid 20 mg und Erythromycin (500 mg alle 8 Stunden) allein und in Kombination verabreicht. Es gab keinen signifikanten Effekt auf QTc mit der Kombination oder mit Cetirizinhydrochlorid allein. In der dritten Studie, ebenfalls einer Crossover-Studie, wurden Cetirizinhydrochlorid 20 mg und Ketoconazol (400 mg pro Tag) allein und in Kombination verabreicht.
Cetirizinhydrochlorid verursachte nach 10-tägiger Therapie einen mittleren Anstieg des QTc von 9,1 ms gegenüber dem Ausgangswert. Ketoconazol erhöhte auch die QTc um 8,3 ms. Die Kombination verursachte einen Anstieg von 17,4 ms, gleich der Summe der Einzeleffekte. Daher gab es keine signifikante Arzneimittelwechselwirkung auf QTc mit der Kombination von Cetirizinhydrochlorid und Ketoconazol. In der vierten Studie, einer placebokontrollierten Parallelstudie, wurden 20 mg Cetirizinhydrochlorid allein oder in Kombination mit Azithromycin verabreicht (500 mg als Einzeldosis am ersten Tag, gefolgt von 250 mg einmal täglich). Es gab keinen signifikanten Anstieg der QTc mit Cetirizinhydrochlorid 20 mg allein oder in Kombination mit Azithromycin. In einer vierwöchigen klinischen Studie an pädiatrischen Patienten im Alter von 6 bis 11 Jahren zeigten die Ergebnisse zufällig erhaltener EKG-Messungen vor und nach 2-wöchiger Behandlung, dass Cetirizinhydrochlorid 5 oder 10 mg die QTc im Vergleich zu Placebo nicht erhöhten. In einer einwöchigen klinischen Studie (N = 86) mit Cetirizinhydrochlorid-Lösung zum Einnehmen, USP (0, 25 mg / kg bid) im Vergleich zu Placebo bei pädiatrischen Patienten im Alter von 6 bis 11 Monaten zeigten EKG-Messungen innerhalb von 3 Stunden nach der letzten Dosis keine EKG-Anomalien oder Erhöhungen des QTc-Intervalls in beiden Gruppen im Vergleich zu den Ausgangswerten. Daten aus anderen Studien, in denen Cetirizinhydrochlorid Patienten im Alter von 6 bis 23 Monaten verabreicht wurde, stimmten mit den Ergebnissen dieser Studie überein.
Die Auswirkungen von Cetirizinhydrochlorid auf das QTc-Intervall bei Dosen von mehr als 10 mg wurden bei Kindern unter 12 Jahren nicht untersucht. In einer sechswöchigen, placebokontrollierten Studie mit 186 Patienten (im Alter von 12 bis 64 Jahren) mit allergischer Rhinitis und leichtem bis mittelschwerem Asthma verbesserte Cetirizinhydrochlorid 10 mg einmal täglich die Rhinitis-Symptome und veränderte die Lungenfunktion nicht. In einer zweiwöchigen, placebokontrollierten klinischen Studie zeigte eine Untergruppenanalyse von 65 pädiatrischen Patienten mit allergischer Rhinitis (im Alter von 6 bis 11 Jahren) mit Asthma, dass Cetirizinhydrochlorid die Lungenfunktion nicht veränderte. Diese Studien unterstützen die Sicherheit der Verabreichung von Cetirizinhydrochlorid an pädiatrische und erwachsene Patienten mit allergischer Rhinitis mit leichtem bis mittelschwerem Asthma.
Klinische Studien: In den USA wurden multizentrische, randomisierte, doppelblinde klinische Studien durchgeführt, in denen Cetirizin 5 bis 20 mg mit Placebo bei Patienten ab 12 Jahren mit perennialer allergischer Rhinitis verglichen wurden. Zwei davon zeigten eine signifikante Verringerung der Symptome einer perennialen allergischen Rhinitis über einen Zeitraum von bis zu 8 Wochen. Zwei 4-wöchige multizentrische, randomisierte, doppelblinde klinische Studien, in denen Cetirizin 5 bis 20 mg mit Placebo bei Patienten mit chronischer idiopathischer Urtikaria verglichen wurden, wurden ebenfalls durchgeführt und zeigten eine signifikante Verbesserung der Symptome einer chronischen idiopathischen Urtikaria. Im Allgemeinen war die 10-mg-Dosis wirksamer als die 5-mg-Dosis und die 20-mg-Dosis zeigte keine zusätzliche Wirkung. Einige dieser Studien umfassten pädiatrische Patienten im Alter von 12 bis 16 Jahren. Darüber hinaus wurden in den USA vier multizentrische, randomisierte, placebokontrollierte, doppelblinde 2-4-wöchige Studien mit 534 pädiatrischen Patienten im Alter von 6 bis 11 Jahren mit saisonaler allergischer Rhinitis in Dosen von bis zu 10 mg durchgeführt.
INDIKATIONEN & VERWENDUNG
Perenniale allergische Rhinitis: Cetirizinhydrochlorid-Lösung zum Einnehmen, USP ist zur Linderung von Symptomen im Zusammenhang mit perennialer allergischer Rhinitis aufgrund von Allergenen wie Hausstaubmilben, Tierhaaren und Schimmelpilzen bei Kindern im Alter von 6 bis 23 Monaten indiziert. Zu den wirksam behandelten Symptomen gehören Niesen, Rhinorrhoe, postnasaler Ausfluss, Nasenpruritus, Augenpruritus und Tränenfluss.
Chronische Urtikaria: Cetirizinhydrochlorid-Lösung zum Einnehmen, USP, ist zur Behandlung der unkomplizierten Hautmanifestationen der chronischen idiopathischen Urtikaria bei Kindern im Alter von 6 Monaten bis 5 Jahren indiziert. Es reduziert signifikant das Auftreten, die Schwere und die Dauer von Nesselsucht und reduziert signifikant Pruritus.
Kontraindikationen
Cetirizinhydrochlorid-Lösung zum Einnehmen, USP ist bei Patienten mit bekannter Überempfindlichkeit gegen es oder einen seiner Inhaltsstoffe oder Hydroxyzin kontraindiziert.
Vorsichtsmaßnahmen
Aktivitäten, die geistige Wachsamkeit erfordern: In klinischen Studien wurde bei einigen Patienten, die Cetirizinhydrochlorid einnahmen, über das Auftreten von Schläfrigkeit berichtet. Die gleichzeitige Anwendung von Cetirizinhydrochlorid mit Alkohol oder anderen ZNS-Depressiva sollte vermieden werden, da eine zusätzliche Verringerung der Wachsamkeit und eine zusätzliche Beeinträchtigung der ZNS-Leistung auftreten können.
Arzneimittel-Wechselwirkungen: Es wurden keine klinisch signifikanten Arzneimittelwechselwirkungen mit Theophyllin in niedriger Dosis, Azithromycin, Pseudoephedrin, Ketoconazol oder Erythromycin gefunden. Es gab eine geringe Abnahme der Clearance von Cetirizin, die durch eine 400-mg-Dosis Theophyllin verursacht wurde; Es ist möglich, dass größere Theophyllindosen eine größere Wirkung haben könnten.
Karzinogenese, Mutagenese und Beeinträchtigung der Fertilität: In einer 2-jährigen Karzinogenitätsstudie an Ratten war Cetirizin in Dosen von bis zu 20 mg / kg über die Nahrung nicht karzinogen (ungefähr das 15-fache der empfohlenen maximalen oralen Tagesdosis bei Erwachsenen auf mg / m 2-Basis oder ungefähr das 7-fache der empfohlenen maximalen oralen Tagesdosis bei Säuglingen auf mg / m 2-Basis). In einer 2-jährigen Karzinogenitätsstudie an Mäusen verursachte Cetirizin bei Männern eine erhöhte Inzidenz von gutartigen Lebertumoren bei einer Nahrungsdosis von 16 mg / kg (ungefähr das 6-fache der maximal empfohlenen oralen Tagesdosis bei Erwachsenen auf mg / m 2-Basis oder ungefähr das 3-fache der maximal empfohlenen oralen Tagesdosis bei Säuglingen auf mg / m 2-Basis). Bei Mäusen wurde bei einer Nahrungsdosis von 4 mg / kg kein Anstieg der Inzidenz von Lebertumoren beobachtet (ungefähr das 2-fache der maximal empfohlenen oralen Tagesdosis bei Erwachsenen auf mg / m 2 -Basis oder ungefähr gleich der maximal empfohlenen oralen Tagesdosis bei Säuglingen auf mg / m 2-Basis). Die klinische Bedeutung dieser Befunde während der Langzeitanwendung von Cetirizinhydrochlorid ist nicht bekannt.
Cetirizin war im Ames-Test nicht mutagen und im menschlichen Lymphozyten-Assay, im Maus-Lymphom-Assay und im In-vivo-Mikronukleustest bei Ratten nicht klastogen.In einer Fertilitäts- und allgemeinen Reproduktionsleistungsstudie an Mäusen beeinträchtigte Cetirizin die Fertilität bei einer oralen Dosis von 64 mg / kg nicht (ungefähr das 25-fache der maximal empfohlenen oralen Tagesdosis bei Erwachsenen auf mg / m 2-Basis).
Pädiatrische Anwendung: Die Sicherheit von Cetirizinhydrochlorid wurde bei pädiatrischen Patienten im Alter von 6 bis 5 Jahren nachgewiesen. Die Sicherheit von Cetirizin wurde bei 168 Patienten im Alter von 2 bis 5 Jahren in placebokontrollierten Studien von bis zu 4 Wochen Dauer nachgewiesen. Auf mg / kg-Basis erhielten die meisten der 168 Patienten zwischen 0, 2 und 0, 4 mg / kg Cetirizin-HCl. Die Sicherheit von Cetirizin bei 399 Patienten im Alter von 12 bis 24 Monaten wurde in einer placebokontrollierten 18-monatigen Studie nachgewiesen, in der die durchschnittliche Dosis
0, 25 mg / kg bid betrug, was einem Bereich von 4 bis 11 mg / Tag entspricht. Die Sicherheit von Cetirizinhydrochlorid-Lösung zum Einnehmen, USP, wurde bei 42 Patienten im Alter von 6 bis 11 Monaten in einer placebokontrollierten 7-tägigen Studie nachgewiesen. Die verschriebene Dosis betrug 0, 25 mg / kg bid, was einem Mittelwert von 4, 5 mg / Tag mit einem Bereich von 3, 4 bis 6, 2 mg / Tag entsprach.Die Wirksamkeit von Cetirizinhydrochlorid zur Behandlung von allergischer Rhinitis und chronischer idiopathischer Urtikaria bei pädiatrischen Patienten im Alter von 6 bis 5 Jahren basiert auf einer Extrapolation der nachgewiesenen Wirksamkeit von Cetirizinhydrochlorid bei Erwachsenen mit diesen Erkrankungen und der Wahrscheinlichkeit, dass der Krankheitsverlauf, die Pathophysiologie und die Wirkung des Arzneimittels zwischen diesen beiden Populationen im Wesentlichen ähnlich sind. Die Wirksamkeit wird bei mehrjähriger allergischer Rhinitis auf das Alter von 6 Monaten extrapoliert, da angenommen wird, dass diese Krankheit bei Kindern bis zu diesem Alter auftritt. Die empfohlenen Dosierungen für die pädiatrische Population basieren auf studienübergreifenden Vergleichen der Pharmakokinetik und Pharmakodynamik von Cetirizin bei erwachsenen und pädiatrischen Patienten sowie auf dem Sicherheitsprofil von Cetirizin bei erwachsenen und pädiatrischen Patienten bei Dosen gleich oder höher als die empfohlenen Dosen. Die AUC und Cmax von Cetirizin bei pädiatrischen Probanden im Alter von 6 bis 23 Monaten, die einen Mittelwert von 2 erhielten.3 mg in einer Einzeldosis und bei Probanden im Alter von 2 bis 5 Jahren, die eine Einzeldosis von 5 mg Cetirizin-Lösung zum Einnehmen erhielten, lagen schätzungsweise zwischen denen, die bei Erwachsenen beobachtet wurden, die eine Einzeldosis von 10 mg Cetirizin-Tabletten erhielten, und denen, die eine Einzeldosis von 20 mg Cetirizin-Tabletten erhielten.
Die Sicherheit und Wirksamkeit von Cetirizin bei pädiatrischen Patienten unter 6 Monaten wurde nicht nachgewiesen.
Nebenwirkungen
Pädiatrische Studien wurden mit Cetirizinhydrochlorid durchgeführt. Mehr als 1300 pädiatrische Patienten im Alter von 6 bis 11 Jahren mit mehr als 900, die mit Cetirizinhydrochlorid in Dosen von 1, 25 bis 10 mg pro Tag behandelt wurden, wurden in kontrollierte und unkontrollierte klinische Studien in den USA aufgenommen. Die Behandlungsdauer lag zwischen 2 und 12 Wochen. Placebokontrollierte Studien mit einer Dauer von bis zu 4 Wochen umfassten 168 pädiatrische Patienten im Alter von 2 bis 5 Jahren, die Cetirizin erhielten, von denen die mehrheit tägliche Einzeldosen von 5 mg erhielt. Eine placebokontrollierte Studie von 18 Monaten Dauer umfasste 399 Patienten im Alter von 12 bis 24 Monaten, die mit Cetirizin behandelt wurden (0.25 mg/kg bid) und eine weitere placebokontrollierte Studie von 7 Tagen Dauer umfasste 42 Patienten im Alter von 6 bis 11 Monaten, die mit Cetirizin (0, 25 mg/kg bid) behandelt wurden.
Die Mehrzahl der Nebenwirkungen, die bei pädiatrischen Patienten im Alter von 2 bis 11 Jahren mit Cetirizinhydrochlorid berichtet wurden, waren leicht oder mittelschwer. In placebokontrollierten Studien kam es gelegentlich zu Abbrüchen aufgrund von Nebenwirkungen bei pädiatrischen Patienten, die bis zu 10 mg Cetirizinhydrochlorid erhielten (0, 4% unter Cetirizinhydrochlorid gegenüber 1, 0% unter Placebo).
Tabelle 1 listet Nebenwirkungen auf, die für Cetirizinhydrochlorid 5 und 10 mg bei pädiatrischen Patienten im Alter von 6 bis 11 Jahren in placebokontrollierten klinischen Studien in den USA berichtet wurden und häufiger mit Cetirizinhydrochlorid als mit Placebo auftraten. Von diesen wurden Bauchschmerzen als behandlungsbedingt angesehen, und die Schläfrigkeit schien dosisabhängig zu sein, 1, 3% unter Placebo, 1, 9% unter 5 mg und 4, 2% unter 10 mg. Die Nebenwirkungen, die bei pädiatrischen Patienten im Alter von 2 bis 5 Jahren in placebokontrollierten Studien berichtet wurden, waren qualitativ ähnlich und im Allgemeinen ähnlich häufig wie in Studien mit Kindern im Alter von 6 bis 11 Jahren.
In den placebokontrollierten Studien mit pädiatrischen Patienten im Alter von 6 bis 24 Monaten waren die Inzidenz von Nebenwirkungen in den Cetirizin- und Placebo-Behandlungsgruppen in jeder Studie ähnlich. Somnolenz trat bei Patienten, die Cetirizin erhielten, und bei Patienten, die Placebo erhielten, im Wesentlichen gleich häufig auf. In einer Studie von 1 Woche Dauer bei Kindern im Alter von 6-11 Monaten zeigten Patienten, die Cetirizin erhielten, eine größere Reizbarkeit / Aufregung als Patienten unter Placebo. In einer Studie von 18 Monaten Dauer bei Patienten ab 12 Monaten trat Schlaflosigkeit häufiger bei Patienten auf, die Cetirizin erhielten, als bei Patienten, die Placebo erhielten (9, 0% v. 5, 3%). Bei Patienten, die 5 mg oder mehr Cetirizin pro Tag erhielten, traten im Vergleich zu Patienten, die Placebo erhielten, Müdigkeit (3,6% vs. 1,3%) und Unwohlsein (3,6% vs. 1,8%) häufiger auf.
Tabelle 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Bronchospasmus | 1,9% | 3,1% | 1,9% |
| Übelkeit | 1,9% | 1,9% | 2,8% |
| Erbrechen | 1,0% | 2,5% | 2,3% |
Die folgenden Ereignisse wurden selten beobachtet (weniger als 2%), entweder bei 3982 Erwachsenen und Kindern ab 12 Jahren oder bei 659 pädiatrischen Patienten im Alter von 6 bis 11 Jahren, die Cetirizinhydrochlorid in US-Studien, einschließlich einer offenen Erwachsenenstudie von sechs Monaten Dauer. Ein kausaler Zusammenhang dieser seltenen Ereignisse mit der Verabreichung von Cetirizinhydrochlorid wurde nicht hergestellt.
Autonomes Nervensystem: Anorexie, Hitzewallungen, erhöhter Speichelfluss, Harnverhalt.
Herz-Kreislauf: Herzinsuffizienz, Bluthochdruck, Herzklopfen, Tachykardie.
Zentrales und peripheres Nervensystem: Koordinationsstörungen, Ataxie, Verwirrtheit, Dysphonie, Hyperästhesie, Hyperkinesie, Hypertonie, Hypästhesie, Beinkrämpfe, Migräne, Myelitis, Lähmung, Parästhesie, Ptosis, Synkope, Tremor, Zucken, Schwindel, Gesichtsfelddefekt.
Gastrointestinaltrakt: abnormale Leberfunktion, verschlimmerte Zahnkaries, Verstopfung, Dyspepsie, Aufstoßen, Blähungen, Gastritis, Hämorrhoiden, erhöhter Appetit, Melena, rektale Blutung, Stomatitis einschließlich ulzerativer Stomatitis, Zungenverfärbung, Zungenödem.
Urogenital: Zystitis, Dysurie, Hämaturie, Miktionsfrequenz, Polyurie, Harninkontinenz, Harnwegsinfektion.
Hören und Vestibulär: Taubheit, Ohrenschmerzen, Ototoxizität, Tinnitus.
Stoffwechsel/Ernährung: Dehydration, Diabetes mellitus, Durst.
Bewegungsapparat: arthralgie, Arthritis, Arthrose, Muskelschwäche, Myalgie.
Psychiatrisch: abnormales Denken, Unruhe, Amnesie, Angstzustände, verminderte Libido, Depersonalisierung, Depression, emotionale Labilität, Euphorie, Konzentrationsstörungen, Schlaflosigkeit, Nervosität, Paronirie, Schlafstörungen.
Atmungssystem: Bronchitis, Dyspnoe, Hyperventilation, vermehrter Auswurf, Lungenentzündung, Atemwegserkrankungen, Rhinitis, Sinusitis, Infektion der oberen Atemwege.
Reproduktiv: Dysmenorrhoe, weibliche Brustschmerzen, intermenstruelle Blutungen, Leukorrhoe, Menorrhagie, Vaginitis.
Retikuloendotheliale: Lymphadenopathie.
Haut: Akne, Alopezie, Angioödem, bullöser Ausbruch, Dermatitis, trockene Haut, Ekzem, erythematöser Hautausschlag, Furunkulose, Hyperkeratose, Hypertrichose, vermehrtes Schwitzen, makulopapulöser Hautausschlag, Lichtempfindlichkeitsreaktion, lichtempfindlichkeitstoxische Reaktion, Pruritus, Purpura, Hautausschlag, Seborrhoe, Hauterkrankung, Hautknoten, Urtikaria.
Besondere Sinne: Parosmie, Geschmacksverlust, Geschmacksperversion.
Vision: Blindheit, Konjunktivitis, Augenschmerzen, Glaukom, Akkommodationsverlust, Augenblutung, Xerophthalmie.
Körper als Ganzes: unfallverletzung, Asthenie, Rückenschmerzen, Brustschmerzen, vergrößerter Bauch, Gesichtsödem, Fieber, generalisiertes Ödem, Hitzewallungen, erhöhtes Gewicht, Beinödem, Unwohlsein, Nasenpolyp, Schmerzen, Blässe, periorbitales Ödem, peripheres Ödem, Rigoren.
Gelegentlich kam es während der Cetirizin-Therapie zu vorübergehenden, reversiblen Erhöhungen der Lebertransaminase. Es wurde über Hepatitis mit signifikanter Transaminaseerhöhung und erhöhtem Bilirubin in Verbindung mit der Anwendung von Cetirizinhydrochlorid berichtet.
Erfahrungen nach Markteinführung
In der Post-Marketing-Periode wurden die folgenden zusätzlichen seltenen, aber potenziell schweren unerwünschten Ereignisse berichtet: aggressive Reaktion, Anaphylaxie, Cholestase, Krämpfe, Glomerulonephritis, Halluzinationen, hämolytische Anämie, Hepatitis, orofaziale Dyskinesie, schwere Hypotonie, Totgeburt, Suizidgedanken, Selbstmord, Thrombozytopenie und akute generalisierte exanthematöse Pustulose (AGEP).Um VERMUTETE NEBENWIRKUNGEN zu melden, wenden Sie sich an Torrent Pharma Inc. bei 800-912-9561 oder FDA bei 1-800-FDA-1088 oder www.fda.gov/medwatch.
Drogenmissbrauch und Abhängigkeit
Es gibt keine Informationen, die darauf hindeuten, dass Missbrauch oder Abhängigkeit mit Cetirizinhydrochlorid auftritt.
Überdosierung
Es wurde über eine Überdosierung von Cetirizinhydrochlorid berichtet. Bei einem erwachsenen Patienten, der 150 mg Cetirizinhydrochlorid einnahm, war der Patient schläfrig, zeigte jedoch keine anderen klinischen Anzeichen oder abnormale Ergebnisse der Blutchemie oder Hämatologie. Bei einem 18 Monate alten pädiatrischen Patienten, der eine Überdosis Cetirizinhydrochlorid (etwa 180 mg) einnahm, wurden zunächst Unruhe und Reizbarkeit beobachtet; es folgte Schläfrigkeit. Im Falle einer Überdosierung sollte die Behandlung symptomatisch oder unterstützend sein, wobei gleichzeitig eingenommene Medikamente zu berücksichtigen sind. Es ist kein spezifisches Gegenmittel gegen Cetirizinhydrochlorid bekannt. Cetirizinhydrochlorid wird durch Dialyse nicht wirksam entfernt, und die Dialyse ist unwirksam, es sei denn, es wurde gleichzeitig ein dialysierbares Mittel eingenommen. Die akuten minimalen letalen oralen Dosen betrugen 237 mg / kg bei Mäusen (ungefähr das 95-fache der empfohlenen maximalen oralen Tagesdosis bei Erwachsenen auf mg / m2-Basis oder ungefähr das 40-fache der empfohlenen maximalen oralen Tagesdosis bei Säuglingen auf mg / m2-Basis) und 562 mg / kg bei Ratten (ungefähr das 460-fache der empfohlenen maximalen oralen Tagesdosis bei Erwachsenen auf mg / m2-Basis oder ungefähr das 190-fache der empfohlenen maximalen oralen Tagesdosis bei Säuglingen auf mg / m2-Basis). Bei Nagetieren war das Ziel der akuten Toxizität das zentrale Nervensystem, und das Ziel der Mehrfachdosis-Toxizität war die Leber.
DOSIERUNG & VERWALTUNG
Cetirizinhydrochlorid-Lösung zum Einnehmen, USP kann ohne Rücksicht auf den Verzehr von Lebensmitteln eingenommen werden.
Kinder 2 bis 5 Jahre für chronische Urtikaria: Die empfohlene Anfangsdosis von Cetirizinhydrochlorid Lösung zum Einnehmen, USP bei Kindern im Alter von 2 bis 5 Jahren beträgt 2,5 mg (½ Teelöffel) Lösung zum Einnehmen einmal täglich. Die Dosierung in dieser Altersgruppe kann auf eine maximale Dosis von 5 mg pro Tag erhöht werden, die einmal täglich als 1 Teelöffel Lösung zum Einnehmen oder alle 12 Stunden als ½ Teelöffel Lösung zum Einnehmen verabreicht wird.
Kinder 6 Monate bis < 2 Jahre für perenniale allergische Rhinitis und chronische Urtikaria: Die empfohlene Dosis von Cetirizinhydrochlorid Lösung zum Einnehmen, USP bei Kindern 6 Monate bis 23 Monate alt ist 2,5 mg (½ Teelöffel) einmal täglich. Die Dosis bei Kindern im Alter von 12 bis 23 Monaten kann auf eine Höchstdosis von 5 mg pro Tag erhöht werden, die alle 12 Stunden als ½ Teelöffel (2, 5 mg) verabreicht wird.
Wie wird Cetirizin geliefert
Cetirizinhydrochlorid-Lösung zum Einnehmen, USP 5 mg / 5 ml (1 mg / ml) ist eine farblose bis leicht gelbe Lösung zum Einnehmen, die in Flaschen mit 120 ml geliefert wird.
Flaschen mit 120 ml NDC 13668-029-07
Cetirizinhydrochlorid-Lösung zum Einnehmen, USP 5 mg / 5 ml (1 mg / ml) ist eine farblose bis leicht gelbe Lösung zum Einnehmen, die in Flaschen mit 480 ml geliefert wird.
Flaschen mit 480 ml NDC 13668-029-11
LAGERUNG
Bei 20 ° -25 ° C (68 ° -77 ° F) lagern; Ausflüge auf 15 ° -30 ° C (59 ° -86 ° F) erlaubt.
Nur Rx
Hergestellt von:
Bio-Pharm, Inc.
Levittown, PA 19057
Hergestellt für:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? Und vor oder nach einer bestimmten Mahlzeit?
Mehr über Cetirizin
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Patiententipps
- Arzneimittelbilder
- Arzneimittelwechselwirkungen
- Alternativen vergleichen
- Selbsthilfegruppe
- Preise & Gutscheine
- 225 Bewertungen
- Drogenklasse: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … +3 mehr
Verwandte Behandlungsleitfäden
- Allergische Rhinitis
- Urtikaria
- Dysfunktion der Eustachischen Röhre
- Physikalische Urtikaria
Medizinischer Haftungsausschluss
Leave a Reply