Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Nazwa chemiczna to ( ± ) – – 1 – piperazynylo] etoksy] kwas octowy, dichlorowodorek. Chlorowodorek cetyryzyny jest związkiem racemicznym o empirycznym wzorze C21H25ClN2O3 •2HCl. Masa cząsteczkowa wynosi 461,82, a struktura chemiczna jest pokazana poniżej:
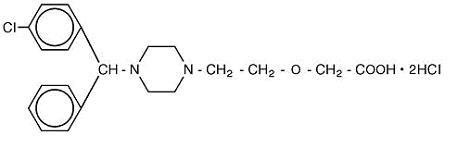
dichlorowodorek cetyryzyny jest białym lub prawie białym proszkiem i jest łatwo rozpuszczalny w wodzie, praktycznie nierozpuszczalny w acetonie i chlorku metylenu. Roztwór doustny chlorowodorku cetyryzyny, USP jest bezbarwnym do lekko żółtego roztworem doustnym zawierającym chlorowodorek cetyryzyny w stężeniu 1 mg/mL (5 mg/5 mL) do podawania doustnego. PH wynosi od 4 do 5. Nieaktywnymi składnikami roztworu doustnego są: kwas octowy lodowaty, aromat winogronowy, gliceryna, metyloparaben, glikol propylenowy, propyloparaben, octan sodu, sacharoza i woda oczyszczona.
Cetyryzyna – Farmakologia kliniczna
mechanizm działania: cetyryzyna, ludzki metabolit hydroksyzyny, jest lekiem przeciwhistaminowym; jego główne działanie polega na selektywnym hamowaniu obwodowych receptorów H1. Działanie przeciwhistaminowe cetyryzyny zostało wyraźnie udokumentowane w różnych modelach zwierzęcych i ludzkich. Modele zwierzęce In vivo i ex vivo wykazały nieistotną aktywność antycholinergiczną i anty serotoninergiczną. W badaniach klinicznych suchość w jamie ustnej występowała jednak częściej w przypadku cetyryzyny niż w przypadku placebo. W badaniach in vitro nie wykazano mierzalnego powinowactwa do receptorów innych niż receptory H1. Badania autoradiograficzne znakowanej radioizotopem cetyryzyny u szczurów wykazały znikome przenikanie do mózgu. Eksperymenty Ex vivo na myszach wykazały, że systemowo podawana Cetyryzyna nie zajmuje znacząco mózgowych receptorów H1.
farmakokinetyka:
wchłanianie: Cetyryzyna była szybko wchłaniana z czasem do maksymalnego stężenia (T max) wynoszącym około 1 godziny po podaniu doustnym tabletek lub roztworu doustnego u dorosłych. Stwierdzono porównywalną biodostępność pomiędzy tabletkami i postaciami dawkowania roztworu doustnego. Podczas wielokrotnego podawania zdrowym ochotnikom cetyryzyny (tabletki 10 mg raz na dobę przez 10 dni), średnie maksymalne stężenie w osoczu (C max) wynosiło 311 ng/mL. Nie obserwowano kumulacji. Farmakokinetyka cetyryzyny była liniowa dla dawek doustnych w zakresie od 5 do 60 mg. Pokarm nie wpływał na stopień ekspozycji na cetyryzynę (AUC), ale T max był opóźniony o 1,7 godziny, a C max zmniejszył się o 23% w obecności pokarmu.
Dystrybucja: Średnie Wiązanie cetyryzyny z białkami osocza wynosi 93%, niezależnie od stężenia w zakresie 25-1000 ng/mL, co obejmuje terapeutyczne stężenia w osoczu.
metabolizm: badanie bilansu masy U 6 zdrowych ochotników płci męskiej wykazało, że 70% podanej radioaktywności było odzyskiwane w moczu, a 10% w kale. Około 50% radioaktywności wykryto w moczu w postaci niezmienionej. Większość szybkiego wzrostu szczytowej radioaktywności w osoczu była związana z lekiem macierzystym, co sugeruje niski stopień metabolizmu pierwszego przejścia. Cetyryzyna jest metabolizowana w ograniczonym stopniu przez oksydacyjną o-dealkilację do metabolitu o znikomej aktywności przeciwhistaminowej. Nie zidentyfikowano enzymu lub enzymów odpowiedzialnych za ten metabolizm.
eliminacja: średni okres półtrwania w fazie eliminacji u 146 zdrowych ochotników w wielu badaniach farmakokinetycznych wynosił 8, 3 godziny, a pozorny całkowity klirens cetyryzyny wynosił około 53 mL/min.
badania interakcji
przeprowadzono badania interakcji farmakokinetycznych z cetyryzyną u dorosłych z pseudoefedryną, antypiryną, ketokonazolem, erytromycyną i azytromycyną.
nie obserwowano interakcji. W badaniu dawek wielokrotnych teofiliny (400 mg raz na dobę przez 3 dni) i cetyryzyny (20 mg raz na dobę przez 3 dni) obserwowano zmniejszenie klirensu cetyryzyny o 16%. Równoczesne podawanie cetyryzyny nie zmieniło usposobienia teofiliny.
szczególne grupy pacjentów
pacjenci pediatryczni: U dzieci w wieku od 2 do 5 lat, które otrzymały 5 mg cetyryzyny, Średnia wartość C max wynosiła 660 ng / mL. Na podstawie porównań krzyżowych stwierdzono, że znormalizowany, pozorny klirens całkowity w masie ciała był o 81-111% większy, a okres półtrwania w fazie eliminacji był o 33-41% krótszy w populacji dzieci niż u dorosłych. U dzieci w wieku od 6 do 23 miesięcy, które otrzymały pojedynczą dawkę 0, 25 mg/kg mc.cetyryzyny w postaci roztworu doustnego (średnia dawka 2, 3 mg), średnia wartość C max wynosiła 390 ng/mL. Na podstawie porównań krzyżowych stwierdzono, że znormalizowany masą, pozorny klirens całkowity był o 304% większy, a okres półtrwania w fazie eliminacji był o 63% krótszy w tej populacji dzieci w porównaniu z dorosłymi. Oczekuje się, że średnia wartość AUC(0-t) u dzieci w wieku od 6 miesięcy do < w wieku 2 lat otrzymujących maksymalną dawkę roztworu cetyryzyny (2,5 mg dwa razy na dobę) będzie dwukrotnie wyższa niż obserwowana u dorosłych otrzymujących dawkę 10 mg tabletek cetyryzyny raz na dobę.
wpływ płci: wpływ płci na farmakokinetykę cetyryzyny nie został odpowiednio zbadany.
wpływ rasy: nie zaobserwowano związanych z rasą różnic w kinetyce cetyryzyny.
Właściwości farmakodynamiczne: chlorowodorek cetyryzyny w dawkach 5 mg i 10 mg silnie hamował powstawanie pęcherzy i zaostrzeń spowodowanych śródskórnym wstrzyknięciem histaminy u 19 ochotników pediatrycznych (w wieku od 5 do 12 lat), a aktywność utrzymywała się przez co najmniej 24 godziny. W 35-dniowym badaniu z udziałem dzieci w wieku od 5 do 12 lat nie stwierdzono tolerancji chlorowodorku cetyryzyny na działanie przeciwhistaminowe (tłumienie reakcji białkowej i pochodnej). U 10 niemowląt w wieku od 7 do 25 miesięcy, które otrzymały 4 do 9 dni cetyryzyny w roztworze doustnym (0, 25 mg/kg mc.dwa razy na dobę), stwierdzono 90% hamowanie indukowanej histaminą (10 mg/mL) skórnej białaczki oraz 87% hamowanie flary 12 godzin po podaniu ostatniej dawki. Znaczenie kliniczne tego zahamowania indukowanej histaminą reakcji na trądzik i rozbłysk w badaniach skórnych nie jest znane.
wpływ śródskórnego wstrzyknięcia różnych innych mediatorów lub uwalniaczy histaminy był również hamowany przez cetyryzynę, podobnie jak odpowiedź na zimne wyzwanie u pacjentów z pokrzywką wywołaną zimnem. U pacjentów z łagodną astmą chlorowodorek cetyryzyny w dawce 5 do 20 mg blokuje skurcz oskrzeli z powodu nebulizowanej histaminy, z praktycznie całkowitą blokadą po dawce 20 mg. W badaniach prowadzonych przez okres do 12 godzin po podaniu skórnego antygenu, późna Faza rekrutacji eozynofilów, neutrofili i bazofilów, składników alergicznej odpowiedzi zapalnej, była hamowana przez chlorowodorek cetyryzyny w dawce 20 mg. W czterech badaniach klinicznych z udziałem zdrowych dorosłych mężczyzn nie obserwowano klinicznie istotnego średniego zwiększenia odstępu QTc u pacjentów leczonych chlorowodorkiem cetyryzyny. W pierwszym badaniu, kontrolowanym placebo, chlorowodorek cetyryzyny podawano w dawkach do 60 mg na dobę, 6 razy większych od maksymalnej dawki klinicznej, przez 1 tydzień i nie stwierdzono istotnego średniego wydłużenia odstępu QTc. W drugim badaniu, badaniu krzyżowym, chlorowodorek cetyryzyny w dawce 20 mg i erytromycyna (500 mg co 8 godzin) podawano w monoterapii i w skojarzeniu. Nie stwierdzono istotnego wpływu na odstęp QTc podczas leczenia skojarzonego lub z samym chlorowodorkiem cetyryzyny. W trzecim badaniu, również w badaniu krzyżowym, chlorowodorek cetyryzyny w dawce 20 mg i ketokonazol (400 mg na dobę) podawano w monoterapii i w skojarzeniu.
chlorowodorek cetyryzyny powodował średnie zwiększenie odstępu QTc o 9,1 MS w stosunku do wartości wyjściowych po 10 dniach leczenia. Ketokonazol zwiększał również odstęp QTc o 8,3 milisekundy. Skojarzenie to powodowało wzrost o 17,4 milisekundy, równy sumie poszczególnych efektów. Z tego względu nie stwierdzono istotnych interakcji leku w QTc w skojarzeniu chlorowodorku cetyryzyny i ketokonazolu. W czwartym badaniu, równoległym badaniu kontrolowanym placebo, chlorowodorek cetyryzyny w dawce 20 mg podawano w monoterapii lub w skojarzeniu z azytromycyną (500 mg w pojedynczej dawce w pierwszym dniu, a następnie 250 mg raz na dobę). Nie stwierdzono istotnego zwiększenia odstępu QTc po podaniu chlorowodorku cetyryzyny w dawce 20 mg w monoterapii lub w skojarzeniu z azytromycyną. W czterotygodniowym badaniu klinicznym z udziałem dzieci w wieku od 6 do 11 lat, wyniki losowo uzyskanych pomiarów EKG przed leczeniem i po 2 tygodniach leczenia wykazały, że 5 lub 10 mg chlorowodorku cetyryzyny nie powodowało wydłużenia odstępu QTc w porównaniu z placebo. W jednotygodniowym badaniu klinicznym (N=86) z zastosowaniem chlorowodorku cetyryzyny w postaci roztworu doustnego USP (0,25 mg/kg mc.dwa razy na dobę) w porównaniu z placebo u dzieci w wieku od 6 do 11 miesięcy, pomiary EKG wykonane w ciągu 3 godzin od podania ostatniej dawki nie wykazały żadnych nieprawidłowości w zapisie EKG ani wydłużenia odstępu QTc w żadnej z grup w porównaniu z oceną początkową. Dane z innych badań, w których pacjentom w wieku 6-23 miesięcy podawano chlorowodorek cetyryzyny, były zgodne z wynikami tego badania.
nie badano wpływu chlorowodorku cetyryzyny na odstęp QTc w dawkach większych niż 10 mg u dzieci w wieku poniżej 12 lat. W trwającym sześć tygodni, kontrolowanym placebo badaniu obejmującym 186 pacjentów (w wieku od 12 do 64 lat) z alergicznym zapaleniem błony śluzowej nosa i łagodną do umiarkowanej astmą, chlorowodorek cetyryzyny w dawce 10 mg raz na dobę poprawiał objawy zapalenia błony śluzowej nosa i nie wpływał na czynność płuc. W dwutygodniowym badaniu klinicznym kontrolowanym placebo, analiza podgrupy 65 dzieci (w wieku od 6 do 11 lat) z alergicznym zapaleniem błony śluzowej nosa i astmą wykazała, że chlorowodorek cetyryzyny nie wpływa na czynność płuc. Badania te potwierdzają bezpieczeństwo stosowania chlorowodorku cetyryzyny u dzieci i dorosłych pacjentów z alergicznym zapaleniem błony śluzowej nosa z łagodną do umiarkowanej astmą.
badania kliniczne: wieloośrodkowe, randomizowane, podwójnie ślepe badania kliniczne porównujące cetyryzynę w dawce 5 do 20 mg z placebo u pacjentów w wieku 12 lat i starszych z wieloletnim alergicznym zapaleniem błony śluzowej nosa przeprowadzono w Stanach Zjednoczonych. Dwa z nich wykazały znaczne zmniejszenie objawów wieloletniego alergicznego zapalenia błony śluzowej nosa przez okres do 8 tygodni. Przeprowadzono również dwa 4-tygodniowe wieloośrodkowe, randomizowane, podwójnie ślepe badania kliniczne porównujące cetyryzynę w dawce 5 mg do 20 mg z placebo u pacjentów z przewlekłą pokrzywką idiopatyczną, które wykazały znaczną poprawę objawów przewlekłej pokrzywki idiopatycznej. Ogólnie dawka 10 mg była skuteczniejsza niż dawka 5 mg, a dawka 20 mg nie dawała dodatkowego efektu. Niektóre z tych badań obejmowały pacjentów pediatrycznych w wieku od 12 do 16 lat. Ponadto w Stanach Zjednoczonych przeprowadzono cztery wieloośrodkowe, randomizowane, kontrolowane placebo, podwójnie ślepe 2-4-tygodniowe badania z udziałem 534 dzieci w wieku od 6 do 11 lat z sezonowym alergicznym zapaleniem błony śluzowej nosa w dawkach do 10 mg.
wskazania& zastosowanie
wieloletni alergiczny nieżyt nosa: roztwór doustny chlorowodorku cetyryzyny, USP jest wskazany w łagodzeniu objawów związanych z wieloletnim alergicznym zapaleniem błony śluzowej nosa spowodowanym alergenami, takimi jak roztocza kurzu, sierść zwierząt i pleśnie u dzieci w wieku od 6 do 23 miesięcy. Objawy leczone skutecznie obejmują kichanie, wyciek z nosa, wydzielinę poporodową, świąd nosa, świąd oka i łzawienie.
przewlekła pokrzywka: chlorowodorek cetyryzyny roztwór doustny, USP jest wskazany w leczeniu niepowikłanych objawów skórnych przewlekłej pokrzywki idiopatycznej u dzieci w wieku od 6 miesięcy do 5 lat. Znacznie zmniejsza występowanie, nasilenie i czas trwania pokrzywki i znacznie zmniejsza świąd.
przeciwwskazania
chlorowodorek cetyryzyny roztwór doustny, USP jest przeciwwskazany u pacjentów ze stwierdzoną nadwrażliwością na niego lub którykolwiek z jego składników lub hydroksyzynę.
środki ostrożności
działania wymagające koncentracji uwagi: w badaniach klinicznych obserwowano występowanie senności u niektórych pacjentów przyjmujących chlorowodorek cetyryzyny; z tego względu należy zachować szczególną ostrożność podczas prowadzenia samochodu lub obsługiwania potencjalnie niebezpiecznych urządzeń mechanicznych. Należy unikać jednoczesnego stosowania chlorowodorku cetyryzyny z alkoholem lub innymi lekami działającymi hamująco na OUN, ponieważ może wystąpić dodatkowe zmniejszenie czujności i dodatkowe upośledzenie czynności OUN.
interakcje lekowe: nie stwierdzono istotnych klinicznie interakcji lekowych z teofiliną w małych dawkach, azytromycyną, pseudoefedryną, ketokonazolem lub erytromycyną. Stwierdzono niewielkie zmniejszenie klirensu cetyryzyny spowodowane dawką teofiliny 400 mg; możliwe, że większe dawki teofiliny mogą mieć większy wpływ.
Rakotwórczość, mutageneza i zaburzenia płodności: w trwającym 2 lata badaniu rakotwórczości u szczurów Cetyryzyna nie wykazywała działania rakotwórczego w dawkach do 20 mg/kg mc. (około 15-krotność maksymalnej zalecanej dawki dobowej u dorosłych w dawce mg/m2 lub około 7-krotność maksymalnej zalecanej dawki dobowej u niemowląt w dawce mg/m2). W trwającym 2 lata badaniu rakotwórczości u myszy, Cetyryzyna powodowała zwiększenie częstości występowania łagodnych guzów wątroby u mężczyzn w dawce 16 mg/kg mc. (około 6-krotność maksymalnej zalecanej dawki doustnej u dorosłych w dawce mg/m2 lub około 3-krotność maksymalnej zalecanej dawki doustnej u niemowląt w dawce mg/m2). Nie obserwowano zwiększenia częstości występowania nowotworów wątroby u myszy po podaniu dawki pokarmowej 4 mg / kg mc. (około 2 razy większej od maksymalnej zalecanej dawki doustnej u dorosłych w dawce mg/m2 lub w przybliżeniu równoważnej maksymalnej zalecanej dawce doustnej u niemowląt w dawce mg/m2). Kliniczne znaczenie tych obserwacji podczas długotrwałego stosowania chlorowodorku cetyryzyny nie jest znane.
Cetyryzyna nie wykazywała działania mutagennego w teście Amesa, ani klastogennego w teście limfocytów ludzkich, teście chłoniaka u myszy i teście mikrojąderkowym in vivo u szczurów.
w badaniu płodności i ogólnego wpływu na reprodukcję u myszy Cetyryzyna nie zaburzała płodności po podaniu doustnym dawki 64 mg/kg mc. (około 25 razy większej od maksymalnej zalecanej dobowej dawki doustnej u dorosłych w przeliczeniu na mg/m2).
zastosowanie u dzieci: bezpieczeństwo stosowania chlorowodorku cetyryzyny wykazano u dzieci w wieku od 6 do 5 lat. Bezpieczeństwo stosowania cetyryzyny wykazano u 168 pacjentów w wieku od 2 do 5 lat w badaniach kontrolowanych placebo trwających do 4 tygodni. W przeliczeniu na mg/kg mc. większość ze 168 pacjentów otrzymywała od 0,2 do 0,4 mg/kg mc. cetyryzyny HCl. Bezpieczeństwo stosowania cetyryzyny u 399 pacjentów w wieku od 12 do 24 miesięcy Wykazano w 18-miesięcznym badaniu kontrolowanym placebo, w którym średnia dawka wynosiła
0, 25 mg/kg mc.dwa razy na dobę, co odpowiada zakresowi od 4 do 11 mg/dobę. Bezpieczeństwo stosowania chlorowodorku cetyryzyny w postaci roztworu doustnego USP wykazano u 42 pacjentów w wieku od 6 do 11 miesięcy w 7-dniowym badaniu kontrolowanym placebo. Zalecana dawka wynosiła 0, 25 mg/kg mc.dwa razy na dobę, co odpowiadało średniej dawce 4, 5 mg/dobę, przy czym zakres dawki wynosił od 3, 4 do 6, 2 mg/dobę.
skuteczność chlorowodorku cetyryzyny w leczeniu alergicznego zapalenia błony śluzowej nosa i przewlekłej pokrzywki idiopatycznej u dzieci w wieku od 6 do 5 lat opiera się na ekstrapolacji wykazanej skuteczności chlorowodorku cetyryzyny u osób dorosłych z tymi chorobami oraz prawdopodobieństwie, że przebieg choroby, Patofizjologia i działanie leku są zasadniczo podobne w obu populacjach. Skuteczność jest ekstrapolowana w wieku do 6 miesięcy w przypadku wieloletniego alergicznego zapalenia błony śluzowej nosa, ponieważ uważa się, że choroba ta występuje u dzieci w wieku poniżej 6 miesięcy. Zalecane dawki dla populacji pediatrycznej są oparte na porównaniach farmakokinetyki i farmakodynamiki cetyryzyny u dorosłych i dzieci oraz na profilu bezpieczeństwa cetyryzyny zarówno u dorosłych, jak i u dzieci w dawkach równych lub większych od zalecanych dawek. AUC i C max cetyryzyny u dzieci w wieku od 6 do 23 miesięcy, które otrzymały średnio 2.3 mg w pojedynczej dawce oraz u osób w wieku od 2 do 5 lat, które otrzymały pojedynczą dawkę 5 mg cetyryzyny w postaci roztworu doustnego, oceniono jako wartość pośrednią pomiędzy obserwowaną u osób dorosłych, które otrzymały pojedynczą dawkę 10 mg cetyryzyny w postaci tabletek a osobami, które otrzymały pojedynczą dawkę 20 mg cetyryzyny w postaci tabletek.
nie określono bezpieczeństwa stosowania i skuteczności cetyryzyny u dzieci w wieku poniżej 6 miesięcy.
działania niepożądane
przeprowadzono badania pediatryczne z zastosowaniem chlorowodorku cetyryzyny. Ponad 1300 pacjentów pediatrycznych w wieku od 6 do 11 lat z ponad 900 leczonych chlorowodorkiem cetyryzyny w dawkach od 1,25 do 10 mg na dobę zostało włączonych do kontrolowanych i niekontrolowanych badań klinicznych prowadzonych w Stanach Zjednoczonych. Czas trwania leczenia wynosił od 2 do 12 tygodni. Badania kontrolowane Placebo trwające do 4 tygodni obejmowały 168 pacjentów pediatrycznych w wieku od 2 do 5 lat, którzy otrzymywali cetyryzynę, z których większość otrzymywała pojedynczą dawkę dobową 5 mg. Trwające 18 miesięcy badanie kontrolowane placebo obejmowało 399 pacjentów w wieku od 12 do 24 miesięcy leczonych cetyryzyną (0.25 mg/kg mc. dwa razy na dobę) oraz inne badanie kontrolowane placebo trwające 7 dni obejmowało 42 pacjentów w wieku od 6 do 11 miesięcy, którzy byli leczeni cetyryzyną (0, 25 mg / kg mc. dwa razy na dobę).
większość działań niepożądanych zgłaszanych u dzieci w wieku od 2 do 11 lat leczonych chlorowodorkiem cetyryzyny była łagodna lub umiarkowana. W badaniach kontrolowanych placebo częstość przerwania leczenia z powodu działań niepożądanych u dzieci otrzymujących do 10 mg chlorowodorku cetyryzyny występowała niezbyt często (0,4% w grupie otrzymującej chlorowodorek cetyryzyny w porównaniu do 1,0% w grupie placebo).
Tabela 1 zawiera wykaz działań niepożądanych, które zgłoszono po zastosowaniu chlorowodorku cetyryzyny w dawce 5 mg i 10 mg u dzieci w wieku od 6 do 11 lat w badaniach klinicznych kontrolowanych placebo w Stanach Zjednoczonych i występowały częściej w przypadku stosowania chlorowodorku cetyryzyny niż placebo. Spośród nich uznano, że ból brzucha jest związany z leczeniem, a senność wydaje się zależna od dawki: 1, 3% w grupie placebo, 1, 9% w grupie otrzymującej 5 mg i 4, 2% w grupie otrzymującej 10 mg. Działania niepożądane zgłaszane u dzieci w wieku od 2 do 5 lat w badaniach kontrolowanych placebo były jakościowo podobne i ogólnie podobne pod względem częstości do tych zgłaszanych w badaniach z udziałem dzieci w wieku od 6 do 11 lat.
w kontrolowanych placebo badaniach z udziałem dzieci w wieku od 6 do 24 miesięcy częstość występowania działań niepożądanych była podobna w grupach leczonych cetyryzyną i placebo w każdym badaniu. Senność występowała zasadniczo z taką samą częstością u pacjentów otrzymujących cetyryzynę i u pacjentów otrzymujących placebo. W trwającym 1 tydzień badaniu z udziałem dzieci w wieku 6-11 miesięcy pacjenci otrzymujący cetyryzynę wykazywali większą drażliwość / drażliwość niż pacjenci otrzymujący placebo. W badaniu trwającym 18 miesięcy u pacjentów w wieku 12 miesięcy i starszych bezsenność występowała częściej u pacjentów otrzymujących cetyryzynę niż u pacjentów otrzymujących placebo (9,0% V. 5,3%). U pacjentów, którzy otrzymywali 5 mg lub więcej cetyryzyny na dobę w porównaniu z pacjentami, którzy otrzymywali placebo, uczucie zmęczenia (3,6% V.1,3%) i złe samopoczucie (3,6% V. 1,8%) występowały częściej.
Tabela 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| skurcz oskrzeli | 1, 9% | 3, 1% | 1, 9% |
| nudności | 1, 9% | 2, 8% | |
| wymioty | 1, 0% | 2, 5% | 2, 3% |
następujące zdarzenia obserwowano rzadko (mniej niż 2%), w obu przypadkach: 3982 dorosłych i dzieci w wieku 12 lat i starszych lub u 659 pacjentów pediatrycznych w wieku od 6 do 11 lat, którzy otrzymywali chlorowodorek cetyryzyny w badaniach amerykańskich, w tym w otwartym badaniu dla dorosłych trwającym sześć miesięcy. Nie ustalono związku przyczynowego tych rzadkich zdarzeń z podawaniem chlorowodorku cetyryzyny.
autonomiczny układ nerwowy: jadłowstręt, zaczerwienienie twarzy, zwiększone wydzielanie śliny, zatrzymanie moczu.
układ sercowo-naczyniowy: niewydolność serca, nadciśnienie tętnicze, kołatanie serca, tachykardia.
ośrodkowy i obwodowy układ nerwowy: zaburzenia koordynacji, ataksja, splątanie, dysfonia, przeczulica, hiperkineza, wzmożone napięcie, niedoczulica, skurcze nóg, migrena, zapalenie rdzenia, paraliż, parestezje, opadanie powiek, omdlenia, drżenie, drgawki, zawroty głowy, wady pola widzenia.
: nieprawidłowa czynność wątroby, nasilona próchnica zębów, zaparcia, niestrawność, odbijanie, wzdęcia, zapalenie żołądka, hemoroidy, zwiększony apetyt, melena, krwotok z odbytnicy, zapalenie jamy ustnej, w tym wrzodziejące zapalenie jamy ustnej, przebarwienia języka, obrzęk języka.
układ moczowo-płciowy: zapalenie pęcherza moczowego, dyzuria, krwiomocz, częstość oddawania moczu, wielomocz, nietrzymanie moczu, zakażenie dróg moczowych.
słuch i przedsionek: głuchota, ból ucha, ototoksyczność, szumy uszne.
metaboliczne/odżywcze: odwodnienie, cukrzyca,pragnienie.
: ból stawów, zapalenie stawów, choroba zwyrodnieniowa stawów, osłabienie mięśni, bóle mięśni.
Psychiatria: zaburzenia myślenia, pobudzenie, amnezja, lęk, zmniejszone libido, depersonalizacja, depresja, labilność emocjonalna, euforia, zaburzenia koncentracji, bezsenność, nerwowość, paroniria, zaburzenia snu.
układ oddechowy: zapalenie oskrzeli, duszność, hiperwentylacja, zwiększona plwocina, zapalenie płuc, zaburzenia oddychania, nieżyt nosa, zapalenie zatok, zakażenie górnych dróg oddechowych.
rozród: bolesne miesiączkowanie, ból piersi u kobiet, krwawienie międzymiesiączkowe, białaczka, krwotok miesiączkowy, zapalenie pochwy.
Reticuloendothelial: powiększenie węzłów chłonnych.
skóra: trądzik, łysienie, obrzęk naczynioruchowy, wykwity pęcherzowe, zapalenie skóry, suchość skóry, wyprysk, wysypka rumieniowa, czyraczność, hiperkeratoza, hipertrichoza, zwiększona potliwość, wysypka grudkowo-plamkowa, reakcja nadwrażliwości na światło, reakcja toksyczna nadwrażliwości na światło, świąd, plamica, wysypka, łojotok, zaburzenia skóry, guzki skórne, pokrzywka.
zmysły specjalne: parasmia, utrata smaku, Perwersja smaku.
widzenie: ślepota, zapalenie spojówek, ból oka, jaskra, utrata akomodacji, krwotok oczny, kseroftalmia.
ciało jako całość: przypadkowe obrażenia, osłabienie, ból pleców, ból w klatce piersiowej, powiększenie brzucha, obrzęk twarzy, gorączka, uogólniony obrzęk, uderzenia gorąca, zwiększona waga, obrzęk nóg, złe samopoczucie, polip nosa, ból, bladość, obrzęk okołooczodołowy, obrzęk obwodowy, sztywność.
sporadycznie podczas leczenia cetyryzyną występowały przemijające, odwracalne zwiększenie aktywności aminotransferaz wątrobowych. Zgłaszano zapalenie wątroby ze znacznym zwiększeniem aktywności aminotransferaz i zwiększonym stężeniem bilirubiny w związku ze stosowaniem chlorowodorku cetyryzyny.
doświadczenia po wprowadzeniu produktu do obrotu
w okresie po wprowadzeniu do obrotu zgłaszano następujące dodatkowe rzadkie, ale potencjalnie ciężkie działania niepożądane: agresywne reakcje, anafilaksja, cholestaza, drgawki, kłębuszkowe zapalenie nerek, omamy, niedokrwistość hemolityczna, zapalenie wątroby, dyskinezy o twarzoczaszkowe, ciężkie niedociśnienie, poronienia martwe, myśli samobójcze, samobójstwo, małopłytkowość i ostra uogólniona pustuloza (AGEP).
Aby zgłosić podejrzewane działania niepożądane, skontaktuj się z Torrent Pharma Inc. w 800-912-9561 lub FDA w 1-800-FDA-1088 lub www.fda.gov/medwatch.
nadużywanie narkotyków i uzależnienie
brak informacji wskazujących na to, że nadużywanie lub uzależnienie występuje w przypadku chlorowodorku cetyryzyny.
przedawkowanie
donoszono o przedawkowaniu chlorowodorku cetyryzyny. U jednego dorosłego pacjenta, który przyjął 150 mg chlorowodorku cetyryzyny, pacjent był somnolentny, ale nie wykazywał żadnych innych objawów klinicznych ani nieprawidłowych wyników w zakresie chemii krwi lub Hematologii. U 18-miesięcznego pacjenta pediatrycznego, który przedawkował chlorowodorek cetyryzyny (około 180 mg), początkowo obserwowano niepokój i drażliwość; po tym następowała senność. W przypadku przedawkowania należy zastosować leczenie objawowe lub podtrzymujące, biorąc pod uwagę jednocześnie przyjmowane leki. Nie jest znane swoiste antidotum na chlorowodorek cetyryzyny. Chlorowodorek cetyryzyny nie jest skutecznie usuwany przez dializę, a dializa jest nieskuteczna, chyba że jednocześnie spożyto lek dający się dializować. Ostra minimalna śmiertelna dawka doustna wynosiła 237 mg/kg mc.u myszy (około 95 razy większa od maksymalnej zalecanej dawki dobowej u dorosłych w dawce mg/m2 pc., lub około 40 razy większa od maksymalnej zalecanej dawki dobowej u niemowląt w dawce mg/m2 pc.) i 562 mg/kg mc. u szczurów (około 460 razy większa od maksymalnej zalecanej dawki dobowej u dorosłych w dawce mg/m2 pc., lub około 190 razy większa od maksymalnej zalecanej dawki dobowej u niemowląt w dawce mg/m2 pc.). U gryzoni celem ostrej toksyczności był ośrodkowy układ nerwowy, a celem toksyczności po podaniu wielokrotnym była wątroba.
dawkowanie& podawanie
chlorowodorek cetyryzyny roztwór doustny, USP można przyjmować bez względu na spożycie pokarmu.
dzieci w wieku od 2 do 5 lat w przewlekłej pokrzywce: zalecana dawka początkowa roztworu doustnego chlorowodorku cetyryzyny, USP u dzieci w wieku od 2 do 5 lat wynosi 2,5 mg (½ łyżeczki do herbaty) roztworu doustnego raz na dobę. Dawkowanie w tej grupie wiekowej można zwiększyć do maksymalnej dawki 5 mg na dobę podawanej w postaci 1 łyżeczki do herbaty roztworu doustnego raz na dobę lub 1 ½ łyżeczki do herbaty roztworu doustnego podawanego co 12 godzin.
dzieci w wieku od 6 miesięcy do < 2 lata w przypadku wieloletniego alergicznego zapalenia błony śluzowej nosa i przewlekłej pokrzywki: zalecana dawka chlorowodorku cetyryzyny w postaci roztworu doustnego USP u dzieci w wieku od 6 miesięcy do 23 miesięcy wynosi 2,5 mg (½ łyżeczki do herbaty) raz na dobę. Dawkę u dzieci w wieku od 12 do 23 miesięcy można zwiększyć do maksymalnej dawki 5 mg na dobę, podawanej w ½ łyżeczki do herbaty (2,5 mg) co 12 godzin.
jak jest dostarczany Cetyryzyna
roztwór doustny chlorowodorku cetyryzyny, USP 5 mg/5 mL (1 mg/mL) jest bezbarwnym lub lekko żółtym roztworem doustnym dostarczanym w butelkach po 120 mL.
butelki 120 mL NDC 13668-029-07
roztwór doustny chlorowodorku cetyryzyny, USP 5 mg/5 mL (1 mg/mL) jest bezbarwnym lub lekko żółtym roztworem doustnym dostarczanym w butelkach po 480 mL.
butelki o pojemności 480 mL NDC 13668-029-11
przechowywanie
Przechowywać w temperaturze 20°-25°C (68°-77°F); wycieki dozwolone do 15°-30°C (59°-86°f) .
tylko Rx
Producent:
Bio-Pharm, Inc.
Levittown, PA 19057
Wyprodukowano dla:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? A przed czy po jakimś konkretnym posiłku?
więcej o cetyryzynie
- skutki uboczne
- podczas ciąży lub karmienia piersią
- Informacje dotyczące dawkowania
- Porady dla pacjentów
- Zdjęcia leków
- interakcje leków
- Porównaj alternatywy
- Grupa Wsparcia
- Cennik & kupony
- 225 opinii
- : antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … +3 więcej
powiązane poradniki leczenia
- alergiczny nieżyt nosa
- pokrzywka
- dysfunkcja trąbki Eustachiusza
- pokrzywka fizyczna
oświadczenie lekarskie
Leave a Reply