Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Il nome chimico è ( ± ) – – 1 – piperazinil] etossi] acido acetico, dicloridrato. Cetirizina cloridrato è un composto racemico con una formula empirica di C21H25ClN2O3 * 2HCl. Il peso molecolare è 461,82 e la struttura chimica è mostrata di seguito:
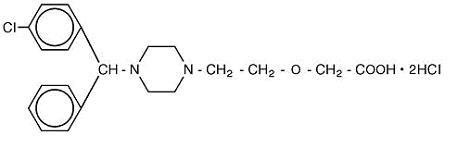
Il dicloridrato di cetirizina è una polvere bianca o quasi bianca ed è liberamente solubile in acqua, praticamente insolubile in acetone e in cloruro di metilene. Cetirizine Hydrochloride Oral Solution, USP è una soluzione orale da incolore a leggermente gialla contenente Cetirizina cloridrato ad una concentrazione di 1 mg/mL (5 mg/5 mL) per somministrazione orale. Il pH è compreso tra 4 e 5. Gli ingredienti inattivi della soluzione orale sono: acido acetico glaciale, aroma d’uva, glicerina, metilparabene, glicole propilenico, propilparabene, acetato di sodio, saccarosio e acqua purificata.
Cetirizina – Farmacologia clinica
Meccanismo d’azione: La cetirizina, un metabolita umano dell’idrossizina, è un antistaminico; i suoi effetti principali sono mediati tramite inibizione selettiva dei recettori H1 periferici. L’attività antistaminica della cetirizina è stata chiaramente documentata in una varietà di modelli animali e umani. Modelli animali in vivo ed ex vivo hanno mostrato attività anticolinergica e anti-serotoninergica trascurabile. Negli studi clinici, tuttavia, la secchezza delle fauci è stata più comune con cetirizina che con placebo. Studi di legame recettoriale in vitro non hanno mostrato affinità misurabile per altri recettori H1. Studi autoradiografici con cetirizina radiomarcata nel ratto hanno mostrato una penetrazione trascurabile nel cervello. Esperimenti ex vivo nel topo hanno dimostrato che la cetirizina somministrata per via sistemica non occupa significativamente i recettori H1 cerebrali.
Farmacocinetica:
Assorbimento: La cetirizina è stata rapidamente assorbita con un tempo di concentrazione massima (T max) di circa 1 ora dopo la somministrazione orale di compresse o soluzione orale negli adulti. La biodisponibilità comparabile è stata trovata fra la compressa e le forme di dosaggio della soluzione orale. Quando a volontari sani sono state somministrate dosi multiple di cetirizina (compresse da 10 mg una volta al giorno per 10 giorni), è stata osservata una concentrazione plasmatica media di picco (C max) di 311 ng/mL. Non è stato osservato accumulo. La farmacocinetica della cetirizina è stata lineare per dosi orali comprese tra 5 e 60 mg. Il cibo non ha avuto alcun effetto sull’entità dell’esposizione alla cetirizina (AUC), ma T max è stato ritardato di 1,7 ore e C max è diminuito del 23% in presenza di cibo.
Distribuzione: Il legame medio alle proteine plasmatiche della cetirizina è del 93%, indipendentemente dalla concentrazione nell’intervallo 25-1000 ng/mL, che include i livelli plasmatici terapeutici osservati.
Metabolismo: Uno studio sull’equilibrio di massa condotto su 6 volontari maschi sani ha indicato che il 70% della radioattività somministrata è stata recuperata nelle urine e il 10% nelle feci. Circa il 50% della radioattività è stata identificata nelle urine come farmaco immodificato. La maggior parte del rapido aumento della radioattività plasmatica di picco è stata associata al farmaco progenitore, suggerendo un basso grado di metabolismo di primo passaggio. La cetirizina viene metabolizzata in misura limitata dalla O-dealchilazione ossidativa a un metabolita con attività antistaminica trascurabile. L’enzima o gli enzimi responsabili di questo metabolismo non sono stati identificati.
Eliminazione: L ‘ emivita media di eliminazione in 146 volontari sani in diversi studi di farmacocinetica è stata di 8,3 ore e la clearance totale apparente per Cetirizina è stata di circa 53 ml/min.
Studi di interazione
Studi di interazione farmacocinetica con cetirizina negli adulti sono stati condotti con pseudoefedrina, antipirina, ketoconazolo, eritromicina e azitromicina.
Non sono state osservate interazioni. In uno studio a dosi multiple di teofillina (400 mg una volta al giorno per 3 giorni) e cetirizina (20 mg una volta al giorno per 3 giorni), è stata osservata una diminuzione del 16% della clearance della cetirizina. La disposizione della teofillina non è stata alterata dalla somministrazione concomitante di cetirizina.
Popolazioni speciali
Pazienti pediatrici: Nei pazienti pediatrici di età compresa tra 2 e 5 anni che hanno ricevuto 5 mg di cetirizina, la C max media è stata di 660 ng / mL. Sulla base di confronti incrociati negli studi, la clearance corporea totale apparente normalizzata in peso era maggiore dell ’81-111% e l’ emivita di eliminazione era inferiore del 33-41% nella popolazione pediatrica rispetto agli adulti. Nei pazienti pediatrici di età compresa tra 6 e 23 mesi che hanno ricevuto una dose singola di 0,25 mg/kg di cetirizina soluzione orale (dose media 2,3 mg), la C max media è stata di 390 ng/mL. Sulla base di confronti incrociati negli studi, la clearance corporea totale apparente normalizzata dal peso era del 304% maggiore e l’emivita di eliminazione era del 63% più breve in questa popolazione pediatrica rispetto agli adulti. L’AUC media(0-t) nei bambini di età compresa tra 6 mesi e < 2 anni che ricevono la dose massima di soluzione di cetirizina (2,5 mg due volte al giorno) dovrebbe essere due volte superiore a quella osservata negli adulti che ricevono una dose di 10 mg di cetirizina compresse una volta al giorno.
Effetto del sesso: L’effetto del sesso sulla farmacocinetica della cetirizina non è stato adeguatamente studiato.
Effetto della razza: Non sono state osservate differenze legate alla razza nella cinetica della cetirizina.
Farmacodinamica: Cetirizina cloridrato a dosi di 5 e 10 mg ha fortemente inibito il wheal e il flare causati dall’iniezione intradermica di istamina in 19 volontari pediatrici (di età compresa tra 5 e 12 anni) e l’attività è persistita per almeno 24 ore. In uno studio di 35 giorni su bambini di età compresa tra 5 e 12 anni, non è stata riscontrata tolleranza agli effetti antistaminici (soppressione della risposta wheal e flare) della cetirizina cloridrato. In 10 lattanti di età compresa tra 7 e 25 mesi che hanno ricevuto da 4 a 9 giorni di cetirizina in soluzione orale (0,25 mg/kg bid), si è verificata un’inibizione del 90% della wheal cutanea indotta da istamina (10 mg/mL) e dell ‘ 87% della flare 12 ore dopo la somministrazione dell’ultima dose. La rilevanza clinica di questa soppressione della risposta wheal e flare indotta da istamina sui test cutanei non è nota.
Gli effetti dell’iniezione intradermica di vari altri mediatori o rilasciatori di istamina sono stati anche inibiti dalla cetirizina, così come la risposta a una sfida a freddo nei pazienti con orticaria indotta da freddo. In soggetti lievemente asmatici, cetirizina cloridrato a 5-20 mg ha bloccato la broncocostrizione dovuta all’istamina nebulizzata, con blocco praticamente totale dopo una dose di 20 mg. In studi condotti fino a 12 ore dopo la sfida cutanea dell’antigene, il reclutamento in fase avanzata di eosinofili, neutrofili e basofili, componenti della risposta infiammatoria allergica, è stato inibito dalla cetirizina cloridrato alla dose di 20 mg. In quattro studi clinici condotti su maschi adulti sani, non sono stati osservati aumenti medi clinicamente significativi del QTc nei soggetti trattati con cetirizina cloridrato. Nel primo studio, uno studio crossover controllato con placebo, la cetirizina cloridrato è stata somministrata a dosi fino a 60 mg al giorno, 6 volte la dose clinica massima, per 1 settimana, e non si è verificato un significativo prolungamento medio del QTc. Nel secondo studio, uno studio crossover, Cetirizina cloridrato 20 mg ed eritromicina (500 mg ogni 8 ore) sono stati somministrati da soli e in associazione. Non vi è stato alcun effetto significativo sul QTc con l’associazione o con cetirizina cloridrato da sola. Nel terzo studio, anche in uno studio crossover, Cetirizina cloridrato 20 mg e ketoconazolo (400 mg al giorno) sono stati somministrati da soli e in associazione.
La cetirizina cloridrato ha causato un aumento medio del QTc di 9,1 msec rispetto al basale dopo 10 giorni di terapia. Anche il ketoconazolo ha aumentato il QTc di 8,3 msec. La combinazione ha causato un aumento di 17,4 msec, pari alla somma degli effetti individuali. Pertanto, non vi è stata alcuna interazione farmacologica significativa sul QTc con la combinazione di Cetirizina cloridrato e ketoconazolo. Nel quarto studio, uno studio parallelo controllato con placebo, la cetirizina cloridrato 20 mg è stata somministrata da sola o in associazione con azitromicina (500 mg in dose singola il primo giorno seguita da 250 mg una volta al giorno). Non è stato riscontrato un aumento significativo del QTc con cetirizina cloridrato 20 mg da sola o in associazione con azitromicina. In uno studio clinico di quattro settimane in pazienti pediatrici di età compresa tra 6 e 11 anni, i risultati delle misurazioni ECG ottenute casualmente prima del trattamento e dopo 2 settimane di trattamento hanno mostrato che la cetirizina cloridrato 5 o 10 mg non ha aumentato il QTc rispetto al placebo. In uno studio clinico di una settimana (N=86) di cetirizina cloridrato soluzione orale, USP (0,25 mg/kg bid) rispetto al placebo in pazienti pediatrici di età compresa tra 6 e 11 mesi, le misurazioni ECG effettuate entro 3 ore dall’ultima dose non hanno mostrato anomalie ECG o aumenti dell’intervallo QTc in entrambi i gruppi rispetto alle valutazioni basali. I dati di altri studi in cui cetirizina cloridrato è stata somministrata a pazienti di età compresa tra 6 e 23 mesi sono stati coerenti con i risultati di questo studio.
Gli effetti della cetirizina cloridrato sull’intervallo QTc a dosi superiori a 10 mg non sono stati studiati nei bambini di età inferiore ai 12 anni. In uno studio di sei settimane, controllato con placebo su 186 pazienti (di età compresa tra 12 e 64 anni) con rinite allergica e asma da lieve a moderata, cetirizina cloridrato 10 mg una volta al giorno ha migliorato i sintomi della rinite e non ha alterato la funzionalità polmonare. In uno studio clinico di due settimane, controllato con placebo, un’analisi di sottoinsieme di 65 pazienti pediatrici (di età compresa tra 6 e 11 anni) con rinite allergica con asma ha mostrato che la cetirizina cloridrato non alterava la funzionalità polmonare. Questi studi supportano la sicurezza della somministrazione di cetirizina cloridrato a pazienti pediatrici e adulti con rinite allergica con asma da lieve a moderata.
Studi clinici: negli Stati Uniti sono stati condotti studi clinici multicentrici, randomizzati, in doppio cieco, che confrontano Cetirizina da 5 a 20 mg a placebo in pazienti di età pari o superiore a 12 anni con rinite allergica perenne. Due di questi hanno mostrato riduzioni significative dei sintomi della rinite allergica perenne fino a 8 settimane di durata. Sono stati condotti anche due studi clinici multicentrici di 4 settimane, randomizzati, in doppio cieco, che hanno confrontato Cetirizina da 5 a 20 mg con placebo in pazienti con orticaria cronica idiopatica e hanno mostrato un miglioramento significativo dei sintomi di orticaria cronica idiopatica. In generale, la dose di 10 mg è stata più efficace della dose di 5 mg e la dose di 20 mg non ha dato alcun effetto aggiunto. Alcuni di questi studi hanno incluso pazienti pediatrici di età compresa tra 12 e 16 anni. Inoltre, quattro studi multicentrici, randomizzati, controllati con placebo, in doppio cieco di 2-4 settimane in 534 pazienti pediatrici di età compresa tra 6 e 11 anni con rinite allergica stagionale sono stati condotti negli Stati Uniti a dosi fino a 10 mg.
INDICAZIONI&USO
Rinite allergica perenne: Cetirizina cloridrato soluzione orale, USP è indicato per il sollievo dei sintomi associati alla rinite allergica perenne a causa di allergeni come acari della polvere, peli di animali e muffe nei bambini dai 6 ai 23 mesi di età. I sintomi trattati efficacemente includono starnuti, rinorrea, scarico postnasale, prurito nasale, prurito oculare e lacrimazione.
Orticaria cronica: Cetirizina cloridrato soluzione orale, USP è indicato per il trattamento delle manifestazioni cutanee non complicate di orticaria cronica idiopatica nei bambini dai 6 mesi ai 5 anni di età. Riduce significativamente l’insorgenza, la gravità e la durata degli alveari e riduce significativamente il prurito.
Controindicazioni
Cetirizina cloridrato Soluzione orale, USP è controindicato in quei pazienti con una nota ipersensibilità ad esso o uno qualsiasi dei suoi ingredienti o idrossizina.
Precauzioni
Attività che richiedono vigilanza mentale: Negli studi clinici, è stata segnalata l’insorgenza di sonnolenza in alcuni pazienti che assumevano cetirizina cloridrato; si deve pertanto prestare la dovuta cautela quando si guida un’automobile o si utilizzano macchinari potenzialmente pericolosi. L’uso concomitante di cetirizina cloridrato con alcool o altri depressori del SNC deve essere evitato perché possono verificarsi ulteriori riduzioni della vigilanza e ulteriori compromissioni delle prestazioni del SNC.
Interazioni farmaco-farmaco: Non sono state riscontrate interazioni farmacologiche clinicamente significative con teofillina a basse dosi, azitromicina, pseudoefedrina, ketoconazolo o eritromicina. C’è stata una piccola diminuzione della clearance della cetirizina causata da una dose di 400 mg di teofillina; è possibile che dosi più grandi di teofillina possano avere un effetto maggiore.
Carcinogenesi, mutagenesi e compromissione della fertilità: in uno studio di carcinogenicità della durata di 2 anni nei ratti, la cetirizina non è risultata cancerogena a dosi dietetiche fino a 20 mg/kg (circa 15 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m2, o circa 7 volte la dose orale giornaliera massima raccomandata nei neonati su base mg / m2). In uno studio di carcinogenicità della durata di 2 anni nei topi, la cetirizina ha causato un aumento dell’incidenza di tumori benigni del fegato nei maschi alla dose dietetica di 16 mg/kg (circa 6 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m2, o circa 3 volte la dose orale giornaliera massima raccomandata nei neonati su base mg/m2). Non è stato osservato alcun aumento dell’incidenza di tumori epatici nei topi a una dose dietetica di 4 mg/kg (circa 2 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m 2, o approssimativamente equivalente alla dose orale giornaliera massima raccomandata nei neonati su base mg/m 2). Il significato clinico di questi risultati durante l’uso a lungo termine di cetirizina cloridrato non è noto.
La cetirizina non è risultata mutagena nel test Ames e non clastogenica nel test dei linfociti umani, nel test del linfoma del topo e nel test del micronucleo in vivo nei ratti.
In uno studio sulla fertilità e sulle prestazioni riproduttive generali nei topi, la cetirizina non ha alterato la fertilità alla dose orale di 64 mg/kg (circa 25 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m2).
Uso pediatrico: La sicurezza della cetirizina cloridrato è stata dimostrata in pazienti pediatrici di età compresa tra 6 e 5 anni. La sicurezza della cetirizina è stata dimostrata in 168 pazienti di età compresa tra 2 e 5 anni in studi controllati con placebo della durata fino a 4 settimane. Su base mg / kg, la maggior parte dei 168 pazienti ha ricevuto tra 0,2 e 0,4 mg/kg di Cetirizina HCl. La sicurezza della cetirizina in 399 pazienti di età compresa tra 12 e 24 mesi è stata dimostrata in uno studio controllato con placebo della durata di 18 mesi, in cui la dose media era
0,25 mg/kg due volte al giorno, corrispondente ad un intervallo di 4-11 mg/die. La sicurezza di Cetirizina cloridrato soluzione orale, USP è stata dimostrata in 42 pazienti di età compresa tra 6 e 11 mesi in uno studio controllato con placebo di 7 giorni. La dose prescritta era di 0,25 mg / kg bid, che corrispondeva a una media di 4,5 mg / die, con un intervallo da 3,4 a 6,2 mg/die.
L’efficacia di Cetirizine hydrochloride per il trattamento della rinite allergica e orticaria cronica idiopatica in pazienti pediatrici di età compresa tra 6 a 5 anni è basata sull’estrapolazione di dimostrata efficacia di Cetirizine hydrochloride in adulti con queste condizioni, e la probabilità che il decorso della malattia, fisiopatologia e gli effetti del farmaco sono sostanzialmente simili tra queste due popolazioni. L’efficacia è estrapolata fino a 6 mesi di età per la rinite allergica perenne perché si pensa che questa malattia si verifichi fino a queste età nei bambini. Le dosi raccomandate per la popolazione pediatrica si basano su confronti incrociati della farmacocinetica e della farmacodinamica della cetirizina in soggetti adulti e pediatrici e sul profilo di sicurezza della cetirizina in pazienti adulti e pediatrici a dosi uguali o superiori alle dosi raccomandate. La cetirizina AUC e C max in soggetti pediatrici di età compresa tra 6 e 23 mesi che hanno ricevuto una media di 2.3 mg in una dose singola e in soggetti di età compresa tra 2 e 5 anni che hanno ricevuto una dose singola di 5 mg di Cetirizina soluzione orale, è stato stimato essere intermedio tra quello osservato negli adulti che hanno ricevuto una dose singola di 10 mg di Cetirizina compresse e quelli che hanno ricevuto una dose singola di 20 mg di Cetirizina compresse.
La sicurezza e l’efficacia della cetirizina nei pazienti pediatrici di età inferiore ai 6 mesi non sono state stabilite.
Reazioni avverse
Studi pediatrici sono stati condotti con cetirizina cloridrato. Più di 1300 pazienti pediatrici di età compresa tra 6 e 11 anni con più di 900 trattati con cetirizina cloridrato a dosi da 1,25 a 10 mg al giorno sono stati inclusi in studi clinici controllati e incontrollati condotti negli Stati Uniti. La durata del trattamento variava da 2 a 12 settimane. Studi controllati con placebo della durata fino a 4 settimane hanno incluso 168 pazienti pediatrici di età compresa tra 2 e 5 anni che hanno ricevuto Cetirizina, la maggior parte dei quali ha ricevuto dosi giornaliere singole di 5 mg. Uno studio controllato con placebo della durata di 18 mesi ha incluso 399 pazienti di età compresa tra 12 e 24 mesi trattati con cetirizina (0.25 mg/kg bid), e un altro studio controllato con placebo della durata di 7 giorni ha incluso 42 pazienti di età compresa tra 6 e 11 mesi trattati con Cetirizina (0,25 mg/kg bid).
La maggior parte delle reazioni avverse riportate in pazienti pediatrici di età compresa tra 2 e 11 anni con Cetirizina cloridrato sono state lievi o moderate. Negli studi clinici controllati con placebo, l’incidenza di interruzioni dovute a reazioni avverse in pazienti pediatrici che ricevevano fino a 10 mg di cetirizina cloridrato è stata non comune (0,4% in pazienti trattati con cetirizina cloridrato vs. 1,0% in pazienti trattati con placebo).
La Tabella 1 elenca le esperienze avverse che sono state riportate per Cetirizina cloridrato 5 e 10 mg in pazienti pediatrici di età compresa tra 6 e 11 anni in studi clinici controllati con placebo negli Stati Uniti e sono state più comuni con Cetirizina cloridrato rispetto al placebo. Di questi, il dolore addominale è stato considerato correlato al trattamento e la sonnolenza è apparsa dose-correlata, 1,3% nel placebo, 1,9% a 5 mg e 4,2% a 10 mg. Le esperienze avverse riportate in pazienti pediatrici di età compresa tra 2 e 5 anni in studi controllati con placebo sono state qualitativamente simili in natura e generalmente simili in frequenza a quelle riportate in studi con bambini di età compresa tra 6 e 11 anni.
Negli studi clinici controllati con placebo su pazienti pediatrici di età compresa tra 6 e 24 mesi, l ‘ incidenza di esperienze avverse è stata simile nei gruppi trattati con cetirizina e placebo in ciascuno studio. La sonnolenza si è manifestata essenzialmente con la stessa frequenza nei pazienti trattati con cetirizina e nei pazienti trattati con placebo. In uno studio della durata di 1 settimana in bambini di età compresa tra 6 e 11 mesi, i pazienti trattati con cetirizina hanno mostrato maggiore irritabilità/pignoleria rispetto ai pazienti trattati con placebo. In uno studio della durata di 18 mesi in pazienti dai 12 mesi in su, l’insonnia si è verificata più frequentemente nei pazienti trattati con cetirizina rispetto ai pazienti trattati con placebo (9,0% v. 5,3%). In quei pazienti che hanno ricevuto 5 mg o più al giorno di Cetirizina rispetto ai pazienti che hanno ricevuto placebo, affaticamento (3,6% v. 1,3%) e malessere (3,6% v. 1,8%) si sono verificati più frequentemente.
Tabella 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Broncospasmo | 1.9% | 3.1% | 1.9% |
| Nausea | 1.9% | 1.9% | 2.8% |
| Vomito | 1.0% | 2.5% | 2.3% |
I seguenti eventi sono stati osservati raramente (meno del 2%), in entrambi i 3982 adulti e bambini di 12 anni e anziani o in 659 pazienti pediatrici dai 6 agli 11 anni che hanno ricevuto Cetirizine hydrochloride in USA prove, tra cui un open adulto di studio di sei mesi di durata. Non è stata stabilita una relazione causale di questi eventi poco frequenti con la somministrazione di cetirizina cloridrato.
Sistema nervoso autonomo: anoressia, vampate di calore, aumento della salivazione, ritenzione urinaria.
Cardiovascolare: insufficienza cardiaca, ipertensione, palpitazioni, tachicardia.
Sistema nervoso centrale e periferico: coordinazione anormale, atassia, confusione, disfonia, iperestesia, ipercinesia, ipertonia, ipoestesia, crampi alle gambe, emicrania, mielite, paralisi, parestesia, ptosi, sincope, tremore, spasmi, vertigini, difetto del campo visivo.
Gastrointestinale: funzionalità epatica anormale, carie dentale aggravata, stitichezza, dispepsia, eruttazione, flatulenza, gastrite, emorroidi, aumento dell’appetito, melena, emorragia rettale, stomatite inclusa stomatite ulcerosa, scolorimento della lingua, edema della lingua.
Genitourinario: cistite, disuria, ematuria, frequenza della minzione, poliuria, incontinenza urinaria, infezione del tratto urinario.
Udito e vestibolare: sordità, mal d’orecchi, ototossicità, tinnito.
Metabolico / nutrizionale: disidratazione, diabete mellito, sete.
Muscoloscheletrico: artralgia, artrite, artrosi, debolezza muscolare, mialgia.
Psichiatrico: pensiero anormale, agitazione, amnesia, ansia, diminuzione della libido, depersonalizzazione, depressione, labilità emotiva, euforia, compromissione della concentrazione, insonnia, nervosismo, paroniria, disturbi del sonno.
Sistema respiratorio: bronchite, dispnea, iperventilazione, aumento dell’espettorato, polmonite, disturbi respiratori, rinite, sinusite, infezione del tratto respiratorio superiore.
Riproduttivo: dismenorrea, dolore al seno femminile, sanguinamento intermestruale, leucorrea, menorragia, vaginite.
Reticoloendoteliale: linfoadenopatia.
Pelle: acne, alopecia, angioedema, eruzione bollosa, dermatite, pelle secca, eczema, eruzione eritematosa, foruncolosi, ipercheratosi, ipertricosi, aumento della sudorazione, eruzione maculopapulare, reazione di fotosensibilità, reazione tossica di fotosensibilità, prurito, porpora, eruzione cutanea, seborrea, disturbi della pelle, noduli cutanei, orticaria.
Sensi speciali: parosmia, perdita del gusto, perversione del gusto.
Visione: cecità, congiuntivite, dolore oculare, glaucoma, perdita di alloggio, emorragia oculare, xeroftalmia.
Corpo nel suo complesso: lesioni accidentali, astenia, mal di schiena, dolore toracico, addome allargato, edema facciale, febbre, edema generalizzato, vampate di calore, aumento di peso, edema delle gambe, malessere, polipo nasale, dolore, pallore, edema periorbitale, edema periferico, rigori.
Durante la terapia con cetirizina si sono verificati casi occasionali di aumenti transitori e reversibili delle transaminasi epatiche. È stata riportata epatite con aumento significativo delle transaminasi e bilirubina elevata in associazione con l’uso di cetirizina cloridrato.
l’Esperienza Post-Marketing
Nella fase di commercializzazione del periodo, le seguenti ulteriori rara, ma potenzialmente gravi eventi avversi sono stati riportati: reazione aggressiva, anafilassi, colestasi, convulsioni, glomerulonefrite, allucinazioni, anemia emolitica, epatite, orofacciale discinesia, ipotensione grave, morte endouterina, ideazione suicida, suicidio, trombocitopenia acuta generalizzata exanthematous pustulosis (AGEP).
Per segnalare REAZIONI AVVERSE SOSPETTE, contattare Torrent Pharma Inc. a 800-912-9561 o FDA a 1-800-FDA-1088 o www.fda.gov/medwatch.
Abuso e dipendenza da droghe
Non ci sono informazioni che indichino che l’abuso o la dipendenza si verifica con cetirizina cloridrato.
Sovradosaggio
È stato riportato sovradosaggio con cetirizina cloridrato. In un paziente adulto che ha assunto 150 mg di cetirizina cloridrato, il paziente era sonnolento ma non mostrava altri segni clinici o risultati anormali di chimica del sangue o ematologia. In un paziente pediatrico di 18 mesi che ha assunto un sovradosaggio di cetirizina cloridrato (circa 180 mg), sono stati osservati inizialmente irrequietezza e irritabilità; questo è stato seguito da sonnolenza. In caso di sovradosaggio, il trattamento deve essere sintomatico o di supporto, tenendo conto di qualsiasi assunzione concomitante di farmaci. Non esiste un antidoto specifico noto alla cetirizina cloridrato. La cetirizina cloridrato non viene efficacemente rimossa dalla dialisi e la dialisi sarà inefficace a meno che non sia stato contemporaneamente ingerito un agente dializzabile. Le dosi orali minime letali acute sono state 237 mg/kg nei topi (circa 95 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m2, o circa 40 volte la dose orale giornaliera massima raccomandata nei neonati su base mg/m2) e 562 mg/kg nei ratti (circa 460 volte la dose orale giornaliera massima raccomandata negli adulti su base mg/m2, o circa 190 volte la dose orale giornaliera massima raccomandata nei neonati su base mg/m2. Nei roditori, il bersaglio della tossicità acuta era il sistema nervoso centrale e il bersaglio della tossicità a dosi multiple era il fegato.
DOSAGGIO & AMMINISTRAZIONE
Cetirizina cloridrato soluzione orale, USP può essere assunto senza riguardo al consumo di cibo.
Bambini da 2 a 5 anni per orticaria cronica: La dose iniziale raccomandata di cetirizina cloridrato Soluzione orale, USP nei bambini di età compresa tra 2 e 5 anni è di 2,5 mg (½ cucchiaino) soluzione orale una volta al giorno. Il dosaggio in questo gruppo di età può essere aumentato ad una dose massima di 5 mg al giorno dato come soluzione orale di 1 cucchiaino una volta al giorno, o una soluzione orale di ½ cucchiaino da tè data ogni 12 ore.
Bambini da 6 mesi a < 2 anni per rinite allergica perenne e orticaria cronica: la dose raccomandata di Cetirizina cloridrato soluzione orale, USP nei bambini da 6 mesi a 23 mesi di età è di 2,5 mg (½ cucchiaino) una volta al giorno. La dose nei bambini di età compresa tra 12 e 23 mesi può essere aumentata ad una dose massima di 5 mg al giorno, somministrata come ½ cucchiaino da tè (2,5 mg) ogni 12 ore.
Come viene fornita la cetirizina
La soluzione orale di cetirizina cloridrato, USP 5 mg/5 mL (1 mg / mL) è una soluzione orale da incolore a leggermente gialla fornita in flaconi da 120 mL.
Flaconi da 120 mL NDC 13668-029-07
Cetirizina cloridrato Soluzione orale, USP 5 mg/5 mL (1 mg/mL) è una soluzione orale da incolore a leggermente gialla fornita in flaconi da 480 mL.
Flaconi da 480 mL NDC 13668-029-11
CONSERVAZIONE
Conservare a 20°-25 ° C( 68 ° -77 ° F); escursioni consentite a 15°-30°C (59°-86°F).
Rx Solo
Prodotto da:
Bio-Pharm, Inc.
Levittown, PA 19057
Prodotto per:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? E prima o dopo un pasto particolare?
di Più su cetirizine
- Effetti Collaterali
- Durante la Gravidanza o l’Allattamento al seno
- il Dosaggio di Informazioni
- Paziente Suggerimenti
- Interazioni Immagini
- interazioni Farmacologiche
- Confronto Alternative
- Gruppo di Supporto
- Prezzi & Coupon
- 225 Recensioni
- classe di Droga: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 ulteriori
Guide di trattamento correlate
- Rinite allergica
- Orticaria
- Disfunzione della tromba di Eustachio
- Orticaria fisica
Disclaimer medico
Leave a Reply