Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. De chemische naam is ( ± ) – 1-piperazinyl] ethoxy] azijnzuur, dihydrochloride. Het cetirizinewaterstofchloride is een racemische samenstelling met een empirische formule van C21H25ClN2O3 •2HCl. Het molecuulgewicht is 461,82 en de chemische structuur is hieronder weergegeven:
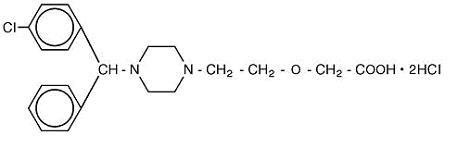
Cetirizinedihydrochloride is een wit of bijna wit poeder en is goed oplosbaar in water, praktisch onoplosbaar in aceton en methyleenchloride. Cetirizinehydrochloride drank, USP is een kleurloze tot lichtgele drank die Cetirizinehydrochloride bevat in een concentratie van 1 mg/mL (5 mg / 5 mL) voor orale toediening. De pH ligt tussen 4 en 5. De inactieve bestanddelen van de drank zijn: ijsazijn, druivensmaak, glycerine, methylparaben, propyleenglycol, propylparaben, natriumacetaat, sucrose en gezuiverd water.
Cetirizine – Klinische Farmacologie
werkingsmechanisme: Cetirizine, een humane metaboliet van hydroxyzine, is een antihistaminicum; de belangrijkste effecten ervan worden gemedieerd via selectieve remming van perifere H1-receptoren. De antihistaminische activiteit van Cetirizine is duidelijk gedocumenteerd in een verscheidenheid van dierlijke en menselijke modellen. In vivo en ex vivo diermodellen hebben verwaarloosbare anticholinerge en anti-serotonerge activiteit aangetoond. In klinische studies kwam droge mond echter vaker voor bij Cetirizine dan bij placebo. In vitro receptorbindingsstudies hebben geen meetbare affiniteit voor andere dan H1-receptoren aangetoond. Autoradiografische studies met radioactief gelabeld Cetirizine bij de rat hebben een verwaarloosbare penetratie in de hersenen aangetoond. Ex vivo experimenten bij de muis hebben aangetoond dat systemisch toegediend Cetirizine niet significant cerebrale H1-receptoren bezet.
farmacokinetiek:
absorptie: Cetirizine werd snel geabsorbeerd met een tijd tot maximale concentratie (T max) van ongeveer 1 uur na orale toediening van tabletten of drank bij volwassenen. Er werd een vergelijkbare biologische beschikbaarheid gevonden tussen de doseringsvormen van de tablet en de drank. Wanneer gezonde vrijwilligers meerdere doses Cetirizine (10 mg tabletten eenmaal daags gedurende 10 dagen) kregen toegediend, werd een gemiddelde piekplasmaconcentratie (C max) van 311 ng/mL waargenomen. Er werd geen accumulatie waargenomen. De farmacokinetiek van Cetirizine was lineair voor orale doses variërend van 5 tot 60 mg. Voedsel had geen effect op de mate van blootstelling aan Cetirizine (AUC), maar T max werd met 1,7 uur vertraagd en C max werd met 23% verlaagd in aanwezigheid van voedsel.
distributie: De gemiddelde plasma-eiwitbinding van Cetirizine is 93%, onafhankelijk van de concentratie in het bereik van 25-1000 ng/mL, inclusief de waargenomen therapeutische plasmaspiegels.metabolisme: een massabalansonderzoek bij 6 gezonde mannelijke vrijwilligers toonde aan dat 70% van de toegediende radioactiviteit werd teruggevonden in de urine en 10% in de ontlasting. Ongeveer 50% van de radioactiviteit werd in de urine geïdentificeerd als onveranderd geneesmiddel. Het grootste deel van de snelle toename van de radioactiviteit in het piekplasma werd geassocieerd met het oorspronkelijke geneesmiddel, wat wijst op een lage mate van first-pass metabolisme. Cetirizine wordt in beperkte mate gemetaboliseerd door oxidatieve O-dealkylatie tot een metaboliet met verwaarloosbare antihistaminica activiteit. Het enzym of de enzymen die verantwoordelijk zijn voor dit metabolisme zijn niet geïdentificeerd.eliminatie :de gemiddelde eliminatiehalfwaardetijd bij 146 gezonde vrijwilligers in meerdere farmacokinetische studies was 8,3 uur en de schijnbare totale lichaamsklaring voor Cetirizine was ongeveer 53 mL/min.
interactiestudies
Farmacokinetische interactiestudies met Cetirizine bij volwassenen werden uitgevoerd met pseudo-efedrine, antipyrine, ketoconazol, erytromycine en azitromycine.
Er werden geen interacties waargenomen. In een onderzoek met meervoudige doses theofylline (400 mg eenmaal daags gedurende 3 dagen) en Cetirizine (20 mg eenmaal daags gedurende 3 dagen) werd een afname van de klaring van Cetirizine met 16% waargenomen. De dispositie van theofylline werd niet gewijzigd door gelijktijdige toediening van Cetirizine.
speciale populaties
pediatrische patiënten: Bij pediatrische patiënten van 2 tot 5 jaar die 5 mg Cetirizine kregen, was de gemiddelde C max 660 ng / mL. Op basis van vergelijkingen tussen kruisstudies was het gewicht genormaliseerd, de schijnbare totale lichaamsklaring was 81-111% groter en de eliminatiehalfwaardetijd was 33 tot 41% korter bij de pediatrische populatie dan bij volwassenen. Bij pediatrische patiënten in de leeftijd van 6 tot 23 maanden die een enkelvoudige dosis van 0,25 mg/kg Cetirizine drank (gemiddelde dosis 2,3 mg) kregen, was de gemiddelde C max 390 ng/mL. Op basis van vergelijkingen tussen kruisstudies was de voor het gewicht genormaliseerde, schijnbare totale lichaamsklaring 304% groter en was de eliminatiehalfwaardetijd 63% korter bij deze pediatrische populatie in vergelijking met volwassenen. De gemiddelde AUC (0-t) bij kinderen van 6 maanden tot < 2 jaar oud die de maximale dosis Cetirizine-oplossing (2,5 mg tweemaal daags) krijgen, is naar verwachting tweemaal hoger dan die waargenomen bij volwassenen die eenmaal daags een dosis van 10 mg Cetirizine-tabletten krijgen.Effect van geslacht: het effect van geslacht op de farmacokinetiek van Cetirizine is niet voldoende onderzocht.
effect van ras: er zijn geen rasgerelateerde verschillen in de kinetiek van Cetirizine waargenomen.
farmacodynamiek: Cetirizinehydrochloride remde bij doses van 5 en 10 mg sterk de wheal en flare veroorzaakt door intradermale injectie van histamine bij 19 pediatrische vrijwilligers (in de leeftijd van 5 tot 12 jaar) en de activiteit hield ten minste 24 uur aan. In een 35 dagen durend onderzoek bij kinderen in de leeftijd van 5 tot 12 jaar werd geen tolerantie gevonden voor de antihistaminica (onderdrukking van wheal en flare response) effecten van Cetirizinehydrochloride. Bij 10 zuigelingen van 7 tot 25 maanden oud die 4 tot 9 dagen Cetirizine in een drank (0,25 mg/kg tweemaal daags) kregen, was er een 90% remming van histamine-geïnduceerde (10 mg/mL) cutane wheal en 87% remming van de opvlamming 12 uur na toediening van de laatste dosis. De klinische relevantie van deze suppressie van histamine-geïnduceerde wheal en flare respons bij huidtesten is onbekend.de effecten van intradermale injectie van verschillende andere mediatoren of histamine-releasers werden ook geremd door Cetirizine, evenals de reactie op een verkoudheid bij patiënten met verkoudheidsgeïnduceerde urticaria. Bij licht astmatische proefpersonen blokkeerde Cetirizinehydrochloride bij 5 tot 20 mg bronchoconstrictie als gevolg van vernevelde histamine, met vrijwel volledige blokkade na een dosis van 20 mg. In studies die tot 12 uur na de challenge van het cutane antigeen werden uitgevoerd, werd de rekrutering in de late fase van eosinofielen, neutrofielen en basofielen, componenten van de allergische ontstekingsreactie, geremd door Cetirizinehydrochloride in een dosis van 20 mg. In vier klinische studies bij gezonde volwassen mannen werden geen klinisch significante gemiddelde verhogingen van QTc waargenomen bij proefpersonen behandeld met Cetirizinehydrochloride. In het eerste onderzoek, een placebogecontroleerde crossover-studie, werd Cetirizinehydrochloride toegediend in doses tot 60 mg per dag, 6 maal de maximale klinische dosis, gedurende 1 week, en Er trad geen significante gemiddelde QTc-verlenging op. In de tweede studie, een crossover-studie, werden Cetirizinehydrochloride 20 mg en erytromycine (500 mg om de 8 uur) alleen en in combinatie gegeven. Er was geen significant effect op de QTc met de combinatie of met alleen Cetirizinehydrochloride. In het derde onderzoek, ook een crossover-onderzoek, werden Cetirizinehydrochloride 20 mg en ketoconazol (400 mg per dag) alleen en in combinatie gegeven.
Cetirizinehydrochloride veroorzaakte na 10 dagen behandeling een gemiddelde QTc-verhoging van 9,1 msec ten opzichte van de uitgangswaarde. Ketoconazol verhoogde ook de QTc met 8,3 msec. De combinatie veroorzaakte een toename van 17,4 msec, gelijk aan de som van de individuele effecten. Er was dus geen significante geneesmiddelinteractie op QTc met de combinatie van Cetirizinehydrochloride en ketoconazol. In de vierde studie, een placebogecontroleerde parallelle studie, werd Cetirizinehydrochloride 20 mg alleen of in combinatie met azithromycine gegeven (500 mg als enkelvoudige dosis op de eerste dag gevolgd door 250 mg eenmaal daags). Er was geen significante toename van QTc met Cetirizinehydrochloride 20 mg alleen of in combinatie met azithromycine. In een vier weken durend klinisch onderzoek bij pediatrische patiënten in de leeftijd van 6 tot 11 jaar, toonden de resultaten van willekeurig verkregen ECG metingen vóór de behandeling en na 2 weken behandeling aan dat Cetirizinehydrochloride 5 of 10 mg de QTc niet verhoogde ten opzichte van placebo. In een klinische studie van één week (n=86) met Cetirizinehydrochloride drank, USP (0,25 mg/kg tweemaal daags) vergeleken met placebo bij pediatrische patiënten van 6 tot 11 maanden oud, vertoonden ECG-metingen die binnen 3 uur na de laatste dosis werden uitgevoerd geen ECG-afwijkingen of verhogingen van het QTc-interval in beide groepen vergeleken met de beoordelingen bij aanvang. Gegevens uit andere onderzoeken waarbij Cetirizinehydrochloride werd toegediend aan patiënten van 6-23 maanden oud waren consistent met de bevindingen in dit onderzoek.de effecten van Cetirizinehydrochloride op het QTc-interval bij doses hoger dan 10 mg zijn niet onderzocht bij kinderen jonger dan 12 jaar. In een zes weken durend, placebogecontroleerd onderzoek bij 186 patiënten (in de leeftijd van 12 tot 64 jaar) met allergische rhinitis en licht tot matig astma, verbeterde 10 mg Cetirizinehydrochloride eenmaal daags rhinitis symptomen en veranderde de longfunctie niet. In een twee weken durend, placebogecontroleerd klinisch onderzoek toonde een subsetanalyse van 65 pediatrische patiënten (van 6 tot 11 jaar) met allergische rhinitis en astma aan dat Cetirizinehydrochloride de longfunctie niet veranderde. Deze studies ondersteunen de veiligheid van het toedienen van Cetirizinehydrochloride aan pediatrische en volwassen allergische rhinitis-patiënten met licht tot matig astma.
klinische onderzoeken: in de Verenigde Staten werden Multicenter, gerandomiseerde, dubbelblinde klinische onderzoeken uitgevoerd waarbij Cetirizine 5 tot 20 mg werd vergeleken met placebo bij patiënten van 12 jaar en ouder met niet-seizoensgebonden allergische rhinitis. Twee hiervan vertoonden een significante afname van de symptomen van niet-seizoensgebonden allergische rhinitis gedurende maximaal 8 weken. Er werden ook twee 4 weken durende multicenter, gerandomiseerde, dubbelblinde klinische onderzoeken uitgevoerd waarin Cetirizine 5 tot 20 mg werd vergeleken met placebo bij patiënten met chronische idiopathische urticaria en die een significante verbetering lieten zien van de symptomen van chronische idiopathische urticaria. Over het algemeen was de dosis van 10 mg werkzamer dan de dosis van 5 mg en gaf de dosis van 20 mg geen extra effect. Sommige van deze onderzoeken omvatten pediatrische patiënten in de leeftijd van 12 tot 16 jaar. Bovendien werden in de Verenigde Staten vier multicenter, gerandomiseerde, placebogecontroleerde, dubbelblinde onderzoeken van 2-4 weken uitgevoerd bij 534 pediatrische patiënten van 6 tot 11 jaar met seizoensgebonden allergische rhinitis in doses tot 10 mg.
indicaties & gebruik
niet-seizoensgebonden allergische Rhinitis: Cetirizinehydrochloride drank, USP is geïndiceerd voor de verlichting van symptomen geassocieerd met niet-seizoensgebonden allergische rhinitis als gevolg van allergenen zoals stofmijt, huidschilfers van dieren en schimmels bij kinderen van 6 tot 23 maanden oud. Effectief behandelde symptomen omvatten niezen, rinorroe, postnasale afscheiding, nasale pruritus, oculaire pruritus en scheuren.
chronische Urticaria: Cetirizinehydrochloride drank, USP is geïndiceerd voor de behandeling van de ongecompliceerde huidmanifestaties van chronische idiopathische urticaria bij kinderen in de leeftijd van 6 maanden tot 5 jaar. Het vermindert significant het voorkomen, de ernst, en de duur van netelroos en vermindert significant pruritus.
contra-indicaties
Cetirizinehydrochloride drank, is USP gecontra-indiceerd bij patiënten met een bekende overgevoeligheid voor het middel of voor één van de bestanddelen ervan of voor hydroxyzine.
voorzorgsmaatregelen
activiteiten die mentale alertheid vereisen: in klinische studies is het optreden van slaperigheid gemeld bij sommige patiënten die Cetirizinehydrochloride gebruiken; voorzichtigheid is daarom geboden bij het besturen van een voertuig of het bedienen van potentieel gevaarlijke machines. Gelijktijdig gebruik van Cetirizinehydrochloride met alcohol of andere CZS-depressiva dient te worden vermeden omdat extra vermindering van de alertheid en extra vermindering van de CZS-prestaties kunnen optreden.
geneesmiddelinteracties: er zijn geen klinisch significante geneesmiddelinteracties gevonden met theofylline bij een lage dosis, azitromycine, pseudo-efedrine, ketoconazol of erytromycine. Er was een kleine afname in de klaring van Cetirizine veroorzaakt door een dosis van 400 mg theofylline; het is mogelijk dat grotere doses theofylline een groter effect kunnen hebben.
carcinogenese, mutagenese en verminderde vruchtbaarheid: in een 2 jaar durend carcinogeniteitsonderzoek bij ratten was Cetirizine niet carcinogeen bij dieetdoses tot 20 mg/kg (ongeveer 15 keer de maximale aanbevolen dagelijkse orale dosis bij volwassenen op mg/m2 basis, of ongeveer 7 keer de maximale aanbevolen dagelijkse orale dosis bij zuigelingen op mg / m2 basis). In een 2 jaar durende carcinogeniciteitsstudie bij muizen veroorzaakte Cetirizine een verhoogde incidentie van goedaardige levertumoren bij mannen bij een voedingsdosis van 16 mg/kg (ongeveer 6 keer de maximale aanbevolen dagelijkse orale dosis bij volwassenen op basis van mg/m2, of ongeveer 3 keer de maximale aanbevolen dagelijkse orale dosis bij zuigelingen op basis van mg/m2). Er werd geen toename in de incidentie van levertumoren waargenomen bij muizen bij een voedingsdosis van 4 mg/kg (ongeveer 2 maal de maximale aanbevolen dagelijkse orale dosis bij volwassenen op basis van mg/m 2, of ongeveer gelijk aan de maximale aanbevolen dagelijkse orale dosis bij zuigelingen op basis van mg/m 2). De klinische significantie van deze bevindingen bij langdurig gebruik van Cetirizinehydrochloride is niet bekend.
Cetirizine was niet mutageen in de Ames-test en niet clastogeen in de humane lymfocyt-test, de muislymfoomtest en in vivo micronucleustest bij ratten.
In een fertiliteits-en algemene voortplantingsprestatiestudie bij muizen verminderde Cetirizine de vruchtbaarheid niet bij een orale dosis van 64 mg/kg (ongeveer 25 keer de maximale aanbevolen dagelijkse orale dosis bij volwassenen op basis van mg/m2).
gebruik bij kinderen: de veiligheid van Cetirizinehydrochloride is aangetoond bij pediatrische patiënten in de leeftijd van 6 tot 5 jaar. De veiligheid van Cetirizine is aangetoond bij 168 patiënten in de leeftijd van 2 tot 5 jaar in placebogecontroleerde studies die tot 4 weken duurden. Op basis van mg / kg kregen de meeste 168 patiënten tussen 0,2 en 0,4 mg/kg Cetirizine HCl. De veiligheid van Cetirizine bij 399 patiënten in de leeftijd van 12 tot 24 maanden is aangetoond in een placebogecontroleerde studie van 18 maanden, waarin de gemiddelde dosis
0,25 mg/kg tweemaal daags was, overeenkomend met een bereik van 4 tot 11 mg/dag. De veiligheid van Cetirizinehydrochloride drank, USP is aangetoond bij 42 patiënten in de leeftijd van 6 tot 11 maanden in een placebogecontroleerde 7-daagse studie. De voorgeschreven dosis was 0,25 mg / kg tweemaal daags, wat overeenkomt met een gemiddelde van 4,5 mg/dag, met een bereik van 3,4 tot 6,2 mg/dag.de werkzaamheid van Cetirizinehydrochloride voor de behandeling van allergische rhinitis en chronische idiopathische urticaria bij pediatrische patiënten in de leeftijd van 6 tot 5 jaar is gebaseerd op een extrapolatie van de aangetoonde werkzaamheid van Cetirizinehydrochloride bij volwassenen met deze aandoeningen en de waarschijnlijkheid dat het verloop van de ziekte, de pathofysiologie en het effect van het geneesmiddel voor deze twee populaties in wezen vergelijkbaar zijn. De werkzaamheid wordt geëxtrapoleerd naar de leeftijd van 6 maanden voor niet-seizoensgebonden allergische rhinitis omdat aangenomen wordt dat deze ziekte bij kinderen tot op deze leeftijd voorkomt. De aanbevolen doses voor de pediatrische populatie zijn gebaseerd op cross-study vergelijkingen van de farmacokinetiek en farmacodynamiek van Cetirizine bij volwassen en pediatrische proefpersonen en op het veiligheidsprofiel van Cetirizine bij zowel volwassen als pediatrische patiënten bij doses gelijk aan of hoger dan de aanbevolen doses. De AUC en C max van Cetirizine bij pediatrische patiënten in de leeftijd van 6 tot 23 maanden die gemiddeld 2 kregen.3 mg in een enkelvoudige dosis en bij personen van 2 tot 5 jaar die een enkelvoudige dosis van 5 mg Cetirizine drank kregen, werd geschat dat het tussen de waarden ligt die werden waargenomen bij volwassenen die een enkelvoudige dosis van 10 mg Cetirizine tabletten kregen en bij degenen die een enkelvoudige dosis van 20 mg Cetirizine tabletten kregen.de veiligheid en werkzaamheid van Cetirizine bij pediatrische patiënten jonger dan 6 maanden zijn niet vastgesteld.
bijwerkingen
pediatrische studies werden uitgevoerd met Cetirizinehydrochloride. Meer dan 1300 pediatrische patiënten in de leeftijd van 6 tot 11 jaar met meer dan 900 behandeld met Cetirizinehydrochloride in doses van 1,25 tot 10 mg per dag werden opgenomen in gecontroleerde en ongecontroleerde klinische onderzoeken die in de Verenigde Staten werden uitgevoerd. De behandelingsduur varieerde van 2 tot 12 weken. Placebo-gecontroleerde studies tot 4 weken duurden onder 168 pediatrische patiënten van 2 tot 5 jaar die Cetirizine kregen, van wie de meerderheid een enkelvoudige dagelijkse dosis van 5 mg kreeg. In een placebogecontroleerd onderzoek van 18 maanden werden 399 patiënten van 12 tot 24 maanden behandeld met Cetirizine (0.In een andere placebogecontroleerde studie van 7 dagen werden 42 patiënten van 6 tot 11 maanden behandeld met Cetirizine (0,25 mg/kg tweemaal daags).
de meerderheid van de bijwerkingen die werden gemeld bij pediatrische patiënten van 2 tot 11 jaar met Cetirizinehydrochloride was licht of matig. In placebogecontroleerde onderzoeken was de incidentie van stopzettingen als gevolg van bijwerkingen bij pediatrische patiënten die tot 10 mg Cetirizinehydrochloride kregen soms (0,4% bij Cetirizinehydrochloride Versus 1,0% bij placebo).
Tabel 1 geeft een overzicht van bijwerkingen die werden gemeld voor Cetirizinehydrochloride 5 en 10 mg bij pediatrische patiënten in de leeftijd van 6 tot 11 jaar in placebogecontroleerde klinische studies in de Verenigde Staten en die vaker voorkwamen met Cetirizinehydrochloride dan met placebo. Van deze patiënten werd buikpijn als behandelingsgerelateerd beschouwd en slaperigheid bleek dosisgerelateerd te zijn, 1,3% bij placebo, 1,9% bij 5 mg en 4,2% bij 10 mg. De bijwerkingen die werden gemeld bij pediatrische patiënten in de leeftijd van 2 tot 5 jaar in placebogecontroleerde onderzoeken waren kwalitatief vergelijkbaar in aard en in het algemeen vergelijkbaar in frequentie met de bijwerkingen die werden gemeld in onderzoeken met kinderen in de leeftijd van 6 tot 11 jaar.
in de placebogecontroleerde onderzoeken bij pediatrische patiënten van 6 tot 24 maanden oud was de incidentie van bijwerkingen vergelijkbaar in de Cetirizine-en placebo-behandelingsgroepen in elk onderzoek. Somnolentie kwam met dezelfde frequentie voor bij patiënten die Cetirizine kregen en bij patiënten die placebo kregen. In een onderzoek van 1 week bij kinderen van 6-11 maanden oud vertoonden patiënten die Cetirizine kregen een grotere prikkelbaarheid/fussiness dan patiënten op placebo. In een studie van 18 maanden bij patiënten van 12 maanden en ouder kwam slapeloosheid vaker voor bij patiënten die Cetirizine kregen dan bij patiënten die placebo kregen (9,0% V.5,3%). Bij de patiënten die 5 mg of meer Cetirizine per dag kregen in vergelijking met patiënten die placebo kregen, traden vermoeidheid (3,6% V.1,3%) en malaise (3,6% V. 1,8%) vaker op.
Tabel 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Bronchospasmen | 1.9% | 3.1% | 1.9% |
| Misselijkheid | 1.9% | 1.9% | 2.8% |
| Braken | 1.0% | 2.5% | 2.3% |
De volgende gebeurtenissen werden zelden waargenomen (minder dan 2%), in 3982 volwassenen en kinderen van 12 jaar en ouder of in 659 pediatrische patiënten in de leeftijd van 6 tot en met 11 jaar die het ontvangen van Cetirizine hydrochloride in AMERIKAANSE studies, met inbegrip van een open volwassen studie van zes maanden. Een causaal verband tussen deze zeldzame voorvallen en de toediening van Cetirizinehydrochloride is niet vastgesteld.
autonoom zenuwstelsel: anorexie, blozen, toegenomen speekselvloed, urineretentie.
cardiovasculair: hartfalen, hypertensie, palpitatie, tachycardie.Centraal en perifeer zenuwstelsel: abnormale coördinatie, ataxie, verwardheid, dysfonie, hyperesthesie, hyperkinesie, hypertonie, hypo-esthesie, beenkrampen, migraine, myelitis, verlamming, paresthesie, ptosis, syncope, tremor, trekkingen, vertigo, gezichtsvelddefect.
maagdarmstelsel: abnormale leverfunctie, verergerde tandcariës, constipatie, dyspepsie, oprispingen, flatulentie, gastritis, aambeien, verhoogde eetlust, melena, rectale bloeding, stomatitis inclusief ulceratieve stomatitis, tongverkleuring, tongoedeem.
urogenitaal: cystitis, dysurie, hematurie, frequent urineren, polyurie, urine-incontinentie, urineweginfectie.
gehoor en vestibulair: doofheid, oorpijn, ototoxiciteit, tinnitus.
metabolisch / nutritioneel: dehydratie, diabetes mellitus, dorst.
Skeletspierstelsel-en bindweefselaandoeningen: artralgie, artritis, artrose, spierzwakte, myalgie.
psychiatrisch: abnormaal denken, agitatie, amnesie, angst, verminderd libido, depersonalisatie, depressie, emotionele labiliteit, euforie, concentratiestoornissen, slapeloosheid, nervositeit, paroniria, slaapstoornis.ademhalingsstelsel: bronchitis, dyspneu, hyperventilatie, toegenomen sputum, pneumonie, ademhalingsstoornis, rhinitis, sinusitis, infectie van de bovenste luchtwegen.reproductie: dysmenorroe, pijn in de vrouwelijke borst, intermenstruele bloeding, leukorroe, menorragie, vaginitis.
reticulo-endotheliaal: lymfadenopathie.
huid: acne, alopecia, angio-oedeem, bulleuze eruptie, dermatitis, Droge huid, eczeem, erythemateuze rash, furunculose, hyperkeratose, hypertrichose, toegenomen transpiratie, maculopapulaire rash, fotosensibiliteitsreactie, fotosensibiliteits toxische reactie, pruritus, purpura, rash, seborroe, huidaandoening, huidnodule, urticaria.
speciale zintuigen: parosmie, smaakverlies, smaakverandering.
zicht: blindheid, conjunctivitis, oogpijn, glaucoom, verlies van accommodatie, oogbloeding, xeroftalmie.
Body als geheel: accidentele verwonding, asthenie, rugpijn, pijn op de borst, vergrote buik, gezichtsoedeem, koorts, gegeneraliseerd oedeem, opvliegers, gewichtstoename, beenoedeem, malaise, nasale poliep, pijn, bleekheid, periorbitaal oedeem, perifeer oedeem, rigors.
incidentele gevallen van voorbijgaande, reversibele verhogingen van levertransaminase zijn opgetreden tijdens de behandeling met Cetirizine. Hepatitis met significante transaminaseverhoging en verhoogd bilirubine in combinatie met het gebruik van Cetirizinehydrochloride is gemeld.
postmarketingervaring
in de postmarketingperiode zijn de volgende bijkomende zeldzame, maar mogelijk ernstige bijwerkingen gemeld: agressieve reactie, anafylaxie, cholestase, convulsies, glomerulonefritis, hallucinaties, hemolytische anemie, hepatitis, orofaciale dyskinesie, ernstige hypotensie, doodgeboorte, zelfmoordgedachten, zelfmoord, trombocytopenie en acute gegeneraliseerde exanthemateuze pustulose (AGEP).neem Voor het melden van vermoedelijke bijwerkingen contact op met Torrent Pharma Inc. bij 800-912-9561 of FDA bij 1-800-FDA-1088 of www.fda.gov/medwatch.
Drug Abuse and Dependence
Er is geen informatie die erop wijst dat met Cetirizinehydrochloride misbruik of afhankelijkheid optreedt.
overdosering
overdosering is gemeld met Cetirizinehydrochloride. Bij één volwassen patiënt die 150 mg Cetirizinehydrochloride nam, was de patiënt slaperig, maar vertoonde geen andere klinische symptomen of abnormale bloedchemie-of hematologische resultaten. Bij een 18 maanden oude pediatrische patiënt die een overdosis Cetirizinehydrochloride (ongeveer 180 mg) nam, werden aanvankelijk rusteloosheid en prikkelbaarheid waargenomen; dit werd gevolgd door slaperigheid. Indien overdosering optreedt, dient de behandeling symptomatisch of ondersteunend te zijn, rekening houdend met alle gelijktijdig ingenomen geneesmiddelen. Er is geen specifiek antidotum voor Cetirizinehydrochloride bekend. Cetirizinehydrochloride wordt niet effectief verwijderd door dialyse, en dialyse zal niet effectief zijn, tenzij een dialyseerbaar middel gelijktijdig is ingenomen. De acute minimale letale orale doses waren de 237 mg/kg bij muizen (ongeveer 95 keer de maximale aanbevolen dagelijkse orale dosis bij volwassenen op een mg/m2 basis, of ongeveer 40 keer de maximale aanbevolen dagelijkse orale dosis bij zuigelingen op een mg/m2 basis) en 562 mg/kg bij ratten (ongeveer 460 keer de maximale aanbevolen dagelijkse orale dosis bij volwassenen op een mg/m2 basis, of ongeveer 190 keer de maximale aanbevolen dagelijkse orale dosis bij zuigelingen op een mg/m2. Bij knaagdieren was de acute toxiciteit gericht op het centrale zenuwstelsel en de toxiciteit bij meervoudige doses op de lever.
dosering & toediening
Cetirizinehydrochloride drank, USP kan worden ingenomen zonder rekening te houden met de voedselconsumptie.
kinderen van 2 tot 5 jaar voor chronische Urticaria: de aanbevolen aanvangsdosis van Cetirizinehydrochloride drank, USP bij kinderen van 2 tot 5 jaar is eenmaal daags 2,5 mg (½ theelepel) drank. De dosering in deze leeftijdsgroep kan worden verhoogd tot een maximale dosis van 5 mg per dag gegeven als 1 theelepel drank eenmaal per dag, of een ½ theelepel drank om de 12 uur gegeven.
kinderen van 6 maanden tot < 2 jaar voor niet-seizoensgebonden allergische Rhinitis en chronische Urticaria: de aanbevolen dosis Cetirizinehydrochloride drank, USP bij kinderen van 6 maanden tot 23 maanden is 2,5 mg (½ theelepel) eenmaal daags. De dosis bij kinderen van 12 tot 23 maanden kan worden verhoogd tot een maximale dosis van 5 mg per dag, toegediend als ½ theelepel (2,5 mg) om de 12 uur.
Hoe wordt Cetirizine geleverd
Cetirizine Hydrochloride drank, USP 5 mg/5 mL (1 mg / mL) is een kleurloze tot lichtgele drank geleverd in flessen van 120 mL.flessen van 120 mL NDC 13668-029-07
Cetirizinehydrochloride drank, USP 5 mg/5 mL (1 mg / mL) is een kleurloze tot lichtgele drank geleverd in flessen van 480 mL.
flessen van 480 mL NDC 13668-029-11
opslag
Bewaren bij 20 ° -25 ° C (68°-77°F); toegestane excursies tot 15°-30°C (59°-86°F).
Rx alleen
vervaardigd door:
Bio-Pharm, Inc.
Levittown, PA 19057
vervaardigd voor:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? En voor of na een bepaalde maaltijd?
meer over cetirizine
- bijwerkingen
- Tijdens zwangerschap of borstvoeding
- doseringsinformatie
- patiënten Tips
- Geneesmiddelafbeeldingen
- geneesmiddelinteracties
- vergelijk alternatieven
- Steungroep
- prijzen & coupons
- 225 beoordelingen
- drug klasse: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 meer
gerelateerde behandelingsgidsen
- allergische Rhinitis
- Urticaria
- Eustachian Tube disfunctie
- fysieke Urticaria
medische Disclaimer
Leave a Reply