Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Le nom chimique est l’acide (±) –1-pipérazinyl] éthoxy] acétique, dichlorhydrate. Le chlorhydrate de cétirizine est un composé racémique de formule empirique C21H25ClN2O3 * 2HCl. Le poids moléculaire est de 461,82 et la structure chimique est illustrée ci-dessous:
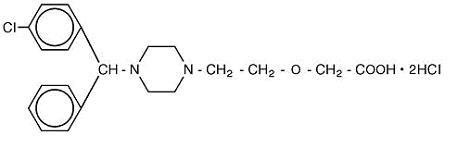
Le dichlorhydrate de cétirizine est une poudre blanche ou presque blanche et est librement soluble dans l’eau, pratiquement insoluble dans l’acétone et dans le chlorure de méthylène. Solution buvable de chlorhydrate de Cétirizine, USP est une solution buvable incolore à légèrement jaune contenant du chlorhydrate de Cétirizine à une concentration de 1 mg / mL (5 mg / 5 mL) pour administration orale. Le pH est compris entre 4 et 5. Les ingrédients inactifs de la solution buvable sont: acide acétique glacial, arôme de raisin, glycérine, méthylparabène, propylène glycol, propylparabène, acétate de sodium, saccharose et eau purifiée.
Cétirizine – Pharmacologie clinique
Mécanisme d’action: La Cétirizine, un métabolite humain de l’hydroxyzine, est un antihistaminique; ses principaux effets sont médiés par l’inhibition sélective des récepteurs H1 périphériques. L’activité antihistaminique de la Cétirizine a été clairement documentée dans divers modèles animaux et humains. Des modèles animaux in vivo et ex vivo ont montré une activité anticholinergique et anti-sérotoninergique négligeable. Dans les études cliniques, cependant, la sécheresse buccale était plus fréquente avec la Cétirizine qu’avec le placebo. Les études de liaison aux récepteurs in vitro n’ont montré aucune affinité mesurable pour d’autres récepteurs que les récepteurs H1. Des études autoradiographiques avec de la Cétirizine radiomarquée chez le rat ont montré une pénétration négligeable dans le cerveau. Des expériences ex vivo chez la souris ont montré que la Cétirizine administrée par voie systémique n’occupe pas de manière significative les récepteurs H1 cérébraux.
Pharmacocinétique:
Absorption: La cétirizine a été rapidement absorbée avec un temps jusqu’à la concentration maximale (T max) d’environ 1 heure après l’administration orale de comprimés ou de solution buvable chez l’adulte. Une biodisponibilité comparable a été trouvée entre les formes posologiques du comprimé et de la solution buvable. Lorsque des volontaires sains ont reçu des doses multiples de Cétirizine (comprimés de 10 mg une fois par jour pendant 10 jours), une concentration plasmatique maximale moyenne (C max) de 311 ng / mL a été observée. Aucune accumulation n’a été observée. La pharmacocinétique de la cétirizine était linéaire pour des doses orales allant de 5 à 60 mg. Les aliments n’ont eu aucun effet sur l’étendue de l’exposition à la cétirizine (ASC), mais le T max a été retardé de 1,7 heure et le C max a été diminué de 23% en présence d’aliments.
Distribution: La liaison moyenne aux protéines plasmatiques de la Cétirizine est de 93%, indépendamment de la concentration comprise entre 25 et 1000 ng / mL, ce qui inclut les taux plasmatiques thérapeutiques observés.
Métabolisme: Une étude de bilan de masse chez 6 volontaires masculins en bonne santé a indiqué que 70% de la radioactivité administrée était récupérée dans les urines et 10% dans les fèces. Environ 50 % de la radioactivité a été identifiée dans l’urine comme étant sous forme inchangée. La majeure partie de l’augmentation rapide de la radioactivité plasmatique maximale était associée au médicament parent, suggérant un faible degré de métabolisme de premier passage. La cétirizine est métabolisée dans une mesure limitée par O-désalkylation oxydative en un métabolite ayant une activité antihistaminique négligeable. La ou les enzymes responsables de ce métabolisme n’ont pas été identifiées.
Élimination: La demi-vie d’élimination moyenne chez 146 volontaires sains dans le cadre de multiples études pharmacocinétiques était de 8,3 heures et la clairance corporelle totale apparente pour la Cétirizine était d’environ 53 mL/min.
Études d’interaction
Des études d’interaction pharmacocinétique avec la Cétirizine chez l’adulte ont été menées avec de la pseudoéphédrine, de l’antipyrine, du kétoconazole, de l’érythromycine et de l’azithromycine.
Aucune interaction n’a été observée. Dans une étude à doses multiples de théophylline (400 mg une fois par jour pendant 3 jours) et de Cétirizine (20 mg une fois par jour pendant 3 jours), une diminution de 16% de la clairance de la Cétirizine a été observée. La disposition de la théophylline n’a pas été modifiée par l’administration concomitante de Cétirizine.
Populations particulières
Patients pédiatriques: Chez les patients pédiatriques âgés de 2 à 5 ans ayant reçu 5 mg de Cétirizine, le C max moyen était de 660 ng / mL. Sur la base de comparaisons entre études, la clairance corporelle totale apparente normalisée en poids était de 81 à 111% plus grande et la demi-vie d’élimination était de 33 à 41% plus courte dans la population pédiatrique que chez les adultes. Chez les patients pédiatriques âgés de 6 à 23 mois ayant reçu une dose unique de 0,25 mg / kg de solution buvable de Cétirizine (dose moyenne de 2,3 mg), le C max moyen était de 390 ng / mL. Sur la base de comparaisons croisées, la clairance corporelle totale apparente normalisée en poids était 304% plus grande et la demi-vie d’élimination était 63% plus courte dans cette population pédiatrique que chez les adultes. L’ASC moyenne (0-t) chez les enfants de 6 mois à < 2 ans recevant la dose maximale de solution de Cétirizine (2,5 mg deux fois par jour) devrait être deux fois plus élevée que celle observée chez les adultes recevant une dose de 10 mg de comprimés de Cétirizine une fois par jour.
Effet du sexe: L’effet du sexe sur la pharmacocinétique de la Cétirizine n’a pas été suffisamment étudié.
Effet de la race : Aucune différence liée à la race dans la cinétique de la cétirizine n’a été observée.
Pharmacodynamique: Le chlorhydrate de cétirizine aux doses de 5 et 10 mg a fortement inhibé la papule et la poussée provoquées par l’injection intradermique d’histamine chez 19 volontaires pédiatriques (âgés de 5 à 12 ans) et l’activité a persisté pendant au moins 24 heures. Dans une étude de 35 jours chez des enfants âgés de 5 à 12 ans, aucune tolérance aux effets antihistaminiques (suppression de la réponse de la papule et de la poussée) du chlorhydrate de cétirizine n’a été trouvée. Chez 10 nourrissons âgés de 7 à 25 mois ayant reçu de 4 à 9 jours de Cétirizine en solution buvable (0,25 mg / kg bid), il y a eu une inhibition de 90% de la papule cutanée induite par l’histamine (10 mg / mL) et une inhibition de 87% de la poussée 12 heures après l’administration de la dernière dose. La pertinence clinique de cette suppression de la réponse de la papule et des poussées induites par l’histamine lors des tests cutanés est inconnue.
Les effets de l’injection intradermique de divers autres médiateurs ou libérateurs d’histamine ont également été inhibés par la Cétirizine, tout comme la réponse à un défi du froid chez les patients atteints d’urticaire induite par le froid. Chez les sujets légèrement asthmatiques, le chlorhydrate de cétirizine à 5 à 20 mg bloquait la bronchoconstriction due à l’histamine nébulisée, avec un blocage pratiquement total après une dose de 20 mg. Dans des études menées jusqu’à 12 heures après le défi antigénique cutané, le recrutement en phase tardive d’éosinophiles, de neutrophiles et de basophiles, composants de la réponse inflammatoire allergique, a été inhibé par le chlorhydrate de Cétirizine à la dose de 20 mg. Dans quatre études cliniques menées chez des hommes adultes en bonne santé, aucune augmentation moyenne cliniquement significative de l’QTc n’a été observée chez les sujets traités par chlorhydrate de cétirizine. Dans la première étude, un essai croisé contrôlé par placebo, le chlorhydrate de cétirizine a été administré à des doses allant jusqu’à 60 mg par jour, soit 6 fois la dose clinique maximale, pendant 1 semaine, et aucun allongement moyen significatif de l’intervalle QTc n’a été observé. Dans la deuxième étude, un essai croisé, le chlorhydrate de cétirizine à 20 mg et l’érythromycine (500 mg toutes les 8 heures) ont été administrés seuls et en association. Il n’y a pas eu d’effet significatif sur le QTc avec l’association ou avec le chlorhydrate de cétirizine seul. Dans le troisième essai, également une étude croisée, le chlorhydrate de Cétirizine à 20 mg et le kétoconazole (400 mg par jour) ont été administrés seuls et en association.
Le chlorhydrate de cétirizine a provoqué une augmentation moyenne de l’intervalle QTc de 9,1 msec par rapport à l’inclusion après 10 jours de traitement. Le kétoconazole a également augmenté l’QTc de 8,3 msec. La combinaison a provoqué une augmentation de 17,4 msec, égale à la somme des effets individuels. Ainsi, il n’y a pas eu d’interaction médicamenteuse significative sur le QTc avec l’association de chlorhydrate de Cétirizine et de kétoconazole. Dans la quatrième étude, un essai parallèle contrôlé par placebo, le chlorhydrate de cétirizine à 20 mg a été administré seul ou en association avec de l’azithromycine (500 mg en dose unique le premier jour suivi de 250 mg une fois par jour). Il n’y a pas eu d’augmentation significative de l’QTc avec le chlorhydrate de Cétirizine 20 mg seul ou en association avec l’azithromycine. Dans un essai clinique de quatre semaines chez des patients pédiatriques âgés de 6 à 11 ans, les résultats de mesures d’ECG obtenues au hasard avant le traitement et après 2 semaines de traitement ont montré que le chlorhydrate de Cétirizine à 5 ou 10 mg n’augmentait pas l’intervalle QTc par rapport au placebo. Dans un essai clinique d’une semaine (N = 86) sur une solution buvable de chlorhydrate de Cétirizine, USP (0,25 mg / kg bid) par rapport au placebo chez des patients pédiatriques âgés de 6 à 11 mois, les mesures ECG effectuées dans les 3 heures suivant la dernière dose n’ont montré aucune anomalie ECG ni augmentation de l’intervalle QTc dans l’un ou l’autre groupe par rapport aux évaluations initiales. Les données d’autres études dans lesquelles du chlorhydrate de cétirizine a été administré à des patients âgés de 6 à 23 mois étaient cohérentes avec les résultats de cette étude.
Les effets du chlorhydrate de Cétirizine sur l’intervalle QTc à des doses supérieures à 10 mg n’ont pas été étudiés chez les enfants de moins de 12 ans. Dans une étude de six semaines contrôlée par placebo sur 186 patients (âgés de 12 à 64 ans) atteints de rhinite allergique et d’asthme léger à modéré, le chlorhydrate de cétirizine 10 mg une fois par jour a amélioré les symptômes de la rhinite et n’a pas altéré la fonction pulmonaire. Dans un essai clinique contrôlé par placebo de deux semaines, une analyse de sous-ensemble de 65 patients asthmatiques atteints de rhinite allergique pédiatrique (âgés de 6 à 11 ans) a montré que le chlorhydrate de cétirizine n’altérait pas la fonction pulmonaire. Ces études soutiennent l’innocuité de l’administration de chlorhydrate de cétirizine aux patients atteints de rhinite allergique pédiatrique et adulte souffrant d’asthme léger à modéré.
Études cliniques: Des essais cliniques multicentriques, randomisés, en double aveugle, comparant 5 à 20 mg de Cétirizine à un placebo chez des patients de 12 ans et plus atteints de rhinite allergique pérenne ont été menés aux États-Unis. Deux d’entre eux ont montré une réduction significative des symptômes de la rhinite allergique pérenne pendant une durée allant jusqu’à 8 semaines. Deux essais cliniques multicentriques randomisés en double aveugle de 4 semaines comparant 5 à 20 mg de Cétirizine à un placebo chez des patients atteints d’urticaire idiopathique chronique ont également été menés et ont montré une amélioration significative des symptômes de l’urticaire idiopathique chronique. En général, la dose de 10 mg était plus efficace que la dose de 5 mg et la dose de 20 mg n’a donné aucun effet supplémentaire. Certains de ces essais comprenaient des patients pédiatriques âgés de 12 à 16 ans. En outre, quatre essais multicentriques, randomisés, contrôlés par placebo et en double aveugle de 2 à 4 semaines chez 534 patients pédiatriques âgés de 6 à 11 ans atteints de rhinite allergique saisonnière ont été menés aux États-Unis à des doses allant jusqu’à 10 mg.
INDICATIONS &UTILISATION
Rhinite allergique pérenne: Solution buvable de chlorhydrate de Cétirizine, USP est indiquée pour le soulagement des symptômes associés à la rhinite allergique pérenne due à des allergènes tels que les acariens, les squames animales et les moisissures chez les enfants de 6 à 23 mois. Les symptômes traités efficacement comprennent les éternuements, la rhinorrhée, les écoulements postnasaux, le prurit nasal, le prurit oculaire et les larmoiements.
Urticaire chronique: Solution buvable de chlorhydrate de Cétirizine, USP est indiqué pour le traitement des manifestations cutanées non compliquées de l’urticaire idiopathique chronique chez les enfants de 6 mois à 5 ans. Il réduit considérablement l’apparition, la gravité et la durée de l’urticaire et réduit considérablement le prurit.
Contre-indications
Chlorhydrate de Cétirizine en solution buvable, USP est contre-indiqué chez les patients présentant une hypersensibilité connue à celui-ci ou à l’un de ses ingrédients ou à l’hydroxyzine.
Précautions
Activités nécessitant une vigilance mentale: Dans les essais cliniques, des cas de somnolence ont été rapportés chez certains patients prenant du chlorhydrate de Cétirizine; la prudence requise doit donc être exercée lors de la conduite d’une voiture ou de l’utilisation de machines potentiellement dangereuses. L’utilisation concomitante de chlorhydrate de Cétirizine avec de l’alcool ou d’autres dépresseurs du SNC doit être évitée car des réductions supplémentaires de la vigilance et une altération supplémentaire des performances du SNC peuvent survenir.
Interactions médicamenteuses: Aucune interaction médicamenteuse cliniquement significative n’a été trouvée avec la théophylline à faible dose, l’azithromycine, la pseudoéphédrine, le kétoconazole ou l’érythromycine. Il y a eu une petite diminution de la clairance de la Cétirizine causée par une dose de 400 mg de théophylline; il est possible que des doses plus importantes de théophylline puissent avoir un effet plus important.
Carcinogenèse, Mutagénèse et Altération de la fertilité: Dans une étude de cancérogénicité sur 2 ans chez le rat, la cétirizine n’était pas cancérogène à des doses alimentaires allant jusqu’à 20 mg/kg (environ 15 fois la dose quotidienne maximale recommandée par voie orale chez l’adulte en mg/m2, ou environ 7 fois la dose quotidienne maximale recommandée par voie orale chez le nourrisson en mg/m2). Dans une étude de cancérogénicité de 2 ans chez la souris, la cétirizine a provoqué une incidence accrue de tumeurs hépatiques bénignes chez les mâles à une dose alimentaire de 16 mg / kg (environ 6 fois la dose quotidienne maximale recommandée par voie orale chez les adultes en mg / m2, ou environ 3 fois la dose quotidienne maximale recommandée par voie orale chez les nourrissons en mg / m2). Aucune augmentation de l’incidence des tumeurs hépatiques n’a été observée chez la souris à une dose alimentaire de 4 mg / kg (environ 2 fois la dose quotidienne maximale recommandée par voie orale chez l’adulte en mg / m2, ou approximativement équivalente à la dose quotidienne maximale recommandée par voie orale chez le nourrisson en mg/ m2). La signification clinique de ces résultats lors d’une utilisation à long terme du chlorhydrate de cétirizine n’est pas connue.
La cétirizine n’a pas été mutagène dans le test d’Ames, ni clastogène dans le test de lymphocytes humains, le test de lymphome de souris et le test de micronoyau in vivo chez le rat.
Dans une étude sur la fertilité et la performance générale de la reproduction chez la souris, la cétirizine n’a pas altéré la fertilité à une dose orale de 64 mg/ kg (environ 25 fois la dose orale quotidienne maximale recommandée chez l’adulte en mg/m2).
Utilisation pédiatrique: L’innocuité du chlorhydrate de cétirizine a été démontrée chez des patients pédiatriques âgés de 6 à 5 ans. L’innocuité de la Cétirizine a été démontrée chez 168 patients âgés de 2 à 5 ans dans des essais contrôlés par placebo d’une durée allant jusqu’à 4 semaines. En mg / kg, la plupart des 168 patients ont reçu entre 0,2 et 0,4 mg / kg de Cétirizine HCl. L’innocuité de la Cétirizine chez 399 patients âgés de 12 à 24 mois a été démontrée dans un essai de 18 mois contrôlé par placebo, dans lequel la dose moyenne était
0,25 mg / kg bid, correspondant à une plage de 4 à 11 mg / jour. L’innocuité du chlorhydrate de Cétirizine en solution buvable, USP a été démontrée chez 42 patients âgés de 6 à 11 mois dans un essai de 7 jours contrôlé par placebo. La dose prescrite était de 0,25 mg / kg bid, ce qui correspondait à une moyenne de 4,5 mg / jour, avec une plage de 3,4 à 6,2 mg / jour.
L’efficacité du chlorhydrate de Cétirizine pour le traitement de la rhinite allergique et de l’urticaire idiopathique chronique chez les enfants âgés de 6 à 5 ans est basée sur une extrapolation de l’efficacité démontrée du chlorhydrate de Cétirizine chez les adultes atteints de ces affections et la probabilité que l’évolution de la maladie, la physiopathologie et l’effet du médicament soient sensiblement similaires entre ces deux populations. L’efficacité est extrapolée jusqu’à l’âge de 6 mois pour la rhinite allergique pérenne, car on pense que cette maladie survient jusqu’à cet âge chez les enfants. Les doses recommandées pour la population pédiatrique sont basées sur des comparaisons croisées de la pharmacocinétique et de la pharmacodynamique de la Cétirizine chez des sujets adultes et pédiatriques et sur le profil de sécurité de la Cétirizine chez des patients adultes et pédiatriques à des doses égales ou supérieures aux doses recommandées. L’ASC de la Cétirizine et la C max chez les sujets pédiatriques âgés de 6 à 23 mois ayant reçu une moyenne de 2.3 mg en une dose unique et chez les sujets âgés de 2 à 5 ans ayant reçu une dose unique de 5 mg de solution buvable de Cétirizine, ont été estimés intermédiaires entre ceux observés chez les adultes ayant reçu une dose unique de 10 mg de comprimés de Cétirizine et ceux ayant reçu une dose unique de 20 mg de comprimés de Cétirizine.
L’innocuité et l’efficacité de la Cétirizine chez les enfants de moins de 6 mois n’ont pas été établies.
Effets indésirables
Des études pédiatriques ont été menées avec du chlorhydrate de cétirizine. Plus de 1300 patients pédiatriques âgés de 6 à 11 ans dont plus de 900 traités avec du chlorhydrate de Cétirizine à des doses de 1,25 à 10 mg par jour ont été inclus dans des essais cliniques contrôlés et non contrôlés menés aux États-Unis. La durée du traitement variait de 2 à 12 semaines. Les essais contrôlés par placebo d’une durée allant jusqu’à 4 semaines ont inclus 168 patients pédiatriques âgés de 2 à 5 ans qui ont reçu de la cétirizine, dont la majorité a reçu des doses quotidiennes uniques de 5 mg. Un essai contrôlé par placebo d’une durée de 18 mois a inclus 399 patients âgés de 12 à 24 mois traités par la Cétirizine (0.25 mg / kg bid), et un autre essai contrôlé par placebo d’une durée de 7 jours a inclus 42 patients âgés de 6 à 11 mois qui ont été traités par de la Cétirizine (0,25 mg / kg bid).
La majorité des effets indésirables rapportés chez les enfants âgés de 2 à 11 ans sous chlorhydrate de cétirizine étaient légers ou modérés. Dans les essais contrôlés versus placebo, l’incidence des interruptions dues à des effets indésirables chez les patients pédiatriques recevant jusqu’à 10 mg de chlorhydrate de Cétirizine était peu fréquente (0,4 % sous chlorhydrate de Cétirizine contre 1,0 % sous placebo).
Le tableau 1 répertorie les effets indésirables rapportés pour le chlorhydrate de Cétirizine à 5 et 10 mg chez des patients pédiatriques âgés de 6 à 11 ans lors d’essais cliniques contrôlés par placebo aux États-Unis et qui étaient plus fréquents avec le chlorhydrate de Cétirizine que le placebo. Parmi ceux-ci, les douleurs abdominales étaient considérées comme liées au traitement et la somnolence semblait être liée à la dose, 1,3% dans le placebo, 1,9% à 5 mg et 4,2% à 10 mg. Les effets indésirables rapportés chez des patients pédiatriques âgés de 2 à 5 ans dans les essais contrôlés versus placebo étaient qualitativement similaires en nature et généralement similaires en fréquence à ceux rapportés dans les essais avec des enfants âgés de 6 à 11 ans.
Dans les essais contrôlés versus placebo de patients pédiatriques âgés de 6 à 24 mois, l’incidence des effets indésirables était similaire dans les groupes traités par la Cétirizine et le placebo dans chaque étude. La somnolence est apparue avec essentiellement la même fréquence chez les patients ayant reçu de la Cétirizine et chez les patients ayant reçu un placebo. Dans une étude d’une durée de 1 semaine chez des enfants âgés de 6 à 11 mois, les patients ayant reçu de la Cétirizine ont présenté une irritabilité / une agitation plus grande que les patients sous placebo. Dans une étude d’une durée de 18 mois chez des patients de 12 mois et plus, l’insomnie est apparue plus fréquemment chez les patients recevant de la Cétirizine que chez les patients recevant un placebo (9,0% contre 5,3%). Chez les patients ayant reçu 5 mg ou plus de Cétirizine par jour par rapport aux patients ayant reçu le placebo, la fatigue (3,6% v. 1,3%) et le malaise (3,6% v. 1,8%) sont survenus plus fréquemment.
Tableau 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Bronchospasme | 1,9% | 3,1% | 1,9% |
| Nausées | 1,9% | 1,9% | 2,8% |
| Vomissements | 1,0% | 2,5% | 2,3% |
Les événements suivants ont été observés rarement (moins de 2%), soit chez 3982 adultes et enfants de 12 ans et plus, soit chez 659 patients pédiatriques âgés de 6 à 11 ans qui reçu du chlorhydrate de cétirizine dans des essais aux États-Unis, y compris une étude ouverte chez l’adulte d’une durée de six mois. Une relation causale de ces événements peu fréquents avec l’administration de chlorhydrate de cétirizine n’a pas été établie.
Système nerveux autonome: anorexie, bouffées vasomotrices, augmentation de la salivation, rétention urinaire.
Cardiovasculaire: insuffisance cardiaque, hypertension, palpitations, tachycardie.
Systèmes nerveux central et périphérique: coordination anormale, ataxie, confusion, dysphonie, hyperesthésie, hyperkinésie, hypertonie, hypoesthésie, crampes aux jambes, migraine, myélite, paralysie, paresthésie, ptose, syncope, tremblements, contractions, vertiges, défaut du champ visuel.
Gastro-intestinal: fonction hépatique anormale, caries dentaires aggravées, constipation, dyspepsie, éructation, flatulences, gastrite, hémorroïdes, augmentation de l’appétit, méléna, hémorragie rectale, stomatite y compris stomatite ulcéreuse, décoloration de la langue, œdème de la langue.
Génito-urinaire: cystite, dysurie, hématurie, fréquence de miction, polyurie, incontinence urinaire, infection des voies urinaires.
Audition et vestibulaire: surdité, mal d’oreille, ototoxicité, acouphènes.
Métabolique / nutritionnel: déshydratation, diabète sucré, soif.
Appareil locomoteur: arthralgie, arthrite, arthrose, faiblesse musculaire, myalgie.
Psychiatrie: pensée anormale, agitation, amnésie, anxiété, diminution de la libido, dépersonnalisation, dépression, labilité émotionnelle, euphorie, troubles de la concentration, insomnie, nervosité, paroniria, trouble du sommeil.
Système respiratoire: bronchite, dyspnée, hyperventilation, augmentation des expectorations, pneumonie, troubles respiratoires, rhinite, sinusite, infection des voies respiratoires supérieures.
Reproduction: dysménorrhée, douleurs mammaires féminines, saignements intermenstruels, leucorrhée, ménorragie, vaginite.
Réticulo-Endothélial: lymphadénopathie.
Peau: acné, alopécie, œdème de quincke, éruption bulleuse, dermatite, peau sèche, eczéma, éruption érythémateuse, furonculose, hyperkératose, hypertrichose, augmentation de la transpiration, éruption maculopapulaire, réaction de photosensibilité, réaction toxique de photosensibilité, prurit, purpura, éruption cutanée, séborrhée, trouble cutané, nodule cutané, urticaire.
Sens particuliers: parosmie, perte de goût, perversion du goût.
Vision: cécité, conjonctivite, douleur oculaire, glaucome, perte d’accommodation, hémorragie oculaire, xérophtalmie.
Le corps dans son ensemble: blessure accidentelle, asthénie, maux de dos, douleurs thoraciques, abdomen élargi, œdème du visage, fièvre, œdème généralisé, bouffées de chaleur, augmentation du poids, œdème des jambes, malaise, polype nasal, douleur, pâleur, œdème périorbitaire, œdème périphérique, rigueurs.
Des cas occasionnels d’élévations transitoires et réversibles des transaminases hépatiques sont survenus au cours du traitement par la cétirizine. Une hépatite avec une élévation significative des transaminases et une élévation de la bilirubine en association avec l’utilisation de chlorhydrate de Cétirizine a été rapportée.
Expérience post-commercialisation
Au cours de la période post-commercialisation, les événements indésirables supplémentaires rares mais potentiellement graves suivants ont été rapportés: réaction agressive, anaphylaxie, cholestase, convulsions, glomérulonéphrite, hallucinations, anémie hémolytique, hépatite, dyskinésie orofaciale, hypotension sévère, mortinatalité, idées suicidaires, suicide, thrombocytopénie et pustulose exanthémateuse aiguë généralisée (AGEP).
Pour signaler LES EFFETS INDÉSIRABLES SUSPECTÉS, contactez Torrent Pharma Inc. au 800-912-9561 ou FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch .
Toxicomanie et dépendance
Aucune information n’indique qu’un abus ou une dépendance se produit avec le chlorhydrate de cétirizine.
Surdosage
Un surdosage avec le chlorhydrate de cétirizine a été rapporté. Chez un patient adulte ayant pris 150 mg de chlorhydrate de Cétirizine, le patient était somnolent, mais ne présentait aucun autre signe clinique ni aucun résultat chimique ou hématologique anormal dans le sang. Chez un patient pédiatrique âgé de 18 mois qui a pris une surdose de chlorhydrate de Cétirizine (environ 180 mg), une agitation et une irritabilité ont été observées initialement; cela a été suivi de somnolence. En cas de surdosage, le traitement doit être symptomatique ou de soutien, en tenant compte de tout médicament ingéré en même temps. Il n’existe pas d’antidote spécifique connu au chlorhydrate de cétirizine. Le chlorhydrate de cétirizine n’est pas éliminé efficacement par dialyse et la dialyse sera inefficace à moins qu’un agent dialysable n’ait été ingéré de manière concomitante. Les doses orales létales minimales aiguës étaient de 237 mg/kg chez la souris (environ 95 fois la dose orale quotidienne maximale recommandée chez l’adulte en mg/m2, soit environ 40 fois la dose orale quotidienne maximale recommandée chez le nourrisson en mg/m2) et de 562 mg/kg chez le rat (environ 460 fois la dose orale quotidienne maximale recommandée chez l’adulte en mg/m2, soit environ 190 fois la dose orale quotidienne maximale recommandée chez le nourrisson en mg/m2. Chez les rongeurs, la cible de toxicité aiguë était le système nerveux central et la cible de toxicité à doses multiples était le foie.
POSOLOGIE &ADMINISTRATION
Solution buvable de chlorhydrate de cétirizine, USP peut être prise sans égard à la consommation alimentaire.
Enfants de 2 à 5 ans pour l’urticaire chronique: La dose initiale recommandée de Solution buvable de chlorhydrate de Cétirizine, USP chez les enfants âgés de 2 à 5 ans est de 2,5 mg (½ cuillère à café) de solution buvable une fois par jour. La posologie dans ce groupe d’âge peut être augmentée à une dose maximale de 5 mg par jour administrée sous forme de 1 cuillère à café de solution buvable une fois par jour, ou d’une ½ cuillère à café de solution buvable toutes les 12 heures.
Enfants de 6 mois à < 2 ans pour la Rhinite allergique pérenne et l’Urticaire chronique: La dose recommandée de Solution buvable de chlorhydrate de Cétirizine, USP chez les enfants de 6 mois à 23 mois est de 2,5 mg (½ cuillère à café) une fois par jour. La dose chez les enfants de 12 à 23 mois peut être augmentée à une dose maximale de 5 mg par jour, administrée à raison de ½ cuillère à café (2,5 mg) toutes les 12 heures.
Comment la Cétirizine est-elle fournie
La solution buvable de chlorhydrate de Cétirizine, USP 5 mg / 5 mL (1 mg / mL) est une solution buvable incolore à légèrement jaune fournie en flacons de 120 mL.
Flacons de 120 mL NDC 13668-029-07
Solution buvable de chlorhydrate de cétirizine, USP 5 mg / 5 mL (1 mg / mL) est une solution buvable incolore à légèrement jaune fournie en flacons de 480 mL.
Bouteilles de 480 mL NDC 13668-029-11
STOCKAGE
Conserver à 20 °-25 ° C (68 °-77 ° F); excursions autorisées à 15 °-30 °C (59 °-86 °F).
Rx Uniquement
Fabriqué par:
Bio-Pharm, Inc.
Levittown, PA 19057
Fabriqué pour:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? Et avant ou après un repas particulier?
En savoir plus sur la cétirizine
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Conseils aux patients
- Images des médicaments
- Interactions médicamenteuses
- Comparez les alternatives
- Groupe de soutien
- Prix &Coupons
- 225 Avis
- Classe de médicaments: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 autres
Guides de traitement connexes
- Rhinite allergique
- Urticaire
- Dysfonctionnement de la trompe d’Eustache
- Urticaire physique
Avertissement médical
Leave a Reply