Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Det kemiske navn er (L.) – – – 1-eddikesyre, dihydrochlorid. Hydrochlorid er en racemisk forbindelse med en empirisk formel af C21H25ClN2O3 * 2HCl. Molekylvægten er 461,82, og den kemiske struktur er vist nedenfor:
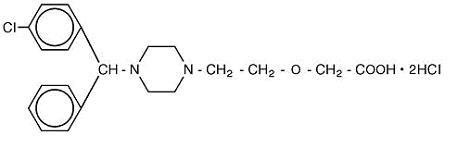
cetirisindihydrochlorid er et hvidt eller næsten hvidt pulver og er frit opløseligt i vand, praktisk talt uopløseligt i acetone og i methylenchlorid. Oral opløsning, USP er en farveløs til svagt gul oral opløsning indeholdende cetirisinhydrochlorid i en koncentration på 1 mg/mL (5 mg/5 mL) til oral administration. PH-værdien er mellem 4 og 5. De inaktive ingredienser i den orale opløsning er: iseddikesyre, druesmag, glycerin, methylparaben, propylenglycol, propylparaben, natriumacetat, saccharose og renset vand.
Klinisk Farmakologi
virkningsmekanisme:; dets vigtigste virkninger medieres via selektiv inhibering af perifere H1-receptorer. Den antihistaminiske aktivitet af Cetirisin er tydeligt dokumenteret i en række dyre-og menneskelige modeller. In vivo og tidligere vivo dyremodeller har vist ubetydelig antikolinerg og anti-serotonerg aktivitet. I kliniske studier var mundtørhed imidlertid mere almindelig med cetirisin end med placebo. In vitro-receptorbindingsundersøgelser har ikke vist nogen målbar affinitet for andre end H1-receptorer. Autoradiografiske undersøgelser med radioaktivt mærket cetirisin hos rotter har vist ubetydelig penetration i hjernen. Tidligere vivo-eksperimenter i musen har vist, at systemisk administreret Cetirisin ikke optager signifikant cerebrale H1-receptorer.1 time efter oral administration af tabletter eller oral opløsning hos voksne. Sammenlignelig biotilgængelighed blev fundet mellem tablet-og orale opløsningsdoseringsformer. Når raske frivillige blev administreret flere doser Cetirisin (10 mg tabletter en gang dagligt i 10 dage), blev der observeret en gennemsnitlig maksimal plasmakoncentration (C maks.) på 311 ng/mL. Der blev ikke observeret nogen akkumulering. Farmakokinetikken var lineær for orale doser fra 5 til 60 mg. Mad havde ingen effekt på omfanget af eksponering for CETIRISIN (AUC), Men T maks blev forsinket med 1,7 timer, og C maks blev reduceret med 23% Ved tilstedeværelse af mad.
Distribution: Den gennemsnitlige plasmaproteinbinding af Cetirisin er 93% uafhængig af koncentrationen i området 25-1000 ng / mL, hvilket inkluderer de observerede terapeutiske plasmaniveauer.
metabolisme: en massebalanceundersøgelse hos 6 raske mandlige frivillige viste, at 70% af den administrerede radioaktivitet blev genvundet i urinen og 10% i fæces. Cirka 50% af radioaktiviteten blev identificeret i urinen som uændret lægemiddel. Det meste af den hurtige stigning i maksimal plasmaradioaktivitet var forbundet med moderlægemiddel, hvilket antyder en lav grad af first-pass metabolisme. Cetirisin metaboliseres i begrænset omfang ved oksidativ o-dealkylering til en metabolit med ubetydelig antihistaminaktivitet. De stoffer, der er ansvarlige for denne metabolisme, er ikke blevet identificeret.Elimination: den gennemsnitlige eliminationshalveringstid hos 146 raske frivillige på tværs af flere farmakokinetiske studier var 8,3 timer, og den tilsyneladende totale kropsclearance for Cetirisin var ca.53 mL/min.interaktionsstudier
interaktionsstudier
Farmakokinetiske interaktionsstudier med cetirisin hos voksne blev udført med pseudoephedrin, antipyrin, ketoconasol, erythromycin og acithromycin.
ingen interaktioner blev observeret. I en flerdosisundersøgelse af theophyllin (400 mg en gang dagligt i 3 dage) og Cetirisin (20 mg en gang dagligt i 3 dage) blev der observeret et fald på 16% i clearance af Cetirisin. Dispositionen af theophyllin blev ikke ændret ved samtidig administration af cetirisin.
særlige populationer
pædiatriske patienter: Hos pædiatriske patienter i alderen 2 til 5 år, der fik 5 mg cetirisin, var den gennemsnitlige C-maks 660 ng/mL. Baseret på sammenligninger af krydsundersøgelser var den normaliserede vægt, tilsyneladende total kropsclearance 81-111% større, og eliminationshalveringstiden var 33 Til 41% kortere i den pædiatriske population end hos voksne. Hos pædiatriske patienter i alderen 6 til 23 måneder, der fik en enkelt dosis på 0,25 mg/kg oral opløsning (gennemsnitlig dosis 2,3 mg), var gennemsnittet C maks 390 ng/mL. Baseret på sammenligninger på tværs af undersøgelser var den vægt-normaliserede, tilsyneladende totale kropsclearance 304% større, og eliminationshalveringstiden var 63% kortere i denne pædiatriske population sammenlignet med voksne. Den gennemsnitlige AUC (0-t) hos børn 6 måneder til < 2 år, der får den maksimale dosis cetirisinopløsning (2, 5 mg to gange dagligt), forventes at være to gange højere end den, der observeres hos voksne, der får en dosis på 10 mg cetirisin tabletter en gang dagligt.
effekt af køn: virkningen af køn på cetiritsins farmakokinetik er ikke undersøgt tilstrækkeligt.effekt af Race: der er ikke observeret racerelaterede forskelle i kinetikken af Cetirisin.farmakodynamik: cetirisinhydrochlorid i doser på 5 og 10 mg hæmmede kraftigt hvalen og flare forårsaget af intradermal injektion af histamin hos 19 pædiatriske frivillige (i alderen 5 til 12 år), og aktiviteten varede i mindst 24 timer. I et 35-dages studie med børn i alderen 5 til 12 år blev der ikke fundet nogen tolerance over for de antihistaminiske (suppression af hval-og flare-respons) virkninger af cetirisinhydrochlorid. Hos 10 spædbørn i alderen 7 til 25 måneder, som fik 4 til 9 dages cetirisin i en oral opløsning (0,25 mg/kg to gange dagligt), var der en 90% hæmning af histamininduceret (10 mg/mL) kutan hval og 87% hæmning af flare 12 timer efter administration af den sidste dosis. Den kliniske relevans af denne suppression af histamininduceret hval-og flare-respons ved hudtest er ukendt.virkningerne af intradermal injektion af forskellige andre mediatorer eller histamin releasers blev også hæmmet af Cetirisin, ligesom respons på en kold udfordring hos patienter med koldinduceret urticaria. Hos mildt astmatiske personer blokerede cetirisinhydrochlorid ved 5 til 20 mg bronchokonstriktion på grund af forstøvet histamin med næsten total blokade efter en dosis på 20 mg. I undersøgelser udført i op til 12 timer efter kutan antigenudfordring blev den sene fase rekruttering af eosinofiler, neutrofiler og basofiler, komponenter i den allergiske inflammatoriske respons, hæmmet af cetiricinhydrochlorid i en dosis på 20 mg. I fire kliniske studier hos raske voksne mænd blev der ikke observeret nogen klinisk signifikant gennemsnitlig stigning i CTC hos patienter behandlet med cetiricinhydrochlorid. I den første undersøgelse, et placebokontrolleret crossover-forsøg, blev cetiricinhydrochlorid givet i doser op til 60 mg dagligt, 6 gange den maksimale kliniske dosis i 1 uge, og der forekom ingen signifikant gennemsnitlig forlængelse af KTC. I den anden undersøgelse blev et crossover-forsøg, cetirisinhydrochlorid 20 mg og erythromycin (500 mg hver 8.time) givet alene og i kombination. Der var ingen signifikant effekt på CTC med kombinationen eller med cetirisinhydrochlorid alene. I det tredje forsøg blev der også givet en crossover-undersøgelse, 20 mg cetirisinhydrochlorid og 400 mg dagligt alene og i kombination.
hydrochlorid forårsagede en gennemsnitlig stigning i KTC på 9,1 MSEK fra baseline efter 10 dages behandling. Ketoconasol øgede også KTC med 8,3 MSEK. Kombinationen forårsagede en stigning på 17, 4 MSEK, svarende til summen af de individuelle effekter. Der var således ingen signifikant lægemiddelinteraktion på KTC med kombinationen af cetiricinhydrochlorid og ketoconasol. I den fjerde undersøgelse, et placebokontrolleret parallelt forsøg, blev cetiricinhydrochlorid 20 mg givet alene eller i kombination med asithromycin (500 mg som en enkelt dosis på den første dag efterfulgt af 250 mg en gang dagligt). Der var ingen signifikant stigning i Cetiricinhydrochlorid 20 mg alene eller i kombination med cetiricinhydrochlorid. I et fire ugers klinisk forsøg med pædiatriske patienter i alderen 6 til 11 år viste resultater af tilfældigt opnåede EKG-målinger før behandling og efter 2 ugers behandling, at cetirisinhydrochlorid 5 eller 10 mg ikke øgede Kvtc versus placebo. I et uges klinisk forsøg (N=86) med Oral opløsning, USP (0,25 mg/kg to gange dagligt) sammenlignet med placebo hos pædiatriske patienter i alderen 6 til 11 måneder viste EKG-målinger taget inden for 3 timer efter den sidste dosis ingen EKG-abnormiteter eller stigninger i Kvtc-interval i nogen af grupperne sammenlignet med baseline-vurderinger. Data fra andre undersøgelser, hvor cetiricinhydrochlorid blev administreret til patienter i alderen 6-23 måneder, var i overensstemmelse med resultaterne i denne undersøgelse.
virkningerne af cetirisinhydrochlorid på KTC-intervallet ved doser højere end 10 mg er ikke undersøgt hos børn under 12 år. I en seks ugers, placebokontrolleret undersøgelse af 186 patienter (i alderen 12 til 64 år) med allergisk rhinitis og mild til moderat astma forbedrede cetirisinhydrochlorid 10 mg en gang dagligt rhinitissymptomer og ændrede ikke lungefunktionen. I et to-ugers, placebokontrolleret klinisk forsøg, en delmængde analyse af 65 pædiatriske (i alderen 6 til 11 år) allergisk rhinitis patienter med astma viste cetirisinhydrochlorid ændrede ikke lungefunktionen. Disse undersøgelser understøtter sikkerheden ved administration af cetiricinhydrochlorid til pædiatriske og voksne allergiske rhinitis patienter med mild til moderat astma.kliniske studier: multicenter, randomiserede, dobbeltblinde kliniske forsøg, der sammenlignede Cetirisin 5 til 20 mg med placebo hos patienter 12 år og ældre med flerårig allergisk rhinitis blev udført i USA. To af disse viste signifikante reduktioner i symptomer på flerårig allergisk rhinitis i op til 8 ugers varighed. To 4-ugers multicenter, randomiserede, dobbeltblinde, kliniske forsøg, der sammenlignede 5 til 20 mg med placebo hos patienter med kronisk idiopatisk urticaria, blev også udført og viste signifikant forbedring af symptomer på kronisk idiopatisk urticaria. Generelt var dosis på 10 mg mere effektiv end dosis på 5 mg, og dosis på 20 mg gav ingen ekstra effekt. Nogle af disse forsøg omfattede pædiatriske patienter i alderen 12 til 16 år. Derudover blev fire multicenter, randomiserede, placebokontrollerede, dobbeltblinde 2-4 ugers forsøg hos 534 pædiatriske patienter i alderen 6 til 11 år med sæsonbetinget allergisk rhinitis udført i USA i doser op til 10 mg.
indikationer& anvendelse
flerårig allergisk Rhinitis: Oral opløsning af Cetirisinhydrochlorid, USP er indiceret til lindring af symptomer forbundet med flerårig allergisk rhinitis på grund af allergener som støvmider, dyrehår og forme hos børn 6 til 23 måneder. Symptomer, der behandles effektivt, inkluderer nysen, rhinorrhea, postnasal udflod, nasal kløe, okulær kløe og rive.
kronisk Urticaria: Cetirisinhydrochlorid Oral opløsning, USP er indiceret til behandling af de ukomplicerede hud manifestationer af kronisk idiopatisk urticaria hos børn 6 måneder til 5 år. Det reducerer forekomsten, sværhedsgraden og varigheden af nældefeber betydeligt og reducerer kløe betydeligt.
kontraindikationer
USP er kontraindiceret hos patienter med en kendt overfølsomhed over for det eller nogen af dets ingredienser eller hydroksysin.
forholdsregler
aktiviteter, der kræver Mental årvågenhed: i kliniske forsøg er forekomsten af somnolens rapporteret hos nogle patienter, der tager cetirisinhydrochlorid; der skal derfor udvises forsigtighed, når du kører bil eller betjener potentielt farlige maskiner. Samtidig brug af CNS hydrochlorid med alkohol eller andre CNS-depressiva bør undgås, fordi yderligere reduktioner i årvågenhed og yderligere forringelse af CNS-ydeevne kan forekomme.der er ikke fundet nogen klinisk signifikante lægemiddelinteraktioner med theophyllin i en lav dosis. Der var et lille fald i clearance af cetirisin forårsaget af en 400 mg dosis theophyllin; det er muligt, at større theophyllindoser kunne have en større effekt.
carcinogenese, mutagenese og nedsat fertilitet: i et 2-årigt karcinogenicitetsstudie med rotter var cetirisin ikke karcinogent ved diætdoser på op til 20 mg/kg (ca.15 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m 2-basis eller ca. 7 gange den maksimale anbefalede daglige orale dosis hos spædbørn på mg / m 2-basis). I et 2-årigt karcinogenicitetsstudie hos mus forårsagede cetirisin en øget forekomst af godartede levertumorer hos mænd ved en diætdosis på 16 mg/kg (ca.6 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m 2-basis eller ca. 3 gange den maksimale anbefalede daglige orale dosis hos spædbørn på mg/m 2-basis). Der blev ikke observeret nogen stigning i forekomsten af levertumorer hos mus ved en diætdosis på 4 mg/kg (cirka 2 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m 2-basis eller omtrent svarende til den maksimale anbefalede daglige orale dosis hos spædbørn på mg/m 2-basis). Den kliniske betydning af disse fund ved langvarig brug af cetirisinhydrochlorid er ikke kendt.
cetirisin var ikke mutagent i Ames-testen og ikke klastogent i den humane lymfocytanalyse, muselymfomanalysen og in vivo mikronukleustest hos rotter.
i et studie med fertilitet og generel reproduktionsevne hos mus nedsatte cetirisin ikke fertiliteten ved en oral dosis på 64 mg/kg (ca.25 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m 2-basis).
pædiatrisk anvendelse: sikkerheden ved cetirisinhydrochlorid er påvist hos pædiatriske patienter i alderen 6 til 5 år. Sikkerheden af Cetirisin er påvist hos 168 patienter i alderen 2 til 5 år i placebokontrollerede forsøg af op til 4 ugers varighed. På basis af mg / kg fik de fleste af de 168 patienter mellem 0,2 og 0,4 mg/kg HCl. Sikkerheden af Cetirisin hos 399 patienter i alderen 12 til 24 måneder er blevet påvist i et placebokontrolleret 18-måneders studie, hvor den gennemsnitlige dosis var
0,25 mg/kg to gange daglig, svarende til et interval på 4 til 11 mg/dag. Sikkerheden ved Oral opløsning, USP er påvist hos 42 patienter i alderen 6 til 11 måneder i et placebokontrolleret 7-dages forsøg. Den ordinerede dosis var 0,25 mg / kg to gange dagligt, hvilket svarede til et gennemsnit på 4,5 mg/dag med et interval på 3,4 til 6,2 mg/dag.
effektiviteten af cetirisinhydrochlorid til behandling af allergisk rhinitis og kronisk idiopatisk urticaria hos pædiatriske patienter i alderen 6 til 5 år er baseret på en ekstrapolering af den påviste effekt af Cetirisinhydrochlorid hos voksne med disse tilstande og sandsynligheden for, at sygdomsforløbet, patofysiologien og lægemidlets virkning er i det væsentlige ens mellem disse to populationer. Effekten ekstrapoleres ned til 6 måneder for flerårig allergisk rhinitis, fordi denne sygdom menes at forekomme ned til disse aldre hos børn. De anbefalede doser til den pædiatriske population er baseret på sammenligninger af farmakokinetikken og farmakodynamikken af cetirisin hos voksne og pædiatriske forsøgspersoner og på sikkerhedsprofilen for Cetirisin hos både voksne og pædiatriske patienter i doser, der er lig med eller højere end de anbefalede doser. Hos pædiatriske forsøgspersoner i alderen 6 til 23 måneder, der fik et gennemsnit på 2.3 mg i en enkelt dosis og hos personer i alderen 2 til 5 år, der fik en enkelt dosis på 5 mg cetirisin oral opløsning, blev estimeret til at være mellemliggende mellem det, der blev observeret hos voksne, der fik en enkelt dosis på 10 mg cetirisin tabletter, og dem, der fik en enkelt dosis på 20 mg cetirisin tabletter.
sikkerheden og effektiviteten af cetirisin hos pædiatriske patienter under 6 måneder er ikke blevet fastslået.
bivirkninger
pædiatriske undersøgelser blev udført med cetirisinhydrochlorid. Mere end 1300 pædiatriske patienter i alderen 6 til 11 år med mere end 900 behandlet med cetirisinhydrochlorid i doser på 1,25 til 10 mg dagligt blev inkluderet i kontrollerede og ukontrollerede kliniske forsøg udført i USA. Behandlingsvarigheden varierede fra 2 til 12 uger. Placebokontrollerede forsøg op til 4 ugers varighed omfattede 168 pædiatriske patienter i alderen 2 til 5 år, som fik Cetirisin, hvoraf størstedelen fik daglige enkeltdoser på 5 mg. Et placebokontrolleret forsøg med en varighed på 18 måneder omfattede 399 patienter i alderen 12 til 24 måneder behandlet med Cetirisin (0.25 mg/kg to gange daglig) og et andet placebokontrolleret studie af 7 dages varighed omfattede 42 patienter i alderen 6 til 11 måneder, som blev behandlet med Cetirisin (0,25 mg/kg to gange daglig).
størstedelen af de bivirkninger, der blev rapporteret hos pædiatriske patienter i alderen 2 til 11 år med cetirisinhydrochlorid, var milde eller moderate. I placebokontrollerede forsøg var forekomsten af seponeringer på grund af bivirkninger hos pædiatriske patienter, der fik op til 10 mg cetirisinhydrochlorid, ikke almindelig (0,4% på cetiricinhydrochlorid versus 1,0% på placebo).
tabel 1 viser bivirkninger, der blev rapporteret for cetiricinhydrochlorid 5 og 10 mg hos pædiatriske patienter i alderen 6 til 11 år i placebokontrollerede kliniske forsøg i USA og var mere almindelige med cetiricinhydrochlorid end placebo. Af disse blev mavesmerter betragtet som behandlingsrelaterede, og somnolens syntes at være dosisrelateret, 1, 3% i placebo, 1, 9% ved 5 mg og 4, 2% ved 10 mg. De bivirkninger, der blev rapporteret hos pædiatriske patienter i alderen 2 til 5 år i placebokontrollerede forsøg, var kvalitativt ens i naturen og generelt ens i hyppighed som dem, der blev rapporteret i forsøg med børn i alderen 6 til 11 år.
i de placebokontrollerede forsøg med pædiatriske patienter i alderen 6 til 24 måneder var forekomsten af bivirkninger ens i grupperne i hver undersøgelse. Somnolens forekom med stort set samme hyppighed hos patienter, der fik cetirisin, og patienter, der fik placebo. I en undersøgelse af 1 uges varighed hos børn i alderen 6-11 måneder udviste patienter, der fik Cetirisin, større irritabilitet/besværlighed end patienter, der fik placebo. I en undersøgelse af 18 måneders varighed hos patienter 12 måneder og ældre forekom søvnløshed hyppigere hos patienter, der fik Cetirisin sammenlignet med patienter, der fik placebo (9, 0% V, 5, 3%). Hos de patienter, der fik 5 mg eller mere om dagen, sammenlignet med patienter, der fik placebo, forekom træthed (3, 6% V, 1, 3%) og utilpashed (3, 6% V, 1, 8%) hyppigere.
tabel 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| bronkospasme | 1, 9% | 3, 1% | 1, 9% |
| kvalme | 1, 9% | 2, 8% | |
| opkastning | 1,0% | 2,5% | 2,3% |
følgende hændelser blev observeret sjældent (mindre end 2%), hos enten 3982 voksne og børn 12 år og ældre eller hos 659 pædiatriske patienter i alderen 6 til 11 år, der fik cetirisinhydrochlorid i amerikanske forsøg, herunder en åben voksenundersøgelse af seks måneders varighed. Der er ikke påvist en årsagssammenhæng mellem disse sjældne hændelser og administration af cetiritsinhydrochlorid.
autonome nervesystem: anoreksi, rødme, øget salivation, urinretention.
kardiovaskulær: hjertesvigt, hypertension, hjertebanken, takykardi.
centrale og perifere nervesystemer: unormal koordination, ataksi, forvirring, dysfoni, hyperesthesi, hyperkinesi, hypertoni, hypoestesi, benkramper, migræne, myelitis, lammelse, paræstesi, ptose, synkope, rysten, rykninger, svimmelhed, synsfeltdefekt.
Gastrointestinal: unormal leverfunktion, forværrede tandkaries, forstoppelse, dyspepsi, erctation, flatulens, gastritis, hæmorroider, øget appetit, melena, rektal blødning, stomatitis inklusive ulcerøs stomatitis, misfarvning af tungen, tungeødem.
Genitourinary: cystitis, dysuri, hæmaturi, micturition frekvens, polyuri, urininkontinens, urinvejsinfektion.
hørelse og vestibulær: døvhed, ørepine, ototoksicitet, tinnitus.
metabolisk / ernæringsmæssig: dehydrering, diabetes mellitus, tørst.
muskuloskeletale: artralgi, arthritis, arthrose, muskelsvaghed, myalgi.
psykiatrisk: unormal tænkning, agitation, amnesi, angst, nedsat libido, depersonalisering, depression, følelsesmæssig labilitet, eufori, nedsat koncentration, søvnløshed, nervøsitet, paroniria, søvnforstyrrelse.
åndedrætssystem: bronkitis, dyspnø, hyperventilation, øget sputum, lungebetændelse, respiratorisk lidelse, rhinitis, bihulebetændelse, øvre luftvejsinfektion.
reproduktiv: dysmenorrhea, Kvindelig brystsmerter, intermenstruel blødning, leukorrhea, menorrhagia, vaginitis.
Reticuloendothelial: lymfadenopati.
hud: acne, alopeci, angioødem, bullous eruption, dermatitis, tør hud, eksem, erythematøs udslæt, furunkulose, hyperkeratose, hypertrichose, øget svedtendens, makulopapulært udslæt, lysfølsomhedsreaktion, lysfølsomhed toksisk reaktion, kløe, purpura, udslæt, seborrhea, hudlidelse, hudknude, urticaria.
særlige sanser: parosmi, smagstab, smagsperversion.
Vision: blindhed, conjunctivitis, øjensmerter, glaukom, tab af indkvartering, okulær blødning, kserophthalmia.
krop som helhed: utilsigtet skade, asteni, rygsmerter, brystsmerter, forstørret mave, ansigtsødem, feber, generaliseret ødem, hot flashes, øget vægt, benødem, utilpashed, nasal polyp, smerte, lak, periorbital ødem, perifert ødem, rigor.der er lejlighedsvis forekommet forbigående, reversible levertransaminaseforhøjelser under behandling med cetirisin. Der er rapporteret om Hepatitis med signifikant forhøjet transaminase og forhøjet bilirubin i forbindelse med brugen af cetirisinhydrochlorid.
erfaring efter markedsføring
i perioden efter markedsføring er følgende yderligere sjældne, men potentielt alvorlige bivirkninger rapporteret: aggressiv reaktion, anafylaksi, kolestase, kramper, glomerulonephritis, hallucinationer, hæmolytisk anæmi, hepatitis, orofacial dyskinesi, svær hypotension, dødfødsel, selvmordstanker, selvmord, trombocytopeni og akut generaliseret eksanthematøs pustulose (AGEP).kontakt Torrent Pharma Inc for at rapportere formodede bivirkninger. ved 800-912-9561 eller FDA ved 1-800-FDA-1088 eller www.fda.gov/medwatch.
stofmisbrug og afhængighed
der er ingen oplysninger, der tyder på, at misbrug eller afhængighed forekommer med cetirisinhydrochlorid.
overdosering
overdosering er rapporteret. Hos en voksen patient, der tog 150 mg cetirisinhydrochlorid, var patienten somnolent, men udviste ingen andre kliniske tegn eller unormale blodkemi eller hæmatologiske resultater. Hos en 18 måneder gammel pædiatrisk patient, der tog en overdosis af cetirisinhydrochlorid (cirka 180 mg), blev rastløshed og irritabilitet oprindeligt observeret; dette blev efterfulgt af døsighed. Hvis overdosering forekommer, skal behandlingen være symptomatisk eller understøttende under hensyntagen til samtidig indtagelse af medicin. Der er ingen kendt specifik antidot mod cetirisinhydrochlorid. Hydrochlorid fjernes ikke effektivt ved dialyse, og dialyse vil være ineffektiv, medmindre et dialyserbart middel er blevet indtaget samtidigt. De akutte minimale dødelige orale doser var 237 mg/kg hos mus (ca.95 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m2-basis eller ca. 40 gange den maksimale anbefalede daglige orale dosis hos spædbørn på mg/m2-basis) og 562 mg/kg hos rotter (ca. 460 gange den maksimale anbefalede daglige orale dosis hos voksne på mg/m2-basis eller ca. 190 gange den maksimale anbefalede daglige orale dosis hos spædbørn på mg / m2. Hos gnavere var målet for akut toksicitet centralnervesystemet, og målet for flerdosistoksicitet var leveren.
dosering & ADMINISTRATION
Oral opløsning, USP kan tages uden hensyn til fødevareforbrug.
børn 2 til 5 år for kronisk Urticaria: den anbefalede initialdosis Oral opløsning, USP hos børn i alderen 2 til 5 år er 2,5 mg (liter teskefuld) oral opløsning en gang dagligt. Doseringen i denne aldersgruppe kan øges til en maksimal dosis på 5 mg dagligt givet som 1 tsk oral opløsning en gang dagligt eller en liter teskefuld oral opløsning givet hver 12.time.
børn 6 måneder til < 2 år for flerårig allergisk Rhinitis og kronisk Urticaria: den anbefalede dosis Oral opløsning af Cetiricinhydrochlorid, USP hos børn fra 6 måneder til 23 måneder er 2,5 mg (liter teskefuld) en gang dagligt. Dosis hos børn i alderen 12 til 23 måneder kan øges til en maksimal dosis på 5 mg dagligt, givet som en teskefuld (2,5 mg) hver 12.time.
hvordan leveres cetirisin
Oral opløsning, USP 5 mg/5 mL (1 mg/mL) er en farveløs til let gul oral opløsning, der leveres i flasker på 120 mL.
flasker med 120 mL NDC 13668-029-07
USP 5 mg/5 mL (1 mg / mL) er en farveløs til let gul oral opløsning leveret i flasker på 480 mL.
Flasker 480 mL NDC 13668-029-11
OPBEVARING
Opbevares ved 20°-25°C (68°-77°F); udflugter tilladt til 15°-30°C (59°-86°F) .
kun
fremstillet af:
Bio-Pharm, Inc.19057
fremstillet til:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? Og før eller efter et bestemt måltid?
- bivirkninger
- under graviditet eller amning
- doseringsinformation
- Patienttips
- Lægemiddelbilleder
- lægemiddelinteraktioner
- Sammenlign alternativer
- supportgruppe
- prissætning &kuponer
- 225 anmeldelser
- drug class: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 mere
relaterede behandlingsvejledninger
- allergisk Rhinitis
- Urticaria
- Eustachian Tube dysfunktion
- fysisk Urticaria
medicinsk ansvarsfraskrivelse
Leave a Reply