Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. 化学名は(±)–1-ピペラジニル]エトキシ]酢酸、二塩酸塩です。 塩酸セチリジンは、c21H25Cln2O3•2hclの実験式を有するラセミ化合物である。 分子量は461.82であり、化学構造は下記に示されています:
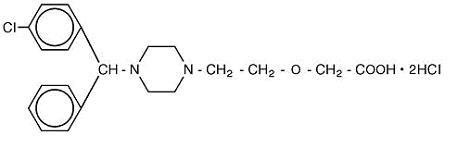
セチリジンのdihydrochlorideは白いですかほとんど白い粉で、水で自由に溶け、アセトンと塩化メチ Cetirizineの塩酸塩の口頭解決、USPは経口投与のための1つのmg/mL(5つのmg/5つのmL)の集中でCetirizineの塩酸塩を含んでいるわずかに黄色い口頭解決へ無色です。 PHは4と5の間です。 経口溶液の不活性成分は、氷酢酸、ブドウ風味、グリセリン、メチルパラベン、プロピレングリコール、プロピルパラベン、酢酸ナトリウム、ショ糖および精製水であ
セチリジン-臨床薬理学
作用機序:ヒドロキシジンのヒト代謝産物であるセチリジンは抗ヒスタミン薬である; その主な効果は、末梢H1受容体の選択的阻害を介して媒介される。 セチリジンの抗ヒスタミン活性は、様々な動物およびヒトモデルにおいて明確に文書化されている。 In vivoおよびex vivoの動物モデルは無視できる抗コリン作動性および反セロトニン作動性の活動を示しました。 しかし、臨床研究では、口渇はプラセボよりもセチリジンでより一般的でした。 In vitroの受容器の結合の調査はH1受容器以外のための測定可能な類縁を示しませんでした。 ラットにおける放射性標識セチリジンを用いたオートラジオグラフィー研究は、脳へのごくわずかな浸透を示している。 マウスにおけるEx vivo実験は、全身投与セチリジンが有意に脳H1受容体を占有しないことを示している。
薬物動態:
吸収:セチリジンは、成人における錠剤または経口溶液の経口投与後約1時間の最大濃度(T max)までの時間で急速に吸収された。 錠剤と経口溶液剤形との間で同等の生物学的利用能が見出された。 健康なボランティアにセチリジンの複数用量(10mg錠剤を10日間毎日一度)を投与した場合、311ng/mLの平均ピーク血漿濃度(C max)が観察された。 蓄積は認められなかった。 セチリジンの薬物動態は5から60mgまで及ぶ口頭線量のために線形でした。 食物はセチリジン曝露(AUC)の程度に影響を及ぼさなかったが、T maxは1.7時間遅れ、C maxは食物の存在下で23%減少した。
分布: セチリジンの平均血漿タンパク質結合は93%であり、観察された治療血漿レベルを含む25-1000ng/mLの範囲の濃度とは無関係である。
代謝:6人の健康な男性ボランティアを対象としたマスバランス研究では、投与された放射能の70%が尿中に、10%が糞便中に回収されたことが示された。 放射能のおよそ50%は変更されていない薬剤として尿で識別されました。 ピーク血しょう放射能の急速な増加の大部分は親薬物と関連しており,ファーストパス代謝の程度が低いことを示唆していた。 セチリジンは、抗ヒスタミン活性を無視できる代謝産物への酸化的O-脱アルキル化によって限られた程度まで代謝される。 この代謝に関与する酵素または酵素は同定されていない。
排除:複数の薬物動態学的研究にわたる146人の健康なボランティアにおける平均排除半減期は8.3時間であり、セチリジンの見かけの総体クリアランスは約53mL/分であった。
相互作用研究
成人におけるセチリジンとの薬物動態学的相互作用研究は、プソイドエフェドリン、アンチピリン、ケトコナゾール、エリスロマイシンおよびアジスロマイシンを用いて行われた。
相互作用は観察されなかった。 テオフィリン(400mg一日一回3日間)とセチリジン(20mg一日一回3日間)の複数用量研究では、セチリジンのクリアランスの16%の減少が観察された。 セチリジン併用投与ではテオフィリンの性質は変化しなかった。
特別集団
小児患者: セチリジンの5mgを受けた2-5歳の小児患者では、平均C maxは660ng/mLであった。 交差調査の比較に基づいて、重量は正常化しました、明白な総ボディ整理は81-111%より大きく、除去の半減期は大人のより小児科の人口で33から41%短かった。 0.25mg/kgセチリジン経口溶液(平均用量2.3mg)の単回投与を受けた6-23ヶ月の小児患者では、平均C maxは390ng/mLであった。 クロススタディ比較に基づいて、体重正規化された見かけの総身体クリアランスは304%大きく、排除半減期は成人と比較してこの小児集団で63%短かった。 6ヶ月から<2歳までの小児における平均AUC(0-t)は、セチリジン溶液(2.5mg一日二回)の最大用量を受けている成人で観察されたものよりも二倍高くなると予想される10mgセチリジン錠一日一回の用量を受けている。
性別の影響:セチリジンの薬物動態に対する性別の影響は十分に研究されていない。
人種の影響:セチリジンの動力学における人種関連の違いは観察されていない。
人種の影響:セチリジンの動態に人種関連の違いは観察されていない。
薬力学:5および10mgの用量での塩酸セチリジンは、19人の小児ボランティア(5-12歳)におけるヒスタミンの皮内注射によって引き起こされる小麦およびフレアを強く阻害し、活性は少なくとも24時間持続した。 5歳から12歳の小児の35日間の研究では、塩酸セチリジンの抗ヒスタミン薬(小麦およびフレア応答の抑制)効果に対する耐性は見出されなかった。 経口溶液(0.25mg/kg bid)中でセチリジンの4-9日を受けた10歳の乳児7-25ヶ月では、ヒスタミン誘発性(10mg/mL)の皮膚ウィールの90%阻害および最後の用量の投与後87%のフレアの阻害が12時間であった。 皮膚検査におけるヒスタミン誘発性ウィールおよびフレア応答のこの抑制の臨床的関連性は不明である。
他の様々なメディエーターまたはヒスタミン離型剤の皮内注射の効果もセチリジンによって阻害され、寒冷誘発性蕁麻疹患者における寒冷チャレンジへの応答であった。 穏やかに喘息の主題では、5から20mgのセチリジンの塩酸塩は20mgの線量の後で事実上総封鎖のnebulizedヒスタミンによるbronchoconstrictionを、妨げました。 皮膚抗原チャレンジ後12時間まで実施された研究では、好酸球、好中球および好塩基球、アレルギー性炎症応答の成分の後期相募集は、20mgの用量で塩酸セチリジン 健康な成人男性における四つの臨床研究では、qtcの臨床的に有意な平均増加は、塩酸セチリジン治療被験者で観察されなかった。 最初の研究では、プラセボ対照クロスオーバー試験では、塩酸セチリジンは、一日あたり60mgまでの用量で、最大臨床用量の6倍、1週間与えられ、有意な平均QTc 第二の研究では、クロスオーバー試験、塩酸セチリジン20mgとエリスロマイシン(500mgごとに8時間)は、単独で、組み合わせて与えられました。 併用または塩酸セチリジン単独ではQtcに有意な影響はなかった。 第三の試験では、また、クロスオーバー研究、セチリジン塩酸塩20mgとケトコナゾール(一日あたり400mg)は、単独で、組み合わせて与えられました。
塩酸セチリジンは、治療の9.1日後のベースラインから10msecのQTcの平均増加を引き起こした。 ケトコナゾールも8.3msecによってQTcを増加させた。 この組み合わせは、個々の効果の合計に等しい17.4ミリ秒の増加を引き起こした。 したがって,塩酸セチリジンとケトコナゾールの組み合わせとのQtc上の有意な薬物相互作用はなかった。 第四の研究では、プラセボ対照並列試験、セチリジン塩酸塩20mgは、単独で、またはアジスロマイシンと組み合わせて与えられた(500mgは、一日一回250mgに続いて最初の日に単回投与として)。 塩酸セチリジン20mg単独またはアジスロマイシンとの組み合わせでQTcの有意な増加はなかった。 6-11歳の小児患者を対象とした四週間の臨床試験では、治療前および治療の2週間後にランダムに得られたECG測定の結果は、塩酸セチリジン5または10mgがプラセボ対QTcを増加させなかったことを示した。 セチリジン塩酸塩経口溶液の一週間の臨床試験(N=86)では、usp(0.25mg/kg bid)は、小児患者のプラセボと比較して6-11ヶ月齢、最後の用量の3時間以内に撮影されたECG測定は、ベースライン評価と比較して、いずれの群でもECG異常またはQTc間隔の増加を示さなかった。 セチリジン塩酸塩が6-23ヶ月齢の患者に投与された他の研究からのデータは、この研究の所見と一致していた。
10mgを超える用量でのqtc間隔に対する塩酸セチリジンの効果は、12歳未満の小児では研究されていない。 アレルギー性鼻炎および軽度から中等度の喘息を有する186人の患者(12歳から64歳)を対象としたプラセボ対照研究では、塩酸セチリジン10mgが毎日鼻炎症状を改善し、肺機能を変化させなかった。 二週間、プラセボ対照臨床試験では、喘息を有する65小児(6-11歳)アレルギー性鼻炎患者のサブセット分析は、塩酸セチリジンが肺機能を変化させなかったことを示した。 これらの調査は喘息を緩和するために穏やかの小児科および大人のアレルギー鼻炎の患者にセチリジンの塩酸塩を管理することの安全を支えます。
臨床試験:多施設、無作為化、二重盲検、セチリジン5-20mgをプラセボと比較した臨床試験12歳以上の多年生アレルギー性鼻炎患者が米国で実施された。 これらのうちの2つは、多年生のアレルギー性鼻炎の症状の有意な減少を最大8週間にわたって示した。 慢性特発性蕁麻疹患者におけるセチリジン5-20mgをプラセボと比較した4週間の多施設、無作為化、二重盲検臨床試験も実施され、慢性特発性蕁麻疹の症状の有意な改善を示した。 一般に、10mgの用量は5mgの用量よりも効果的であり、20mgの用量は追加の効果を与えなかった。 これらの試験のいくつかには、12〜16歳の小児患者が含まれていました。 さらに、季節性アレルギー性鼻炎を有する6歳から11歳の小児患者534人を対象とした多施設、無作為化、プラセボ対照、二重盲検2-4週間の試験を、米国で10mgまでの用量で実施した。
徴候&使用法
不断のアレルギー鼻炎:Cetirizineの塩酸塩の口頭解決、USPは子供の塵のダニ、動物のふけおよび型のようなアレルゲンによる不断のアレルギー性鼻炎と関連付けられる徴候の救助のために6から23か月の年齢示されます。 効果的に扱われる徴候はくしゃみをすること、rhinorrhea、postnasal排出、鼻のpruritus、目のpruritusおよび引き裂くことを含んでいます。
慢性蕁麻疹:塩酸セチリジン経口溶液、USPは、6ヶ月から5歳の小児における慢性特発性蕁麻疹の合併症のない皮膚症状の治療に適応される。 これは、蕁麻疹の発生、重症度、および持続時間を有意に減少させ、掻痒を有意に減少させる。
禁忌
塩酸セチリジン経口溶液、USPは、それまたはその成分またはヒドロキシジンのいずれかに対する過敏症を有する患者には禁忌である。
注意事項
精神的覚醒を必要とする活動:臨床試験では、塩酸セチリジンを服用している一部の患者で傾眠の発生が報告されているため、車を運転したり、潜在的に危険な機械を操作する際には十分な注意が払われるべきである。 アルコールまたは他のCNSの抑制剤とのCetirizineの塩酸塩の同時使用はcnsの性能の警報そして付加的な減損の付加的な減少が起こるかもしれないので避ける
薬物-薬物相互作用:低用量のテオフィリン、アジスロマイシン、pseudoephedrine、ケトコナゾール、またはエリスロマイシンとの臨床的に有意な薬物相互作用は見出されていない。 テオフィリンの400mgの線量によって引き起こされるセチリジンの整理に小さい減少がありました;より大きいテオフィリンの線量がより大きい効果をもたらすことができることは可能です。
発癌、変異誘発および生殖能力の障害:ラットにおける2年間の発癌性試験では、セチリジンは20mg/kgまでの食事用量で発癌性がなかった(成人ではmg/m2ベースで最大推奨毎日経口用量の約15倍、または乳児ではmg/m2ベースで最大推奨毎日経口用量の約7倍)。 マウスにおける2年間の発癌性試験では、セチリジンは16mg/kgの食事用量で男性の良性肝腫瘍の発生率を増加させた(成人の最大推奨毎日経口用量の約6倍、または乳児の最大推奨毎日経口用量の約3倍のmg/m2ベース)。 マウスでは、4mg/kgの食事用量で肝腫瘍の発生率の増加は観察されなかった(成人ではmg/m2ベースで最大推奨毎日経口用量の約2倍、またはmg/m2ベースで乳児で最大推奨毎日経口用量とほぼ同等)。 塩酸セチリジンの長期使用中のこれらの所見の臨床的意義は知られていない。
セチリジンは、エイムズ試験では変異原性ではなく、ヒトリンパ球アッセイ、マウスリンパ腫アッセイ、およびラットのin vivo小核試験ではclastogenicではなかった。
マウスの生殖能力および一般的な生殖能力の研究では、セチリジンは64mg/kgの経口用量(成人の最大推奨毎日の経口用量の約25倍のmg/m2ベース)で生殖能を損なわなかった。
小児使用:塩酸セチリジンの安全性は、6歳から5歳の小児患者で実証されています。 セチリジンの安全性は、2〜5歳の168人の患者において、最大4週間のプラセボ対照試験で実証されている。 Mg/kgの基礎で、168人の患者のほとんどはセチリジンHClの0.2そして0.4mg/kgの間で受け取りました。 399人の12-24ヶ月の患者におけるセチリジンの安全性は、プラセボ対照の18ヶ月の試験で実証されており、平均用量は
0.25mg/kg bidであり、4-11mg/日の範囲に相当する。 セチリジン塩酸塩経口溶液、USPの安全性は、プラセボ対照7日間の試験で6-11ヶ月の42人の患者で実証されています。 処方された用量は0.25mg/kg bidであり、これは4.5mg/日の平均に対応し、3.4から6.2mg/日の範囲であった。
6-5歳の小児患者におけるアレルギー性鼻炎および慢性特発性蕁麻疹の治療のための塩酸セチリジンの有効性は、これらの状態を有する成人における塩酸セチリジンの実証された有効性の外挿に基づいており、疾患の経過、病態生理および薬物の効果は、これら二つの集団間で実質的に類似している可能性がある。 有効性は多年生のアレルギー鼻炎のための年齢の6か月にこの病気が子供のこれらの年齢に起こると考えられるので外挿されます。 小児集団の推奨用量は、成人および小児被験者におけるセチリジンの薬物動態および薬力学のクロススタディ比較、および推奨用量と同等またはそれ以上の用量での成人および小児患者におけるセチリジンの安全性プロファイルに基づいている。 セチリジンAUCおよびc maxは、6-23ヶ月の小児被験者において、平均2を受けた。3mgの単回投与と2-5歳の被験者では、5mgのセチリジン経口溶液を単回投与したが、10mgのセチリジン錠剤を単回投与した成人と20mgのセチリジン錠剤を単回投与した成人で観察されたものとの中間であると推定された。
6ヶ月未満の小児患者におけるセチリジンの安全性および有効性は確立されていない。
有害反応
小児研究は、塩酸セチリジンを用いて行われました。 米国で実施された制御および制御されていない臨床試験には、1日あたり1.25〜10mgの用量で塩酸セチリジンで治療された1300人以上の6〜11歳の小児患者900人以上が含まれていた。 治療期間は2-12週間であった。 4週間までのプラセボ対照試験には、セチリジンを投与された2歳から5歳の小児患者168人が含まれ、その大部分は5mgの単回投与を受けた。 プラセボ対照試験18ヶ月間の期間には、セチリジンで治療した12〜24ヶ月の399人の患者が含まれていた(0.25mg/kg bid)、および7日間の期間の別のプラセボ対照試験には、セチリジン(0.25mg/kg bid)で治療された6-11ヶ月の42人の患者が含まれていた。
塩酸セチリジンを用いた2-11歳の小児患者で報告された有害反応の大部分は、軽度または中等度であった。 プラセボ対照試験では、最大10mgの塩酸セチリジンを投与された小児患者の副作用による中止の発生率はまれであった(塩酸セチリジンで0.4%対プラセボで1.0%)。
表1は、米国におけるプラセボ対照臨床試験において、6歳から11歳の小児患者における塩酸セチリジン5および10mgについて報告され、プラセボよりも塩酸セチリジンでより一般的であった有害経験を示している。 これらのうち、腹痛は治療関連と考えられ、傾眠は用量関連であり、プラセボでは1.3%、5mgでは1.9%、10mgでは4.2%であった。 プラセボ対照試験で2歳から5歳の小児患者で報告された有害経験は、本質的に定性的に類似しており、6歳から11歳の小児を対象とした試験で報告されたものと一般的に頻度が類似していた。
6-24ヶ月齢の小児患者のプラセボ対照試験では、有害経験の発生率は、各研究のセチリジンおよびプラセボ治療群で同様であった。 傾眠は、セチリジンを投与した患者とプラセボを投与した患者で本質的に同じ頻度で起こった。 年齢の子供の1週の持続期間の調査では6-11か月、セチリジンを受け取った患者は偽薬の患者より大きい過敏症/fussinessを示しました。 患者における18ヶ月の期間の研究では12ヶ月以上,不眠症は、プラセボを受けた患者と比較してセチリジンを受けた患者でより頻繁に発生しました(9.0%v.5.3%). プラセボを受けた患者と比較して、セチリジンの一日あたり5mg以上を受けた患者では、疲労(3.6%v.1.3%)および倦怠感(3.6%v.1.8%)がより頻繁に発生した。
表1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1. | 2.5% | 2.3% |
セチリジンを受けた成人3982人および12歳以上の小児または659人の6歳から11歳の小児患者で、以下のイベントがまれに観察された(2%未満)。半年の期間の開いた大人の調査を含む米国の試験の塩酸塩。 これらのまれな事象と塩酸セチリジン投与との因果関係は確立されていない。
自律神経系:食欲不振、潮紅、唾液分泌の増加、尿閉。
心血管:心不全、高血圧、動悸、頻脈。
中枢および末梢神経系:異常な協調、運動失調、混乱、発声障害、知覚過敏、運動亢進、運動亢進、運動亢進、感覚低下、脚のけいれん、片頭痛、脊髄炎、麻痺、感覚異常、眼瞼下垂、失神、振戦、けいれん、めまい、視野欠損。
胃腸: 肝機能異常、悪化した歯のう蝕、便秘、消化不良、eructation、鼓腸、胃炎、痔、高められた食欲、melena、直腸の出血、潰瘍性口内炎を含む口内炎、舌の変色、舌の浮腫。尿生殖器:膀胱炎、排尿障害、血尿、排尿頻度、多尿症、尿失禁、尿路感染症。
尿生殖器:膀胱炎、排尿障害、血尿、排尿頻度、多尿症、尿失禁、尿路感染症。
聴覚および前庭:難聴、耳痛、耳毒性、耳鳴り。
代謝/栄養:脱水、糖尿病、喉の渇き。
筋骨格系: 関節痛、関節炎、関節症、筋力低下、筋肉痛。精神医学:異常な思考、興奮、記憶喪失、不安、性欲減退、脱個人化、うつ病、感情的不安定性、陶酔感、集中障害、不眠症、緊張、パロニリア、睡眠障害。
精神医学:異常な思考、興奮、健忘、不安、性欲減退、脱個人化、うつ病、感情的不安定性、陶酔感、集中障害、不眠症、緊張、パロニリア、睡眠障害。呼吸器系:気管支炎、呼吸困難、過換気、痰の増加、肺炎、呼吸器疾患、鼻炎、副鼻腔炎、上気道感染症。
呼吸器系:気管支炎、呼吸困難、過換気、痰の増加、肺炎、呼吸器疾患、鼻炎、副
生殖:月経困難症、女性の胸の痛み、月経間出血、白血球減少、月経過多、膣炎。
網状内皮: リンパ節腫脹。
皮膚:にきび、脱毛症、血管浮腫、水疱性発疹、皮膚炎、乾燥肌、湿疹、紅斑性発疹、furunculosis、角化亢進症、多毛症、発汗の増加、黄斑丘疹、光感受性反応、光感受性毒性反応、そう痒症、紫斑病、発疹、脂漏症、皮膚障害、皮膚結節、蕁麻疹。
特別な感覚:parosmia、味の損失、味の倒錯。
ビジョン:失明、結膜炎、眼の痛み、緑内障、調節の喪失、眼出血、眼球乾燥症。
全体としての体: 偶発的な傷害、無力症、背中の痛み、胸の痛み、腹部の拡大、顔の浮腫、発熱、全身浮腫、ほてり、体重の増加、脚の浮腫、倦怠感、鼻のポリープ、痛み、蒼白、眼窩周囲浮腫、末梢浮腫、厳しさ。
セチリジン療法中に一過性の可逆性肝トランスアミナーゼ上昇の時折のインスタンスが発生しています。 塩酸セチリジンの使用に関連して有意なトランスアミナーゼ上昇およびビリルビン上昇を伴う肝炎が報告されている。
市販後の経験
市販後の期間には、積極的な反応、アナフィラキシー、胆汁うっ滞、痙攣、糸球体腎炎、幻覚、溶血性貧血、肝炎、口腔顔面ジスキネジー、重度の低血圧、死産、自殺念慮、自殺、血小板減少症および急性全身性発疹性膿疱症(AGEP)が報告されている。
有害反応の疑いを報告するには、Torrent Pharma Inc.にお問い合わせください。 800-912-9561または1-800-FDA-1088のFDAまたはwww.fda.gov/medwatch…..
薬物乱用と依存
塩酸セチリジンで乱用や依存が起こることを示す情報はありません。
過量投与
過量投与は塩酸セチリジンで報告されている。 塩酸セチリジン150mgを服用した成人患者では、患者は傾眠していたが、他の臨床徴候または異常な血液化学または血液学的結果を示さなかった。 セチリジン塩酸塩(約180mg)の過剰摂取を受けた18ヶ月の小児患者では、落ち着きのなさと過敏性が最初に観察された; これに続いて眠気が続いた。 過剰摂取が発生した場合、同時に摂取された薬物を考慮して、治療は対症療法または支持的でなければならない。 塩酸セチリジンに対する特異的な解毒剤は知られていない。 塩酸セチリジンは透析によって効果的に除去されず、透析可能な薬剤が同時に摂取されない限り、透析は効果がない。 急性の最小致死量の経口投与量は、マウスで237mg/kg(成人ではmg/m2ベースで最大推奨毎日経口投与量の約95倍、または乳児ではmg/m2ベースで最大推奨毎日経口投与量の約40倍)およびラットで562mg/kg(成人ではmg/m2ベースで最大推奨毎日経口投与量の約460倍、または乳児ではmg/m2ベースで最大推奨毎日経口投与量の約190倍)であった。 げっ歯類では、急性毒性の標的は中枢神経系であり、複数回投与毒性の標的は肝臓であった。
投与量&投与
セチリジン塩酸塩経口溶液、USPは、食品消費に関係なく取ることができます。
慢性蕁麻疹のための子供2-5年:セチリジン塩酸塩経口溶液の推奨初期用量、2-5歳の子供のUSPは、毎日一度2.5mg(½ティースプーン)経口溶液である。 この年齢層の投与量は、1日1回小さじ1杯の経口溶液、または12時間ごとに小さじ1杯の経口溶液として与えられた1日あたり5mgの最大用量に増
子供6ヶ月から<多年生アレルギー性鼻炎および慢性蕁麻疹のための2年:セチリジン塩酸塩経口溶液、6ヶ月から23ヶ月の子供のUSPの推奨用量は、2.5mg(½ティースプーンフル)一日一回である。 12-23ヶ月齢の小児の用量は、1日あたり5mgの最大用量まで増加させることができ、12時間ごとに½ティースプーン(2.5mg)として与えられる。塩酸セチリジン経口液、USP5mg/5mL(1mg/mL)は、120mLのボトルで供給される無色からわずかに黄色の経口液です。
120mLのボトルNDC13668-029-07
セチリジン塩酸塩経口溶液、USP5mg/5mL(1mg/mL)は、480mLのボトルに供給される無色からわずかに黄色の経口溶液である。
480mLのボトルNDC13668-029-11
ストレージ
20°-25°C(68°-77°F)で保存し、15°-30°C(59°-86°F)までの遠足が許可されています。
Rxのみ
製造:バイオファーム社
Levittown,PA19057
のために製造された:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? そして、任意の特定の食事の前または後に?
セチリジンについての詳細
- 副作用
- 妊娠中または授乳中
- 投与量情報
- 患者のヒント
- 薬物画像
- 薬物相互作用
- 代替案を比較
- サポートグループ
- 価格&クーポン
- 225レビュー
- 薬物クラス: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, …
Leave a Reply