Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. El nombre químico es ácido (±) – -1 – piperazinil] etoxi] acético, dihidrocloruro. El clorhidrato de cetirizina es un compuesto racémico con una fórmula empírica de C21H25ClN2O3 •2HCl. El peso molecular es de 461,82 y la estructura química se muestra a continuación:
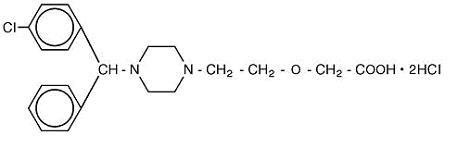
El dihidrocloruro de cetirizina es un polvo blanco o casi blanco y es libremente soluble en agua, prácticamente insoluble en acetona y cloruro de metileno. Solución oral de clorhidrato de Cetirizina, USP es una solución oral incolora a ligeramente amarilla que contiene clorhidrato de Cetirizina a una concentración de 1 mg/ml (5 mg/5 ml) para administración oral. El pH está entre 4 y 5. Los ingredientes inactivos de la solución oral son: ácido acético glacial, sabor a uva, glicerina, metilparabeno, propilenglicol, propilparabeno, acetato de sodio, sacarosa y agua purificada.
Cetirizine – Farmacología Clínica
Mecanismo de acción: la Cetirizina, un metabolito humano de la hidroxizina es un antihistamínico; sus principales efectos están mediados por la inhibición selectiva de los receptores periféricos H1. La actividad antihistamínica de la cetirizina se ha documentado claramente en una variedad de modelos animales y humanos. Los modelos animales in vivo y ex vivo han mostrado una actividad anticolinérgica y anti-serotoninérgica insignificante. Sin embargo, en los ensayos clínicos, la sequedad de boca fue más frecuente con la cetirizina que con el placebo. Los estudios de unión a receptores in vitro no han mostrado afinidad medible por otros receptores distintos de los H1. Los estudios autorradiográficos con cetirizina radiomarcada en ratas han mostrado una penetración insignificante en el cerebro. Experimentos ex vivo en ratones han demostrado que la cetirizina administrada sistémicamente no ocupa significativamente los receptores cerebrales H1.
Farmacocinética: Absorción: La cetirizina se absorbió rápidamente con un tiempo hasta la concentración máxima (T max) de aproximadamente 1 hora después de la administración oral de comprimidos o solución oral en adultos. Se encontró una biodisponibilidad comparable entre las formas de dosificación de comprimidos y soluciones orales. Cuando se administraron dosis múltiples de Cetirizina a voluntarios sanos (comprimidos de 10 mg una vez al día durante 10 días), se observó una concentración plasmática máxima media (C máx) de 311 ng/ml. No se observó acumulación. La farmacocinética de la cetirizina fue lineal para dosis orales de 5 a 60 mg. Los alimentos no tuvieron efecto sobre el grado de exposición a la Cetirizina (AUC), pero la T max se retrasó 1,7 horas y la C max se redujo en un 23% en presencia de alimentos.
Distribución: La unión media a proteínas plasmáticas de la cetirizina es del 93%, independientemente de la concentración en el intervalo de 25-1000 ng/ml, que incluye los niveles plasmáticos terapéuticos observados.Metabolismo: Un estudio de balance de masas en 6 voluntarios varones sanos indicó que el 70% de la radiactividad administrada se recuperaba en la orina y el 10% en las heces. Aproximadamente el 50% de la radiactividad se identificó en la orina como fármaco inalterado. La mayor parte del rápido aumento de la radiactividad plasmática máxima se asoció con el fármaco original, lo que sugiere un bajo grado de metabolismo de primer paso. La cetirizina se metaboliza en grado limitado por O-desalquilación oxidativa a un metabolito con actividad antihistamínica despreciable. No se ha identificado la enzima o enzimas responsables de este metabolismo.Eliminación: La semivida de eliminación media en 146 voluntarios sanos en múltiples estudios farmacocinéticos fue de 8,3 horas y el aclaramiento corporal total aparente de Cetirizina fue de aproximadamente 53 ml / min.
Estudios de interacción
Se realizaron estudios de interacción farmacocinética con Cetirizina en adultos con pseudoefedrina, antipirina, ketoconazol, eritromicina y azitromicina.
No se observaron interacciones. En un estudio de dosis múltiples de teofilina (400 mg una vez al día durante 3 días) y Cetirizina (20 mg una vez al día durante 3 días), se observó una disminución del 16% en el aclaramiento de Cetirizina. La disposición de la teofilina no se vio alterada por la administración concomitante de cetirizina.
Poblaciones especiales
Pacientes pediátricos: En pacientes pediátricos de 2 a 5 años de edad que recibieron 5 mg de Cetirizina, la C max media fue de 660 ng/ml. De acuerdo con las comparaciones de estudios cruzados, el aclaramiento corporal total aparente normalizado en función del peso fue de 81-111% mayor y la semivida de eliminación fue de 33 a 41% más corta en la población pediátrica que en los adultos. En pacientes pediátricos de 6 a 23 meses de edad que recibieron una dosis única de 0,25 mg/kg de solución oral de Cetirizina (dosis media de 2,3 mg), la C máxima media fue de 390 ng/ml. De acuerdo con las comparaciones de estudios cruzados, el aclaramiento corporal total aparente normalizado por peso fue 304% mayor y la semivida de eliminación fue 63% más corta en esta población pediátrica en comparación con los adultos. Se espera que el AUC medio(0-t) en niños de 6 meses a < de 2 años de edad que reciben la dosis máxima de solución de Cetirizina (2,5 mg dos veces al día) sea dos veces mayor que el observado en adultos que reciben una dosis de comprimidos de Cetirizina de 10 mg una vez al día.Efecto del sexo: No se ha estudiado adecuadamente el efecto del sexo en la farmacocinética de la cetirizina.
Efecto de la raza: No se han observado diferencias relacionadas con la raza en la cinética de la cetirizina.
Farmacodinámica: clorhidrato de cetirizina a dosis de 5 y 10 mg inhibió fuertemente el ronquido y el brote causados por la inyección intradérmica de histamina en 19 voluntarios pediátricos (de 5 a 12 años de edad) y la actividad persistió durante al menos 24 horas. En un estudio de 35 días en niños de 5 a 12 años, no se encontró tolerancia a los efectos antihistamínicos (supresión de la respuesta al ronquido y al brote) del clorhidrato de cetirizina. En 10 niños de 7 a 25 meses de edad que recibieron de 4 a 9 días de Cetirizina en una solución oral (0,25 mg/kg dos veces al día), hubo una inhibición del 90% de la inflamación cutánea inducida por histamina (10 mg/ml) y una inhibición del 87% de la exacerbación 12 horas después de la administración de la última dosis. Se desconoce la relevancia clínica de esta supresión de la respuesta de ronchas y brotes inducidos por histamina en las pruebas cutáneas.Los efectos de la inyección intradérmica de varios otros mediadores o liberadores de histamina también fueron inhibidos por la cetirizina, al igual que la respuesta a un desafío por frío en pacientes con urticaria inducida por frío. En sujetos ligeramente asmáticos, clorhidrato de cetirizina a dosis de 5 a 20 mg bloqueó la broncoconstricción debido a la histamina nebulizada, con un bloqueo prácticamente total después de una dosis de 20 mg. En estudios realizados hasta 12 horas después de la exposición cutánea a antígenos, el reclutamiento en fase tardía de eosinófilos, neutrófilos y basófilos, componentes de la respuesta inflamatoria alérgica, fue inhibido por clorhidrato de cetirizina a una dosis de 20 mg. En cuatro ensayos clínicos en varones adultos sanos, no se observaron aumentos medios clínicamente significativos del intervalo QTc en sujetos tratados con clorhidrato de cetirizina. En el primer estudio, un ensayo cruzado controlado con placebo, se administró clorhidrato de cetirizina a dosis de hasta 60 mg al día, 6 veces la dosis clínica máxima, durante 1 semana, sin que se produjera una prolongación media significativa del intervalo QTc. En el segundo estudio, un ensayo cruzado, se administraron 20 mg de hidrocloruro de cetirizina y eritromicina (500 mg cada 8 horas) solos y en combinación. No hubo un efecto significativo sobre el intervalo QTc con la combinación o con clorhidrato de cetirizina en monoterapia. En el tercer ensayo, también un estudio cruzado, se administraron 20 mg de clorhidrato de cetirizina y ketoconazol (400 mg al día) solos y en combinación.Clorhidrato de cetirizina causó un aumento medio del intervalo QTc de 9,1 mseg con respecto al valor basal después de 10 días de tratamiento. El ketoconazol también aumentó el QTc en 8,3 mseg. La combinación causó un aumento de 17,4 mseg, igual a la suma de los efectos individuales. Por lo tanto, no hubo interacción farmacológica significativa en el QTc con la combinación de clorhidrato de cetirizina y ketoconazol. En el cuarto estudio, un ensayo paralelo controlado con placebo, se administraron 20 mg de clorhidrato de cetirizina solo o en combinación con azitromicina (500 mg como dosis única el primer día seguido de 250 mg una vez al día). No hubo un aumento significativo del intervalo QTc con 20 mg de hidrocloruro de cetirizina solo o en combinación con azitromicina. En un ensayo clínico de cuatro semanas de duración en pacientes pediátricos de 6 a 11 años de edad, los resultados de las mediciones de ECG obtenidas aleatoriamente antes del tratamiento y después de 2 semanas de tratamiento mostraron que el clorhidrato de cetirizina 5 o 10 mg no aumentó el intervalo QTc versus placebo. En un ensayo clínico de una semana (N=86) de Solución Oral de clorhidrato de Cetirizina, USP (0,25 mg/kg dos veces al día) en comparación con placebo en pacientes pediátricos de 6 a 11 meses de edad, las mediciones de ECG tomadas dentro de las 3 horas posteriores a la última dosis no mostraron anomalías en el ECG ni aumentos en el intervalo QTc en ninguno de los grupos en comparación con las evaluaciones basales. Los datos de otros estudios en los que se administró clorhidrato de cetirizina a pacientes de 6 a 23 meses de edad coincidieron con los hallazgos de este estudio.Los efectos de clorhidrato de cetirizina en el intervalo QTc a dosis superiores a 10 mg no se han estudiado en niños menores de 12 años de edad. En un estudio controlado con placebo de seis semanas de duración en 186 pacientes (de 12 a 64 años de edad) con rinitis alérgica y asma de leve a moderada, 10 mg de hidrocloruro de cetirizina una vez al día mejoró los síntomas de la rinitis y no alteró la función pulmonar. En un ensayo clínico controlado con placebo de dos semanas de duración, un análisis de subgrupos de 65 pacientes pediátricos (de 6 a 11 años de edad) con rinitis alérgica y asma mostró que el clorhidrato de cetirizina no alteraba la función pulmonar. Estos estudios respaldan la seguridad de administrar clorhidrato de cetirizina a pacientes pediátricos y adultos con rinitis alérgica con asma leve a moderada.
Estudios clínicos: En los Estados Unidos se llevaron a cabo ensayos clínicos multicéntricos, aleatorizados, doble ciego, en los que se comparó Cetirizina de 5 a 20 mg con placebo en pacientes de 12 años o más con rinitis alérgica perenne. Dos de ellos mostraron reducciones significativas en los síntomas de la rinitis alérgica perenne durante hasta 8 semanas de duración. También se llevaron a cabo dos ensayos clínicos multicéntricos, aleatorizados, doble ciego, de 4 semanas de duración en los que se comparó Cetirizina de 5 a 20 mg con placebo en pacientes con urticaria idiopática crónica, que mostraron una mejoría significativa de los síntomas de la urticaria idiopática crónica. En general, la dosis de 10 mg fue más eficaz que la de 5 mg y la de 20 mg no produjo ningún efecto añadido. Algunos de estos ensayos incluyeron pacientes pediátricos de 12 a 16 años de edad. Además, en los Estados Unidos se realizaron cuatro ensayos multicéntricos, aleatorizados, controlados con placebo, doble ciego de 2 a 4 semanas de duración en 534 pacientes pediátricos de 6 a 11 años de edad con rinitis alérgica estacional a dosis de hasta 10 mg.
INDICACIONES & USO
Rinitis alérgica perenne: Solución oral de clorhidrato de Cetirizina, USP está indicada para el alivio de los síntomas asociados con la rinitis alérgica perenne debido a alérgenos como ácaros del polvo, caspa de animales y mohos en niños de 6 a 23 meses de edad. Los síntomas tratados con eficacia incluyen estornudos, rinorrea, secreción posnasal, prurito nasal, prurito ocular y lagrimeo.
Urticaria crónica: Solución oral de clorhidrato de Cetirizina, USP, está indicada para el tratamiento de las manifestaciones cutáneas sin complicaciones de la urticaria idiopática crónica en niños de 6 meses a 5 años de edad. Reduce significativamente la aparición, gravedad y duración de la urticaria y reduce significativamente el prurito.
Contraindicaciones
Solución oral de clorhidrato de Cetirizina, USP está contraindicada en aquellos pacientes con hipersensibilidad conocida a ella o a cualquiera de sus ingredientes o hidroxizina.
Precauciones
Actividades que requieren agudeza mental: En ensayos clínicos, se ha notificado la aparición de somnolencia en algunos pacientes que toman clorhidrato de Cetirizina; por lo tanto, se debe tener la debida precaución al conducir un automóvil o manejar maquinaria potencialmente peligrosa. Debe evitarse el uso concomitante de clorhidrato de Cetirizina con alcohol u otros depresores del SNC, ya que pueden producirse reducciones adicionales del estado de alerta y un deterioro adicional del funcionamiento del SNC.Interacciones medicamentosas: No se han encontrado interacciones medicamentosas clínicamente significativas con teofilina a dosis bajas, azitromicina, pseudoefedrina, ketoconazol o eritromicina. Hubo una pequeña disminución en el aclaramiento de Cetirizina causada por una dosis de 400 mg de teofilina; es posible que dosis más grandes de teofilina pudieran tener un efecto mayor.
Carcinogénesis, Mutagénesis y Alteración de la Fertilidad: En un estudio de carcinogenicidad de 2 años en ratas, la cetirizina no fue carcinogénica a dosis dietéticas de hasta 20 mg/kg (aproximadamente 15 veces la dosis oral diaria máxima recomendada en adultos en base a mg/m 2, o aproximadamente 7 veces la dosis oral diaria máxima recomendada en lactantes en base a mg/m 2). En un estudio de carcinogenicidad de 2 años en ratones, la cetirizina causó un aumento de la incidencia de tumores hepáticos benignos en machos a una dosis dietética de 16 mg/kg (aproximadamente 6 veces la dosis oral diaria máxima recomendada en adultos en una base de mg/m 2, o aproximadamente 3 veces la dosis oral diaria máxima recomendada en lactantes en una base de mg/m 2). No se observó un aumento en la incidencia de tumores hepáticos en ratones a una dosis dietética de 4 mg/kg (aproximadamente 2 veces la dosis oral diaria máxima recomendada en adultos sobre una base de mg/m 2, o aproximadamente equivalente a la dosis oral diaria máxima recomendada en lactantes sobre una base de mg/m 2). Se desconoce la importancia clínica de estos hallazgos durante el uso a largo plazo de clorhidrato de cetirizina.La cetirizina no fue mutagénica en la prueba de Ames, y no clastogénica en la prueba de linfocitos humanos, la prueba de linfoma de ratón y la prueba de micronúcleos in vivo en ratas.En un estudio de fertilidad y rendimiento reproductivo general en ratones, la cetirizina no afectó a la fertilidad a una dosis oral de 64 mg/kg (aproximadamente 25 veces la dosis oral diaria máxima recomendada en adultos en base a mg/m 2).
Uso pediátrico: Se ha demostrado la seguridad del clorhidrato de cetirizina en pacientes pediátricos de 6 a 5 años de edad. La seguridad de la cetirizina se ha demostrado en 168 pacientes de 2 a 5 años de edad en ensayos controlados con placebo de hasta 4 semanas de duración. En mg / kg, la mayoría de los 168 pacientes recibieron entre 0,2 y 0,4 mg/kg de Cetirizina HCl. La seguridad de la cetirizina en 399 pacientes de 12 a 24 meses de edad se ha demostrado en un ensayo controlado con placebo de 18 meses de duración, en el que la dosis media fue
0,25 mg/kg dos veces al día, correspondiente a un intervalo de 4 a 11 mg/día. La seguridad de la Solución Oral de clorhidrato de Cetirizina, USP, se ha demostrado en 42 pacientes de 6 a 11 meses de edad en un ensayo de 7 días controlado con placebo. La dosis prescrita fue de 0,25 mg/kg bid, que corresponde a una media de 4,5 mg/día, con un rango de 3.4 6.2 mg/día.La eficacia del clorhidrato de Cetirizina para el tratamiento de la rinitis alérgica y la urticaria idiopática crónica en pacientes pediátricos de 6 a 5 años de edad se basa en una extrapolación de la eficacia demostrada del clorhidrato de Cetirizina en adultos con estas afecciones y la probabilidad de que el curso de la enfermedad, la fisiopatología y el efecto del fármaco sean sustancialmente similares entre estas dos poblaciones. La eficacia se extrapola hasta los 6 meses de edad para la rinitis alérgica perenne porque se cree que esta enfermedad ocurre hasta estas edades en niños. Las dosis recomendadas para la población pediátrica se basan en comparaciones de estudios cruzados de la farmacocinética y la farmacodinamia de la cetirizina en sujetos adultos y pediátricos y en el perfil de seguridad de la Cetirizina en pacientes adultos y pediátricos a dosis iguales o superiores a las dosis recomendadas. AUC y C max de Cetirizina en pacientes pediátricos de 6 a 23 meses que recibieron una media de 2.3 mg en una dosis única y en sujetos de 2 a 5 años que recibieron una dosis única de 5 mg de solución oral de Cetirizina, se estimó que era intermedio entre el observado en adultos que recibieron una dosis única de 10 mg de comprimidos de Cetirizina y aquellos que recibieron una dosis única de 20 mg de comprimidos de Cetirizina.No se ha establecido la seguridad y eficacia de la cetirizina en pacientes pediátricos menores de 6 meses.
Reacciones adversas
Se realizaron estudios pediátricos con clorhidrato de Cetirizina. En ensayos clínicos controlados y no controlados realizados en los Estados Unidos, se incluyeron más de 1.300 pacientes pediátricos de 6 a 11 años de edad con más de 900 tratados con clorhidrato de cetirizina a dosis de 1,25 a 10 mg al día. La duración del tratamiento osciló entre 2 y 12 semanas. Los ensayos controlados con placebo de hasta 4 semanas de duración incluyeron a 168 pacientes pediátricos de 2 a 5 años de edad que recibieron Cetirizina, la mayoría de los cuales recibieron dosis únicas diarias de 5 mg. Un ensayo controlado con placebo de 18 meses de duración incluyó a 399 pacientes de 12 a 24 meses tratados con Cetirizina (0.25 mg/kg bid), y otro ensayo controlado con placebo de 7 días de duración incluyó a 42 pacientes con edades de 6 a 11 meses que recibieron tratamiento con Cetirizina (0,25 mg/kg bid).
La mayoría de las reacciones adversas notificadas en pacientes pediátricos de 2 a 11 años de edad con clorhidrato de cetirizina fueron leves o moderadas. En ensayos controlados con placebo, la incidencia de interrupciones del tratamiento debidas a reacciones adversas en pacientes pediátricos que recibieron hasta 10 mg de clorhidrato de Cetirizina fue poco frecuente (0,4% con clorhidrato de cetirizina frente a 1,0% con placebo).
En la tabla 1 se enumeran las reacciones adversas que se notificaron con clorhidrato de Cetirizina 5 y 10 mg en pacientes pediátricos de 6 a 11 años de edad en ensayos clínicos controlados con placebo en los Estados Unidos y que fueron más frecuentes con clorhidrato de cetirizina que con placebo. De estos, el dolor abdominal se consideró relacionado con el tratamiento y la somnolencia pareció estar relacionada con la dosis, el 1,3% en el grupo placebo, el 1,9% con 5 mg y el 4,2% con 10 mg. Las experiencias adversas notificadas en pacientes pediátricos de 2 a 5 años de edad en ensayos controlados con placebo fueron cualitativamente similares en naturaleza y, en general, similares en frecuencia a las notificadas en ensayos con niños de 6 a 11 años de edad.
En los ensayos controlados con placebo en pacientes pediátricos de 6 a 24 meses de edad, la incidencia de experiencias adversas fue similar en los grupos de tratamiento con cetirizina y placebo en cada estudio. La somnolencia se produjo con la misma frecuencia en los pacientes que recibieron cetirizina y en los pacientes que recibieron placebo. En un estudio de 1 semana de duración en niños de 6 a 11 meses de edad, los pacientes que recibieron cetirizina mostraron una mayor irritabilidad/nerviosismo que los pacientes que recibieron placebo. En un estudio de 18 meses de duración en pacientes de 12 meses o más, el insomnio se produjo con mayor frecuencia en pacientes que recibieron cetirizina en comparación con los pacientes que recibieron placebo (9,0% frente a 5,3%). En aquellos pacientes que recibieron 5 mg o más de Cetirizina al día en comparación con los pacientes que recibieron placebo, la fatiga (3,6% frente a 1,3%) y el malestar (3,6% frente a 1,8%) ocurrieron con mayor frecuencia.
Cuadro 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Broncoespasmo | 1.9% | 3.1% | 1.9% |
| Náuseas | 1.9% | 1.9% | 2.8% |
| Vómitos | 1.0% | 2.5% | 2.3% |
Los siguientes eventos se han observado con poca frecuencia (menos de 2%), en cualquiera de los 3982 adultos y niños mayores de 12 años o en 659 pacientes pediátricos de 6 a 11 años que recibieron Cetirizine hydrochloride en las pruebas ESTADOUNIDENSES, incluyendo un abrir adulto estudio de seis meses de duración. No se ha establecido una relación causal de estos acontecimientos infrecuentes con la administración de clorhidrato de cetirizina.
Sistema Nervioso autónomo: anorexia, rubor, aumento de la salivación, retención urinaria.
Cardiovascular: insuficiencia cardíaca, hipertensión, palpitaciones, taquicardia.
Sistemas Nerviosos Central y Periférico: coordinación anormal, ataxia, confusión, disfonía, hiperestesia, hipercinesia, hipertonía, hipoestesia, calambres en las piernas, migraña, mielitis, parálisis, parestesia, ptosis, síncope, temblores, espasmos, vértigo, defecto del campo visual.
Gastrointestinal: función hepática anormal, caries dental agravada, estreñimiento, dispepsia, eructos, flatulencia, gastritis, hemorroides, aumento del apetito, melena, hemorragia rectal, estomatitis incluyendo estomatitis ulcerosa, decoloración de la lengua, edema de la lengua.
Genitourinario: cistitis, disuria, hematuria, frecuencia de micción, poliuria, incontinencia urinaria, infección del tracto urinario.
Audición y vestibular: sordera, dolor de oído, ototoxicidad, tinnitus.
Metabólico / Nutricional: deshidratación, diabetes mellitus, sed.
Musculoesquelético: artralgia, artritis, artrosis, debilidad muscular, mialgia.
Psiquiátrico: pensamiento anormal, agitación, amnesia, ansiedad, disminución de la libido, despersonalización, depresión, labilidad emocional, euforia, disminución de la concentración, insomnio, nerviosismo, paroniria, trastorno del sueño.
Sistema respiratorio: bronquitis, disnea, hiperventilación, aumento del esputo, neumonía, trastorno respiratorio, rinitis, sinusitis, infección del tracto respiratorio superior.
Reproductivo: dismenorrea, dolor de mama femenino, sangrado intermenstrual, leucorrea, menorragia, vaginitis.
Reticuloendotelial: linfadenopatía.Piel: acné, alopecia, angioedema, erupción bullosa, dermatitis, piel seca, eccema, erupción eritematosa, furunculosis, hiperqueratosis, hipertricosis, aumento de la sudoración, erupción maculopapular, reacción de fotosensibilidad, reacción tóxica de fotosensibilidad, prurito, púrpura, erupción, seborrea, trastorno de la piel, nódulo cutáneo, urticaria.
Sentidos especiales: parosmia, pérdida del gusto, perversión del gusto.Visión: ceguera, conjuntivitis, dolor ocular, glaucoma, pérdida de acomodación, hemorragia ocular, xeroftalmia.
Cuerpo como un todo: lesión accidental, astenia, dolor de espalda, dolor de pecho, abdomen agrandado, edema facial, fiebre, edema generalizado, sofocos, aumento de peso, edema de piernas, malestar, pólipo nasal, dolor, palidez, edema periorbital, edema periférico, rigidez.
Durante el tratamiento con Cetirizina se han producido casos ocasionales de aumentos transitorios y reversibles de las transaminasas hepáticas. Se ha notificado hepatitis con elevación significativa de transaminasas y bilirrubina elevada en asociación con el uso de clorhidrato de cetirizina.
Experiencia postcomercialización
En el periodo postcomercialización, se han notificado los siguientes acontecimientos adversos raros adicionales, pero potencialmente graves: reacción agresiva, anafilaxia, colestasis, convulsiones, glomerulonefritis, alucinaciones, anemia hemolítica, hepatitis, discinesia orofacial, hipotensión grave, muerte fetal, ideación suicida, suicidio, trombocitopenia y pustulosis exantematosa generalizada aguda (EPGA).Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Torrent Pharma Inc. al 800-912-9561 o FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Abuso y Dependencia de drogas
No hay información que indique que el clorhidrato de Cetirizina produce abuso o dependencia.
Sobredosis
Se ha notificado sobredosis con clorhidrato de Cetirizina. En un paciente adulto que tomó 150 mg de clorhidrato de cetirizina, el paciente estaba somnoliento pero no mostró ningún otro signo clínico ni resultados anómalos de bioquímica sanguínea o hematología. En un paciente pediátrico de 18 meses de edad que tomó una sobredosis de clorhidrato de cetirizina (aproximadamente 180 mg), se observó inicialmente inquietud e irritabilidad; esto fue seguido por somnolencia. En caso de sobredosis, el tratamiento debe ser sintomático o de soporte, teniendo en cuenta los medicamentos ingeridos concomitantemente. No se conoce un antídoto específico para el clorhidrato de cetirizina. El clorhidrato de cetirizina no se elimina eficazmente mediante diálisis, y la diálisis será ineficaz a menos que se haya ingerido concomitantemente un agente dializable. Las dosis orales letales mínimas agudas fueron de 237 mg/kg en ratones (aproximadamente 95 veces la dosis oral diaria máxima recomendada en adultos en mg/m2, o aproximadamente 40 veces la dosis oral diaria máxima recomendada en lactantes en mg/m2) y de 562 mg/kg en ratas (aproximadamente 460 veces la dosis oral diaria máxima recomendada en adultos en mg/m2, o aproximadamente 190 veces la dosis oral diaria máxima recomendada en lactantes en mg / m2. En roedores, el objetivo de toxicidad aguda fue el sistema nervioso central, y el objetivo de toxicidad a dosis múltiples fue el hígado.
DOSIS & ADMINISTRACIÓN
Solución oral de clorhidrato de Cetirizina, USP se puede tomar sin tener en cuenta el consumo de alimentos.
Niños de 2 a 5 años para Urticaria Crónica: La dosis inicial recomendada de Solución Oral de Clorhidrato de Cetirizina, USP en niños de 2 a 5 años es de 2,5 mg (½ cucharadita) de solución oral una vez al día. La dosis en este grupo de edad puede aumentarse a una dosis máxima de 5 mg al día administrada como 1 cucharadita de solución oral una vez al día, o ½ cucharadita de solución oral administrada cada 12 horas.
Niños de 6 meses a < 2 años para Rinitis Alérgica Perenne y Urticaria Crónica: La dosis recomendada de Solución Oral de Clorhidrato de Cetirizina, USP en niños de 6 meses a 23 meses de edad es de 2,5 mg (½ cucharadita) una vez al día. La dosis en niños de 12 a 23 meses de edad puede aumentarse a una dosis máxima de 5 mg al día, administrada como ½ cucharadita (2,5 mg) cada 12 horas.
Cómo se suministra la Cetirizina
Solución oral de clorhidrato de Cetirizina, USP 5 mg/5 ml (1 mg/ml) es una solución oral incolora a ligeramente amarilla que se suministra en frascos de 120 ml.Frascos de 120 mL NDC 13668-029-07
Solución oral de clorhidrato de Cetirizina, USP 5 mg / 5 ml (1 mg/ml) es una solución oral incolora a ligeramente amarilla suministrada en frascos de 480 ml.Botellas de 480 mL de NDC 13668-029-11
ALMACENAMIENTO
Almacenar a 20°-25°C (68°-77°F); se permiten excursiones a 15°-30°C (59°-86°F) .
Solo Rx
Fabricado por:
Bio-Pharm, Inc.Levittown, PA 19057 Fabricado para: TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? ¿Y antes o después de una comida en particular?
Más información sobre cetirizina
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información de dosis
- Consejos para pacientes
- Imágenes de medicamentos
- Interacciones con medicamentos
- Comparar alternativas
- Grupo de apoyo
- Precios & Cupones
- 225 Comentarios
- Clase de drogas: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 más
Guías de tratamiento relacionadas
- Rinitis alérgica
- Urticaria
- Disfunción de la Trompa de Eustaquio
- Urticaria física
Exención de responsabilidad médica
Leave a Reply