Duricef
yleisnimi: cefadroxil
annosmuoto: jauhe, suspensiota varten
lääketieteellisesti arvosteltu Drugs.com. päivitetty viimeksi 21. huhtikuuta 2020.
- yleiskatsaus
- haittavaikutukset
- yhteisvaikutukset
- lisää
annostus Professional
lääkkeille vastustuskykyisten bakteerien kehittymisen vähentämiseksi ja Duricef®-valmisteen ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi Duricefia tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on osoitettu tai joiden epäillään vahvasti olevan bakteerien aiheuttamia.
Duricef kuvaus
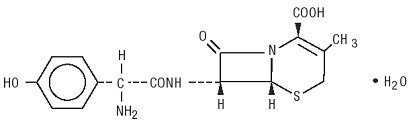
Duricef on puolisynteettinen kefalosporiiniantibiootti, joka on tarkoitettu annettavaksi suun kautta. Se on valkoinen tai kellertävän valkoinen kiteinen jauhe. Se liukenee veteen ja on happostabiili. Se on kemiallisesti 5-Tia-1-atsabisyklo-okt-2-eeni-2-karboksyylihappo, 7-amino]-3-metyyli-8-okso -, monohydraatti] -. Sen formula_16h17n3o5s • H2O ja molekyylipaino on 381,40. Sen rakennekaava on seuraava:
Duricef-kalvopäällysteiset tabletit, 1 g, sisältävät seuraavia inaktiivisia aineita: mikrokiteinen selluloosa, hydroksipropyylimetyyliselluloosa, magnesiumstearaatti, polyetyleeniglykoli, polysorbaatti 80, simetikoniemulsio ja titaanidioksidi.
Duricef oraalisuspensiota varten sisältää seuraavia inaktiivisia aineita: FD&C Keltainen nro 6, aromit (luonnolliset ja keinotekoiset), polysorbaatti 80, natriumbentsoaatti, sakkaroosi ja ksantaanikumi.
Duricef-kapselit sisältävät seuraavia inaktiivisia aineita: d&C punainen nro 28, FD&C sininen nro 1, FD&C punainen nro 40, liivate, magnesiumstearaatti ja titaanidioksidi.
Duricef – Kliininen farmakologia
Duricef imeytyy nopeasti oraalisen annon jälkeen. Keskimääräiset huippupitoisuudet seerumissa olivat 500 mg: n kerta-annoksen jälkeen noin 16 µg/mL ja 1000 mg: n kerta-annoksen jälkeen noin 28 µg / mL. Mitattavissa olevat pitoisuudet olivat 12 tuntia annostelun jälkeen. Yli 90% lääkeaineesta erittyy muuttumattomana virtsaan 24 tunnin kuluessa. Huippupitoisuus virtsassa on noin 1800 µg/mL oraalisen 500 mg: n kerta-annoksen jälkeen. Annoksen suurentaminen nostaa yleensä suhteellisesti Duricefin (kefadroksiilimonohydraatti, USP) virtsapitoisuutta. Virtsan antibioottipitoisuus säilyi 1 g: n annoksen jälkeen selvästi yli virtsalle alttiiden patogeenien MIC: n 20-22 tunnin ajan.
mikrobiologia
In vitro-testit osoittavat, että kefalosporiinit ovat bakterisidisia, koska ne estävät soluseinän synteesiä. Kefadroksiilin on osoitettu olevan aktiivinen seuraavia organismeja vastaan sekä in vitro että kliinisissä infektioissa (KS. käyttöaiheet ja käyttö):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Sillä ei ole vaikutusta Pseudomonas-lajeihin eikä Acinetobacter calcoaceticus-lajeihin (aiemmin Mima ja Herellea-lajit).
Herkkyystestit: Diffuusiotekniikat
antibioottilevyherkkyystestimenetelmien käyttö, joilla mitataan vyöhykkeen halkaisija, antaa tarkan arvion antibioottiherkkyydestä. Yksi tällainen standardimenetelmä1, jota on suositeltu käytettäväksi levykkeiden kanssa eliöiden kefadroksiiliherkkyyden testaamiseksi, käyttää kefalosporiiniluokan (kefalotiini) levyä. Tulkinnassa on kyse levytestissä saatujen halkaisijoiden korrelaatiosta kefadroksiilin pienimmän estopitoisuuden (MIC) kanssa.
laboratorion raportit, joissa annetaan tulokset standardoidusta yhden levyn herkkyystestistä 30 µg: n kefalotiinilevyllä, on tulkittava seuraavien kriteerien mukaisesti::
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of ”Herkkä” viittaa siihen, että taudinaiheuttaja todennäköisesti estyy yleensä saavutettavissa olevilla veren pitoisuuksilla. Raportti ”keskiherkkyydestä” viittaa siihen, että organismi olisi herkkä, jos käytetään suuria annoksia tai jos infektio rajoittuu kudokseen ja nesteisiin (esim.virtsaan), joissa korkea antibioottipitoisuus saavutetaan. ”Resistentin” raportti osoittaa, että saavutettavissa olevat antibioottipitoisuudet eivät todennäköisesti ole estäviä ja muu hoito on valittava.
standardoidut menettelyt edellyttävät laboratoriokontrolliorganismien käyttöä. 30 µg: n kefalotiinilevystä saadaan seuraavat alueen halkaisijat:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (mikrodiluutiomenetelmä mukaan luettuna) menetelmä2 tai vastaava bakteeri-isolaatti voidaan katsoa herkäksi, jos kefalotiinin MIC (minimum inhibitory concentration) – arvo on 8 µg/mL tai vähemmän. Mikrobeja pidetään resistentteinä, jos MIC on 32 µg / mL tai suurempi. Eliöt, joiden MIC-arvo on alle 32 µg/mL mutta suurempi kuin 8 µg/mL, ovat keskitasoisia.
kuten standardidiffuusiomenetelmissä, laimennusmenetelmissä on käytettävä laboratoriokontrolliorganismeja. Standardi kefalotiinijauhe antaa MIC-arvot välillä 0.12 µg/mL ja 0.5 µg / mL Staphylococcus aureus ATCC 29213. Escherichia coli ATCC 25922: n MIC-arvojen tulee olla välillä 4, 0 µg/mL-16, 0 µg/mL. Streptococcus faecalis ATCC 29212: n MIC-vaihteluvälin tulee olla 8, 0-32, 0 µg/mL.
Duricef-valmisteen käyttöaiheet ja käyttöaiheet
Duricef on tarkoitettu hoitoon potilaille, joilla on nimettyjen organismien herkkien kantojen aiheuttama infektio seuraavissa taudeissa:
E. coli -, P. mirabilis-ja Klebsiella-lajien aiheuttamat virtsatietulehdukset.
Stafylokokien ja / tai streptokokien aiheuttamat iho-ja ihonrakenneinfektiot.
Streptococcus pyogenesin aiheuttama nielutulehdus ja / tai tonsilliitti (A-ryhmän beetahemolyyttiset streptokokit).
huomaa: ainoastaan lihaksensisäisesti annosteltavan penisilliinin on osoitettu olevan tehokas reumakuumeen estohoidossa. Duricef on yleensä tehokas streptokokkien hävittämisessä suunielusta. Tietoja Duricefin tehosta myöhemmän reumakuumeen estohoidossa ei kuitenkaan ole saatavilla.
Huomautus: kulttuuri-ja herkkyystestit tulee aloittaa ennen hoitoa ja hoidon aikana. Munuaistoimintaa koskevat tutkimukset tulee tehdä tarvittaessa.
lääkkeille vastustuskykyisten bakteerien kehittymisen vähentämiseksi ja Duricefin ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi Duricefia tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on osoitettu tai joiden epäillään vahvasti olevan alttiiden bakteerien aiheuttamia. Jos viljelystä ja herkkyydestä on tietoa, ne on otettava huomioon antibakteerista hoitoa valittaessa tai muutettaessa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa empiiriseen hoidon valintaan.
vasta-aiheet
Duricef on vasta-aiheinen potilaille, joiden tiedetään olevan allergisia kefalosporiiniryhmälle.
Varoitukset
ennen Duricef-hoidon aloittamista on tutkittava huolellisesti, onko potilaalla ollut aiempia yliherkkyysreaktioita KEFADROKSIILILLE, kefalosporiineille, penisilliineille tai muille lääkkeille. JOS TÄTÄ VALMISTETTA ANNETAAN PENISILLIINIHERKILLE POTILAILLE, ON NOUDATETTAVA VAROVAISUUTTA, KOSKA BEETALAKTAAMIANTIBIOOTTIEN RISTIHERKKYYS ON SELVÄSTI DOKUMENTOITU JA SITÄ VOI ESIINTYÄ JOPA 10%: LLA POTILAISTA, JOILLA ON OLLUT PENISILLIINIALLERGIA.
Jos DURICEFILLE ilmaantuu allerginen reaktio, lääkkeen käyttö on lopetettava. VAKAVAT AKUUTIT YLIHERKKYYSREAKTIOT VOIVAT VAATIA ADRENALIINIHOITOA JA MUITA HÄTÄTOIMENPITEITÄ, MUKAAN LUKIEN HAPPI, SUONENSISÄINEN NESTEYTYS, SUONENSISÄINEN ANTIHISTAMIINIT, KORTIKOSTEROIDIT, PRESSORIAMIINIT JA HENGITYSTEIDEN HALLINTA, KUTEN KLIINISESTI ON TARPEEN.
Clostridium difficile-bakteerin aiheuttamaa ripulia (CDAD) on raportoitu lähes kaikkien antibakteeristen aineiden käytön yhteydessä, Duricef mukaan lukien, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan koliittiin. Hoito antibakteerisia aineita muuttaa normaalia kasvistoa paksusuolen johtaa umpeenkasvua C. vaikea.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD: n kehittymistä. Hypertoksiini tuottaa kantoja C. difficile aiheuttaa lisääntynyttä sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla tulenkestäviä mikrobilääkkeiden hoito ja voivat vaatia colectomy. CDAD on otettava huomioon kaikilla potilailla, joilla esiintyy ripulia antibioottien käytön jälkeen. Huolellinen lääketieteellinen tausta on tarpeen, sillä CDAD: n on raportoitu ilmaantuvan yli kahden kuukauden kuluttua antibakteeristen lääkevalmisteiden antamisesta.
Jos CDAD: tä epäillään tai se on vahvistettu, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficile-bakteeria vastaan, voidaan joutua lopettamaan. Asianmukainen nesteen ja elektrolyytin hallinta, proteiini lisäravinteen, antibioottihoito C. difficile, ja kirurginen arviointi olisi aloitettava kliinisesti osoitettu.
varotoimet
Yleiset
Duricefia tulee käyttää varoen, jos munuaisten toiminta on selvästi heikentynyt (kreatiniinipuhdistuma on alle 50 mL/min / 1, 73 M2). Annostus ja antotapa.) Potilailla, joilla tiedetään tai epäillään olevan munuaisten vajaatoiminta, on tehtävä huolellinen kliininen seuranta ja asianmukaiset laboratoriotutkimukset ennen hoitoa ja hoidon aikana.
Duricefin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista käyttöaihetta ei todennäköisesti hyödytä potilasta ja lisää lääkkeille vastustuskykyisten bakteerien kehittymisen riskiä.
Duricefin pitkäaikainen käyttö voi johtaa syömättömien organismien liikakasvuun. Potilaan huolellinen tarkkailu on oleellista. Jos hoidon aikana ilmenee superinfektio, on ryhdyttävä asianmukaisiin toimenpiteisiin.
Duricefia tulee määrätä varoen henkilöille, joilla on aiemmin ollut maha-suolikanavan sairaus, erityisesti koliitti.
tietoa
potilaille tulee neuvoa, että antibakteerisia lääkkeitä, Duricef mukaan lukien, tulee käyttää vain bakteeri-infektioiden hoitoon. Niillä ei hoideta virusinfektioita (esim.flunssaa). Kun Duricef määrätään bakteeri-infektion hoitoon, potilaille on kerrottava, että vaikka on tavallista tuntea paremmin hoidon alkuvaiheessa, lääkitys on otettava täsmälleen ohjeiden mukaan. Annosten jättäminen väliin tai koko hoitojakson suorittamatta voi (1) heikentää välittömän hoidon tehoa ja (2) lisätä todennäköisyyttä, että bakteerit kehittyvät resistenteiksi eivätkä ne ole tulevaisuudessa hoidettavissa Duricefillä tai muilla antibakteerisilla lääkkeillä.
ripuli on yleinen antibioottien aiheuttama vaiva, joka yleensä päättyy, kun antibiootti lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaalle voi kehittyä vetistä ja veristä ulostetta (vatsakrampeilla ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriinsä mahdollisimman pian.
lääkeaineiden ja laboratoriokokeiden yhteisvaikutuksia
positiivisia suoria Coombsin testejä on raportoitu kefalosporiiniantibioottihoidon aikana. Hematologisissa tutkimuksissa tai verensiirroissa ristisovitustoimenpiteissä, kun antiglobuliinitestejä tehdään pienellä puolella, tai Coombsin testeissä vastasyntyneille, joiden äidit ovat saaneet kefalosporiiniantibiootteja ennen synnytystä, on tunnustettava, että positiivinen Coombsin testi voi johtua lääkkeestä.
karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
pitkäaikaisia tutkimuksia karsinogeenisuuden määrittämiseksi ei ole tehty. Geenimyrkytystestejä ei ole tehty.
raskaus: Raskauskategoria B
lisääntymistutkimuksia on tehty hiirillä ja rotilla annoksilla, jotka olivat jopa 11-kertaisia verrattuna ihmisen annokseen, eikä niissä ole havaittu merkkejä kefadroksiilimonohydraatin aiheuttamasta hedelmällisyyden heikkenemisestä tai sikiölle aiheutuvasta haitasta. Ei kuitenkaan ole olemassa tarkkoja ja hyvin kontrolloituja tutkimuksia käytöstä raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Labor and Delivery
Duricefin käyttöä synnytyksen aikana ei ole tutkittu. Hoitoa tulee antaa vain, jos se on selvästi tarpeen.
imettävät äidit
varovaisuutta tulee noudattaa annettaessa kefadroksiilimonohydraattia imettävälle äidille.
lapsipotilailla
(KS.annostus ja anto.)
geriatrinen käyttö
noin 650 potilaasta, jotka saivat kefadroksiilia virtsatieinfektioiden hoitoon kolmessa kliinisessä tutkimuksessa, 28% oli 60-vuotiaita tai vanhempia ja 16% oli 70-vuotiaita tai vanhempia. Noin 1000 potilaasta, jotka saivat kefadroksiilia iho-ja ihonrakenneinfektion hoitoon 14 kliinisessä tutkimuksessa, 12% oli 60-vuotiaita tai vanhempia ja 4% oli 70 – vuotiaita tai vanhempia. Näissä tutkimuksissa iäkkäiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa. Kefadroksiililla tehdyissä nielutulehduksen tai nielurisatulehduksen hoitoon tehdyissä kliinisissä tutkimuksissa ei ollut riittävästi yli 65-vuotiaita potilaita, jotta olisi voitu määrittää, reagoivatko he eri tavalla kuin nuoremmat potilaat. Muissa raportoiduissa kliinisissä kokemuksissa kefadroksiilista ei ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä, mutta joidenkin iäkkäiden potilaiden suurempaa herkkyyttä ei voida sulkea pois.
Kefadroksiili erittyy olennaisesti munuaisten kautta, ja annoksen muuttaminen on tarpeen munuaisten vajaatoimintaa sairastavilla potilailla (KS.annostus ja antotapa: munuaisten vajaatoiminta). Koska iäkkäillä potilailla munuaistoiminnan heikkeneminen on todennäköisempää, annoksen valinnassa tulee noudattaa varovaisuutta, ja munuaisten toiminnan seuraaminen voi olla hyödyllistä.
haittavaikutukset
maha-suolikanavan
pseudomembranoottisen koliitin oireita voi esiintyä antibioottihoidon aikana tai sen jälkeen (ks.varoitukset). Dyspepsiaa, pahoinvointia ja oksentelua on raportoitu harvoin. Myös ripulia on esiintynyt.
yliherkkyyttä
allergioita (ihottumaa, nokkosihottumaa, angioedeemaa ja kutinaa) on havaittu. Nämä reaktiot yleensä laantuivat, kun lääkkeen käyttö lopetettiin. Myös anafylaksiaa on raportoitu.
muita
muita reaktioita ovat olleet maksan toimintahäiriö mukaan lukien kolestaasi ja seerumin transaminaasiarvojen nousu, sukuelinten kutina, sukupuolielinten moniliasis, vaginiitti, kohtalainen ohimenevä neutropenia, kuume. Agranulosytoosia, trombosytopeniaa, idiosynkraattista maksan vajaatoimintaa, erythema multiformea, Stevens-Johnsonin oireyhtymää, seerumitautia ja nivelkipua on raportoitu harvoin.
edellä lueteltujen haittavaikutusten lisäksi kefadroksiilihoitoa saaneilla potilailla on raportoitu seuraavia haittavaikutuksia ja laboratoriokokeiden muutoksia kefalosporiiniryhmän antibiooteilla.:
toksinen epidermaalinen nekrolyysi, vatsakipu, superinfektio, munuaisten toimintahäiriö, toksinen nefropatia, aplastinen anemia, hemolyyttinen anemia, verenvuoto, pidentynyt protrombiiniaika, positiivinen Coombsin testi, kohonnut BUN, kohonnut kreatiniini, kohonnut alkalinen fosfataasi, kohonnut aspartaattiaminotransferaasi (ASAT), kohonnut alaniiniaminotransferaasi (alat), kohonnut bilirubiini, kohonnut LDH, eosinofilia, pansytopenia, neutropenia.
useiden kefalosporiinien on todettu laukaisevan kohtauksia erityisesti munuaisten vajaatoimintaa sairastavilla potilailla, kun annosta ei ole pienennetty (KS.annostus ja anto sekä yliannostus). Jos lääkehoitoon liittyviä kohtauksia esiintyy, lääke on lopetettava. Epilepsialääkitystä voidaan antaa, jos se on kliinisesti perusteltua.
yliannostus
alle kuusivuotiailla lapsilla tehty tutkimus osoitti, että alle 250 mg / kg: n kefalosporiiniannoksen nauttimiseen ei liittynyt merkittäviä tuloksia. Mitään muuta toimintaa kuin yleistä tukea ja tarkkailua ei tarvita. Jos annos on yli 250 mg/kg, indusoi mahalaukun tyhjeneminen.
viidellä anuric-potilaalla osoitettiin, että keskimäärin 63% 1 g: n oraalisesta annoksesta poistuu elimistöstä 6-8 tunnin hemodialyysin aikana.
Duricef Annostus ja antotapa
Duricef on happostabiili ja se voidaan ottaa suun kautta aterioista riippumatta. Suun kautta annettavaan kefalosporiinihoitoon satunnaisesti liittyvien maha-suolikanavan vaivojen vähentämisessä saattaa olla apua ruokailun yhteydessä.
Aikuiset
virtsatieinfektiot: Komplisoitumattomissa alempien virtsateiden infektioissa (virtsarakkotulehdus) tavanomainen annos on 1 tai 2 g päivässä yhtenä (q.d.) tai jaettuna annoksiin (b.i.d.).
kaikissa muissa virtsatieinfektioissa tavanomainen annos on 2 g vuorokaudessa jaettuina annoksina (s.I.d.).
iho-ja Ihorakenneinfektiot: iho-ja ihorakenneinfektioissa tavanomainen annos on 1 g päivässä kerta-annoksena (QD.) tai jaettuna annoksiin (b. i.d.).
nielutulehdus ja tonsilliitti: A-ryhmän beetahemolyyttisen streptokokin aiheuttaman nielutulehduksen ja tonsilliitin hoito—1 g päivässä kerta-annoksena (q.d.) tai jaettuina annoksina (b.i.d.) 10 päivän ajan.
lapset
virtsatieinfektioissa lasten suositeltu vuorokausiannos on 30 mg/kg / vrk jaettuna annoksiin 12 tunnin välein. Nielutulehdus, tonsilliitti ja märkärupi, suositeltu päivittäinen annos lapsille on 30 mg/kg/vrk kerta-annoksena tai yhtä jaettuina annoksina 12 tunnin välein. Muiden iho-ja ihonrakenneinfektioiden suositeltu vuorokausiannos on 30 mg/kg/vrk jaettuna yhtä suuriin annoksiin 12 tunnin välein. Beetahemolyyttisten streptokokki-infektioiden hoidossa terapeuttista Duricef-annosta tulee antaa vähintään 10 päivän ajan.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 tsp |
munuaisten vajaatoiminta
munuaisten vajaatoimintaa sairastavilla potilailla kefadroksiilimonohydraatin annostusta tulee muuttaa kreatiniinipuhdistuman mukaan lääkkeen kumuloitumisen estämiseksi. Seuraavaa aikataulua ehdotetaan. Aikuisilla Duricefin aloitusannos on 1000 mg ja ylläpitoannos (kreatiniinipuhdistuman mukaan ) 500 mg seuraavin aikavälein.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients kun kreatiniinipuhdistuma on yli 50 mL/min, sitä voidaan hoitaa ikään kuin potilaalla olisi normaali munuaistoiminta.
| pullon koko | valmistusohjeet |
| 100 ml |
suspendoidaan yhteensä 67 ml: aan vettä. menetelmä: pulloa naputetaan kevyesti, jotta jauhe irtoaa. Lisää 67 mL vettä kahdessa erässä. ravista hyvin jokaisen lisäyksen jälkeen. |
| 75 mL |
suspendoidaan yhteensä 51 mL: aan vettä. menetelmä: pulloa naputetaan kevyesti, jotta jauhe irtoaa. Lisää 51 mL vettä kahdessa erässä. ravista hyvin jokaisen lisäyksen jälkeen. |
| 50 mL |
suspendoidaan yhteensä 34 mL: aan vettä. menetelmä: pulloa naputetaan kevyesti, jotta jauhe irtoaa. Lisää 34 mL vettä kahdessa erässä. ravista hyvin jokaisen lisäyksen jälkeen. |
|
käyttövalmiiksi saattamisen jälkeen säilytä jääkaapissa. Ravistettava hyvin ennen käyttöä.pidä pakkaus tiiviisti suljettuna. Käyttämättä jäänyt annos on hävitettävä 14 päivän kuluttua. |
|
miten Duricef toimitetaan
Duricef® (cefadroksiilimonohydraatti, USP) 500 mg kapselit: läpinäkymätön, punaruskea ja valkoinen kova gelatiinikapseli, jonka toisessa päässä merkintä ”PPP” ja ”784” ja toisessa päässä ”Duricef” ja ”500 mg”.
kapselit toimitetaan seuraavasti:
n 0430-0780-19 pullo, jossa 50
säilytä valvotussa huoneenlämmössä 15-30°C (59° – 86°F).
Duricef® 1 gramman tabletit: valkoinen tai luonnonvalkoinen, yläpuolelta halkaistu, soikeanmuotoinen, jossa merkintä ”PPP” toisella puolella jakouurretta ja ”785” toisella puolella jakouurretta.
n 0430-0781-19 pullo, jossa 50
säilytä valvotussa huoneenlämmössä 15-30°C (59° – 86°F).
Duricef® oraalisuspensiota varten on appelsiini-ananasmakuista, ja sitä toimitetaan seuraavasti:
250 mg/5 mL N 0430-2782-15 50 mL: n pullo
n 0430-2782-17 100 mL: n pullo
500 mg/5 mL N 0430-2783-16 75 mL: n pullo
n 0430-2783-17 100 mL: n pullo
valvottu huoneenlämpötila 15°-30° C (59°-86° F).
1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk Susceptibility Test, 4th Edition, Vol. 10 (7): m2-A4, Villanova, PA, Huhtikuu, 1990.
2. National Committee for Clinical Laboratory Standards, hyväksytty standardi: Methods for Diluution Antimicrobial Herkkyystests for bacteries that Grow Aerobically, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, Huhtikuu, 1990.
valmistaja Bristol-Myers Squibb Co.
Princeton, NJ 08543
For Warner Chilcott Company, Inc.
Fajardo, PR 00738
markkinoi Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: ensimmäisen sukupolven kefalosporiinit
Consumer resources
- Advanced Reading
Professional resources
asiaan liittyvät hoito-ohjeet
ihon ja rakenteen infektio märkärupi
lääketieteellinen Vastuuvapauslauseke
Leave a Reply