Duricef
Nome generico: cefadroxil
Forma di dosaggio: polvere, per sospensione
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 21 aprile 2020.
- Panoramica
- Effetti Collaterali
- Dosaggio
- Professional
- Interazioni
- Più
Per ridurre lo sviluppo di batteri resistenti ai farmaci e mantenere l’efficacia del Duricef® e altri farmaci antibatterici, Duricef dovrebbe essere utilizzato solo per trattare o prevenire le infezioni che si sono dimostrati o fortemente sospetta di essere causato da batteri.
Duricef Descrizione
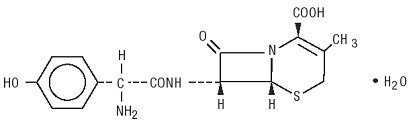
Duricef è un antibiotico cefalosporinico semisintetico destinato alla somministrazione orale. È un bianco a polvere cristallina bianco-giallastra. È solubile in acqua ed è acido-stabile. È chimicamente designato come acido 5-Tia-1-azabicicloott-2-en-2-carbossilico, 7-ammino] – 3-metil-8-osso -, monoidrato] -. Ha la formula C16H17N3O5S * H2O e il peso molecolare di 381,40. Si ha la seguente formula di struttura:
Duricef compresse rivestite con film, 1 g, contengono i seguenti ingredienti inattivi: cellulosa microcristallina, idrossipropil metilcellulosa, magnesio stearato, polietilenglicole, polisorbato 80, simethicone emulsione, e biossido di titanio.
Duricef per sospensione orale contiene i seguenti ingredienti inattivi: FD & C giallo n. 6, aromi (naturali e artificiali), polisorbato 80, benzoato di sodio, saccarosio e gomma xantano.
Le capsule Duricef contengono i seguenti ingredienti inattivi: D & C Red No. 28, FD &C Blue No. 1, FD&C Red No. 40, gelatina, magnesio stearato e biossido di titanio.
Duricef – Farmacologia clinica
Duricef viene rapidamente assorbito dopo somministrazione orale. Dopo dosi singole di 500 mg e 1000 mg, le concentrazioni sieriche medie di picco sono state rispettivamente di circa 16 e 28 µg/mL. Livelli misurabili erano presenti 12 ore dopo la somministrazione. Oltre il 90% del farmaco viene escreto immodificato nelle urine entro 24 ore. Le concentrazioni di picco nelle urine sono di circa 1800 µg / mL durante il periodo successivo a una singola dose orale di 500 mg. Gli aumenti del dosaggio generalmente producono un aumento proporzionato della concentrazione urinaria di Duricef (cefadroxil monoidrato, USP). La concentrazione di antibiotico nelle urine, dopo una dose di 1 g, è stata mantenuta ben al di sopra del MIC dei patogeni urinari sensibili per 20-22 ore.
Microbiologia
Test in vitro dimostrano che le cefalosporine sono battericide a causa della loro inibizione della sintesi della parete cellulare. Cefadroxil ha dimostrato di essere attivo contro i seguenti organismi sia in vitro che nelle infezioni cliniche (vedere INDICAZIONI E USO):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Non ha attività contro le specie Pseudomonas e Acinetobacter calcoaceticus (precedentemente specie Mima e Herellea).
Test di suscettibilità: Tecniche di diffusione
L’uso di metodi di test di suscettibilità del disco antibiotico che misurano il diametro della zona forniscono una stima accurata della suscettibilità agli antibiotici. Una tale procedura standard1 che è stata raccomandata per l’uso con dischi per testare la suscettibilità degli organismi a cefadroxil utilizza il disco della classe delle cefalosporine (cefalotina). L’interpretazione comporta la correlazione dei diametri ottenuti nel test del disco con la concentrazione minima inibitoria (MIC) per cefadroxil.
Le relazioni del laboratorio che forniscono i risultati del test standard di sensibilità a disco singolo con un disco cefalotinico da 30 µg devono essere interpretate secondo i seguenti criteri:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of “Suscettibile” indica che è probabile che l’agente patogeno sia inibito da livelli ematici generalmente raggiungibili. Un rapporto di” suscettibilità intermedia ” suggerisce che l’organismo sarebbe suscettibile se viene utilizzato un dosaggio elevato o se l’infezione è limitata a tessuti e fluidi (ad esempio, urina) in cui vengono raggiunti alti livelli di antibiotici. Un rapporto di’ Resistente ” indica che è improbabile che le concentrazioni ottenibili dell’antibiotico siano inibitorie e devono essere selezionate altre terapie.
Le procedure standardizzate richiedono l’uso di organismi di controllo di laboratorio. Il disco cefalotinico da 30 µg dovrebbe fornire i seguenti diametri di zona:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution metodo 2 o equivalente, un isolato batterico può essere considerato suscettibile se il valore di MIC (concentrazione minima inibitoria) per la cefalotina è pari o inferiore a 8 µg/mL. Gli organismi sono considerati resistenti se la MIC è pari o superiore a 32 µg/mL. Gli organismi con un valore MIC inferiore a 32 µg/mL ma superiore a 8 µg/mL sono intermedi.
Come per i metodi di diffusione standard, le procedure di diluizione richiedono l’uso di organismi di controllo di laboratorio. La polvere di cefalotina standard deve fornire valori MIC nell’intervallo 0,12 µg / mL e 0,5 µg / mL per Staphylococcus aureus ATCC 29213. Per Escherichia coli ATCC 25922, l’intervallo MIC deve essere compreso tra 4,0 µg / mL e 16,0 µg/mL. Per Streptococcus faecalis ATCC 29212, l’intervallo MIC deve essere compreso tra 8,0 e 32,0 µg / mL.
Indicazioni e Utilizzo per Duricef
Duricef è indicato per il trattamento di pazienti con infezione causata da ceppi sensibili di organismi designati nelle seguenti patologie:
infezioni del tratto Urinario causate da E. coli, P. mirabilis, e Klebsiella specie.
Infezioni della pelle e della struttura della pelle causate da stafilococchi e / o streptococchi.
Faringite e / o tonsillite causata da Streptococcus pyogenes (streptococchi beta-emolitici di gruppo A).
Nota: Solo la penicillina per via intramuscolare di somministrazione ha dimostrato di essere efficace nella profilassi della febbre reumatica. Duricef è generalmente efficace nell’eradicazione degli streptococchi dall’orofaringe. Tuttavia, non sono disponibili dati che stabiliscano l’efficacia di Duricef per la profilassi della successiva febbre reumatica.
Nota: i test di coltura e di suscettibilità devono essere iniziati prima e durante la terapia. Quando indicato, devono essere effettuati studi sulla funzionalità renale.
Per ridurre lo sviluppo di batteri resistenti ai farmaci e mantenere l’efficacia di Duricef e di altri farmaci antibatterici, Duricef deve essere usato solo per trattare o prevenire infezioni che sono dimostrate o fortemente sospettate di essere causate da batteri sensibili. Quando sono disponibili informazioni sulla cultura e sulla suscettibilità, devono essere prese in considerazione per selezionare o modificare la terapia antibatterica. In assenza di tali dati, l’epidemiologia locale e i modelli di suscettibilità possono contribuire alla selezione empirica della terapia.
Controindicazioni
Duricef è controindicato nei pazienti con allergia nota al gruppo di antibiotici cefalosporinici.
Avvertenze
PRIMA DI INIZIARE LA TERAPIA CON Duricef, DEVE ESSERE EFFETTUATA UN’ATTENTA INDAGINE PER DETERMINARE SE IL PAZIENTE HA AVUTO PRECEDENTI REAZIONI DI IPERSENSIBILITÀ A CEFADROXIL, CEFALOSPORINE, PENICILLINE O ALTRI FARMACI. SE QUESTO PRODOTTO DEVE ESSERE SOMMINISTRATO A PAZIENTI SENSIBILI ALLA PENICILLINA, DEVE ESSERE ESERCITATA CAUTELA PERCHÉ LA SENSIBILITÀ CROCIATA TRA ANTIBIOTICI BETA-LATTAMICI È STATA CHIARAMENTE DOCUMENTATA E PUÒ VERIFICARSI FINO AL 10% DEI PAZIENTI CON UNA STORIA DI ALLERGIA ALLA PENICILLINA.
SE SI VERIFICA UNA REAZIONE ALLERGICA A Duricef, INTERROMPERE IL FARMACO. LE REAZIONI ACUTE GRAVI DI IPERSENSIBILITÀ POSSONO RICHIEDERE IL TRATTAMENTO CON EPINEFRINA ED ALTRE MISURE DI EMERGENZA, COMPRESO L’OSSIGENO, I LIQUIDI ENDOVENOSI, GLI ANTISTAMINICI ENDOVENOSI, I CORTICOSTEROIDI, LE AMMINE PRESSORIE E LA GESTIONE DELLE VIE AEREE, COME INDICATO CLINICAMENTE.
La diarrea associata a clostridium difficile (CDAD) è stata riportata con l’uso di quasi tutti gli agenti antibatterici, incluso Duricef, e può variare in gravità da lieve diarrea a colite fatale. Il trattamento con agenti antibatterici altera la normale flora del colon portando alla crescita eccessiva di C. difficile.
C. difficile produce tossine A e B che contribuiscono allo sviluppo di CDAD. I ceppi di C. difficile produttori di ipertossina causano un aumento della morbilità e della mortalità, poiché queste infezioni possono essere refrattarie alla terapia antimicrobica e possono richiedere la colectomia. La CDAD deve essere presa in considerazione in tutti i pazienti che presentano diarrea dopo l’uso di antibiotici. È necessaria un’attenta anamnesi poiché è stato segnalato che il CDAD si verifica più di due mesi dopo la somministrazione di agenti antibatterici.
Se si sospetta o si conferma la presenza di CDAD, potrebbe essere necessario interrompere l’uso di antibiotici in corso non diretti contro C. difficile. La gestione appropriata dell’elettrolito e del liquido, il completamento della proteina, il trattamento antibiotico di C. difficile e la valutazione chirurgica dovrebbero essere istituiti come clinicamente indicato.
Precauzioni
Generale
Duricef deve essere usato con cautela in presenza di funzionalità renale marcatamente compromessa (clearance della creatinina inferiore a 50 mL/min / 1,73 M2). (Vedere DOSAGGIO E SOMMINISTRAZIONE.) Nei pazienti con compromissione renale nota o sospetta, devono essere effettuati un ‘ attenta osservazione clinica e appropriati studi di laboratorio prima e durante la terapia.
La prescrizione di Duricef in assenza di un’infezione batterica provata o fortemente sospettata o di un’indicazione profilattica è improbabile che fornisca benefici al paziente e aumenti il rischio di sviluppo di batteri resistenti ai farmaci.
L’uso prolungato di Duricef può causare la crescita eccessiva di organismi non sensibili. È essenziale un’attenta osservazione del paziente. Se si verifica una superinfezione durante la terapia, devono essere prese misure appropriate.
Duricef deve essere prescritto con cautela nei soggetti con anamnesi di malattia gastrointestinale, in particolare colite.
Informazioni per i pazienti
I pazienti devono essere avvisati che i farmaci antibatterici incluso Duricef devono essere usati solo per trattare le infezioni batteriche. Non trattano le infezioni virali (ad esempio, il comune raffreddore). Quando Duricef è prescritto per trattare un’infezione batterica, ai pazienti deve essere detto che, sebbene sia comune sentirsi meglio all’inizio del corso della terapia, il farmaco deve essere assunto esattamente come indicato. Saltare le dosi o non completare l’intero ciclo di terapia può (1) diminuire l’efficacia del trattamento immediato e (2) aumentare la probabilità che i batteri sviluppino resistenza e non siano curabili da Duricef o da altri farmaci antibatterici in futuro.
La diarrea è un problema comune causato da antibiotici che di solito termina quando l’antibiotico viene interrotto. A volte dopo aver iniziato il trattamento con antibiotici, i pazienti possono sviluppare feci acquose e sanguinolente (con o senza crampi allo stomaco e febbre) anche due o più mesi dopo aver assunto l’ultima dose dell’antibiotico. Se ciò si verifica, i pazienti devono contattare il medico il prima possibile.
Interazioni farmaco/test di laboratorio
Sono stati riportati test diretti positivi di Coombs durante il trattamento con antibiotici cefalosporinici. Negli studi ematologici o nelle procedure di cross-matching trasfusionale quando vengono eseguiti test antiglobulinici sul lato minore o nei test di Coombs di neonati le cui madri hanno ricevuto antibiotici cefalosporinici prima del parto, si dovrebbe riconoscere che un test di Coombs positivo può essere dovuto al farmaco.
Carcinogenesi, mutagenesi e compromissione della fertilità
Non sono stati condotti studi a lungo termine per determinare il potenziale cancerogeno. Non sono stati effettuati test di tossicità genetica.
Gravidanza: Gravidanza Categoria B
Studi sulla riproduzione sono stati condotti in topi e ratti a dosi fino a 11 volte la dose umana e non hanno rivelato alcuna evidenza di compromissione della fertilità o danno al feto a causa di cefadroxil monoidrato. Non ci sono, tuttavia, studi adeguati e ben controllati in donne in gravidanza. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, questo farmaco deve essere usato durante la gravidanza solo se chiaramente necessario.
Lavoro e consegna
Duricef non è stato studiato per l’uso durante il travaglio e il parto. Il trattamento deve essere somministrato solo se chiaramente necessario.
Madri che allattano
Si deve usare cautela quando cefadroxil monoidrato viene somministrato a una madre che allatta.
Uso pediatrico
(Vedere DOSAGGIO E SOMMINISTRAZIONE.)
Uso geriatrico
Di circa 650 pazienti che hanno ricevuto cefadroxil per il trattamento delle infezioni del tratto urinario in tre studi clinici, il 28% aveva 60 anni e più, mentre il 16% aveva 70 anni e più. Di circa 1000 pazienti che hanno ricevuto cefadroxil per il trattamento dell’infezione cutanea e della struttura cutanea in 14 studi clinici, il 12% aveva 60 anni e più mentre il 4% aveva 70 anni e oltre. In questi studi non sono state osservate differenze complessive nella sicurezza tra i pazienti anziani e i pazienti più giovani. Gli studi clinici di cefadroxil per il trattamento della faringite o della tonsillite non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso dai pazienti più giovani. Altre esperienze cliniche riportate con cefadroxil non hanno identificato differenze nelle risposte tra pazienti anziani e più giovani, ma non si può escludere una maggiore sensibilità di alcuni individui anziani.
Cefadroxil è sostanzialmente escreto per via renale e un aggiustamento del dosaggio è indicato per i pazienti con insufficienza renale (vedere DOSAGGIO E SOMMINISTRAZIONE: Insufficienza renale). Poiché i pazienti anziani hanno maggiori probabilità di avere una ridotta funzionalità renale, si deve prestare attenzione nella selezione della dose e può essere utile monitorare la funzionalità renale.
Reazioni avverse
Gastrointestinale
Durante o dopo il trattamento antibiotico possono verificarsi sintomi di colite pseudomembranosa (vedere AVVERTENZE). Raramente sono stati riportati dispepsia, nausea e vomito. Si è verificata anche la diarrea.
Ipersensibilità
Sono state osservate allergie (sotto forma di eruzione cutanea, orticaria, angioedema e prurito). Queste reazioni di solito si placarono dopo la sospensione del farmaco. È stata riportata anche anafilassi.
Altre
Altre reazioni hanno incluso disfunzione epatica inclusa colestasi ed aumenti delle transaminasi sieriche, prurito genitale, moniliasi genitale, vaginite, neutropenia transitoria moderata, febbre. Raramente sono stati riportati agranulocitosi, trombocitopenia, insufficienza epatica idiosincratica, eritema multiforme, sindrome di Stevens-Johnson, malattia da siero e artralgia.
In aggiunta alle reazioni avverse sopra elencate che sono state osservate in pazienti trattati con cefadroxil, sono state riportate le seguenti reazioni avverse e test di laboratorio alterati per gli antibiotici di classe cefalosporina:
la necrolisi epidermica Tossica, dolore addominale, superinfezione, disfunzione renale, nefropatia tossica, anemia aplastica, anemia emolitica, emorragie, tempo di protrombina prolungato, positivo di Coombs test, aumento del BUN, aumento della creatinina, fosfatasi alcalina elevata, elevata aspartato aminotransferasi (AST), elevata alanina aminotransferasi (ALT), elevati livelli di bilirubina, livelli elevati di LDH, eosinofilia, pancitopenia, neutropenia.
Diverse cefalosporine sono state implicate nell’insorgenza di crisi epilettiche, in particolare in pazienti con insufficienza renale, quando il dosaggio non è stato ridotto (vedere DOSAGGIO e SOMMINISTRAZIONE e SOVRADOSAGGIO). Se si verificano convulsioni associate alla terapia farmacologica, il farmaco deve essere interrotto. La terapia anticonvulsivante può essere somministrata se clinicamente indicato.
Sovradosaggio
Uno studio su bambini di età inferiore ai sei anni ha suggerito che l’ingestione di meno di 250 mg / kg di cefalosporine non è associata a risultati significativi. Non è necessaria alcuna azione se non il sostegno generale e l’osservazione. Per quantità superiori a 250 mg / kg, indurre lo svuotamento gastrico.
In cinque pazienti anurici, è stato dimostrato che una media del 63% di una dose orale di 1 g viene estratta dal corpo durante una sessione di emodialisi di 6-8 ore.
Duricef Dosaggio e somministrazione
Duricef è acido-stabile e può essere somministrato per via orale indipendentemente dai pasti. La somministrazione con il cibo può essere utile per diminuire i potenziali disturbi gastrointestinali occasionalmente associati alla terapia orale con cefalosporine.
Adulti
Infezioni del tratto urinario: Per le infezioni del tratto urinario inferiore non complicate (cioè cistite) il dosaggio abituale è di 1 o 2 g al giorno in una singola (q.d.) o dosi divise (b.i.d.).
Per tutte le altre infezioni del tratto urinario il dosaggio usuale è di 2 g al giorno in dosi divise (b.i.d.).
Infezioni della pelle e della struttura della pelle: Per le infezioni della pelle e della struttura della pelle il dosaggio usuale è di 1 g al giorno in dosi singole (q.d.) o divise (b.i.d.).
Faringite e tonsillite: Trattamento del gruppo A faringite streptococcica beta-emolitica e tonsillite—1 g al giorno in dosi singole (q.d.) o divise (b.i.d.) per 10 giorni.
Bambini
Per le infezioni del tratto urinario, la dose giornaliera raccomandata per i bambini è di 30 mg/kg/die in dosi divise ogni 12 ore. Per faringite, tonsillite e impetigine, la dose giornaliera raccomandata per i bambini è di 30 mg/kg/die in una singola dose o in dosi equamente divise ogni 12 ore. Per altre infezioni della pelle e della struttura della pelle, la dose giornaliera raccomandata è di 30 mg / kg / die in dosi equamente divise ogni 12 ore. Nel trattamento delle infezioni da streptococco beta-emolitico, un dosaggio terapeutico di Duricef deve essere somministrato per almeno 10 giorni.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | 2 cucchiaini | |
Compromissione Renale
Nei pazienti con compromissione della funzionalità renale, il dosaggio di cefadroxil monoidrato deve essere adattata in base alla clearance della creatinina tassi per evitare accumulo di farmaco. Il seguente programma è suggerito. Negli adulti, la dose iniziale è di 1000 mg di Duricef e la dose di mantenimento (basata sulla velocità di clearance della creatinina ) è di 500 mg agli intervalli di tempo elencati di seguito.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients con livelli di clearance della creatinina superiori a 50 ml / min possono essere trattati come se fossero pazienti con funzionalità renale normale.
| Dimensione Bottiglia | Ricostituzione Indicazioni stradali |
| 100 mL |
a Sospendere, per un totale di 67 mL di acqua. Metodo: Toccare leggermente la bottiglia per allentare la polvere. Aggiungere 67 ml di acqua in due porzioni. Agitare bene dopo ogni aggiunta. |
| 75 mL |
Sospendere in un totale di 51 ml di acqua. Metodo: Toccare leggermente la bottiglia per allentare la polvere. Aggiungere 51 ml di acqua in due porzioni. Agitare bene dopo ogni aggiunta. |
| 50 mL |
Sospendere in un totale di 34 ml di acqua. Metodo: Toccare leggermente la bottiglia per allentare la polvere. Aggiungere 34 ml di acqua in due porzioni. Agitare bene dopo ogni aggiunta. |
|
Dopo la ricostituzione, conservare in frigorifero. Agitare bene prima dell’uso. Tenere il contenitore ben chiuso. Eliminare la porzione non utilizzata dopo 14 giorni. |
|
Come viene fornito Duricef
Duricef® (cefadroxil monoidrato, USP) Capsule da 500 mg: capsule di gelatina dura opaca, marrone e bianca, con impresso “PPP’ e “784’ su una fine e con “Duricef’ e “500 mg’ sull’altra estremità.
Le capsule sono fornite come segue:
N 0430-0780-19 Flacone da 50
Conservare a temperatura ambiente controllata 15°-30 ° C (59°-86° F).
Duricef® Compresse da 1 grammo: da bianco a biancastro, bisecate in alto, di forma ovale, con impresso “PPP “su un lato della bisetta e’ 785” sull’altro lato della bisetta. Le compresse sono fornite come segue:
N 0430-0781-19 Flacone da 50
Conservare a temperatura ambiente controllata 15°-30 ° C (59°-86° F).
Duricef® per sospensione orale è aromatizzato all’arancia-ananas e viene fornito come segue:
250 mg/5 mL N 0430-2782-15 50 mL
N 0430-2782-17 Flacone da 100 mL
500 mg/5 mL N 0430-2783-16 75 mL
N 0430-2783-17 Flacone da 100 mL
Prima della ricostituzione: Conservare a temperatura ambiente controllata 15°-30° C (59° – 86° F).
1. Comitato nazionale per gli standard di laboratorio clinico, Standard approvato, Standard di prestazione per test di suscettibilità del disco antimicrobico, 4a edizione, Vol. 10 (7): M2-A4, Villanova, PA, aprile, 1990.
2. Comitato nazionale per gli standard di laboratorio clinico, standard approvato: Metodi per la diluizione Test di suscettibilità antimicrobica per i batteri che crescono aerobicamente, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, aprile, 1990.
Prodotto da Bristol-Myers Squibb Co.per ulteriori informazioni, consultare il sito:
Fajardo, PR 00738
Commercializzato da Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: la prima generazione di cefalosporine
risorse per i Consumatori
- Avanzate di Lettura
risorse Professionali
- la Prescrizione di Informazione;
- Cefadroxil Sospensione Orale (FDA)
relativo trattamento guide
- Endocardite Batterica Prevenzione
- Pelle e la Struttura Infezione
- Impetigo
- Infezioni Renali
- … +4 più
Disclaimer medico
Leave a Reply