Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. Kemiallinen nimi on ( ± ) – 1-piperatsinyyli] etoksi] etikkahappo, dihydrokloridi. Setiritsiinihydrokloridi on raseeminen yhdiste, jonka empiirinen kaava on C21H25ClN2O3 •2hcl. Sen molekyylipaino on 461,82 ja kemiallinen rakenne on esitetty alla:
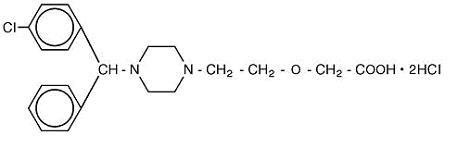
Setiritsiinidihydrokloridi on valkoista tai lähes valkoista jauhetta ja liukenee hyvin veteen, lähes liukenematon asetoniin ja metyleenikloridiin. Setiritsiinihydrokloridi oraaliliuos USP on väritön tai hieman keltainen oraaliliuos, joka sisältää Setiritsiinihydrokloridia pitoisuutena 1 mg/mL (5 mg/5 mL) suun kautta annettuna. PH on välillä 4-5. Oraaliliuoksen inaktiiviset aineet ovat: väkevä etikkahappo, rypäleen maku, glyseriini, metyyliparabeeni, propyleeniglykoli, propyyliparabeeni, natriumasetaatti, sakkaroosi ja puhdistettu vesi.
setiritsiini-Kliininen farmakologia
vaikutusmekanismi: setiritsiini, ihmisen hydroksitsiinin metaboliitti, on antihistamiini; sen pääasialliset vaikutukset välittyvät selektiivisen perifeeristen H1-reseptorien eston kautta. Setiritsiinin antihistamiinivaikutus on dokumentoitu selvästi erilaisissa eläin-ja ihmismalleissa. In vivo ja ex vivo eläinmalleissa on havaittu Vähäinen antikolinerginen ja serotoninerginen vaikutus. Kliinisissä tutkimuksissa suun kuivuminen oli kuitenkin yleisempää Setiritsiinillä kuin lumelääkkeellä. In vitro-reseptorisitoutumistutkimukset eivät ole osoittaneet mitattavissa olevaa affiniteettia muihin kuin H1-reseptoreihin. Rotilla tehdyissä autoradiografisissa tutkimuksissa radioaktiivisesti merkityllä Setiritsiinillä on todettu Vähäinen tunkeutuminen aivoihin. Hiirillä tehdyt Ex vivo-kokeet ovat osoittaneet, että systeemisesti annettu setiritsiini ei merkittävästi miehitä aivojen H1-reseptoreita.
farmakokinetiikka:
imeytyminen: setiritsiini imeytyi nopeasti ja huippupitoisuuden saavuttamiseen (T max) kului noin 1 tunti suun kautta otettujen tablettien tai oraaliliuoksen jälkeen aikuisilla. Vastaava hyötyosuus havaittiin tabletti-ja oraaliliuosannostusmuotojen välillä. Kun terveille vapaaehtoisille annettiin useita Setiritsiiniannoksia (10 mg tabletti kerran vuorokaudessa 10 vuorokauden ajan), keskimääräinen huippupitoisuus plasmassa (C max) oli 311 ng/mL. Kumuloitumista ei havaittu. Setiritsiinin farmakokinetiikka oli lineaarinen 5-60 mg: n oraalisilla annoksilla. Ruoka ei vaikuttanut Setiritsiinialtistukseen (AUC), mutta T max-arvo viivästyi 1, 7 tuntia ja C max-arvo pieneni 23% ruoan läsnä ollessa.
Jakelu: Setiritsiini sitoutuu plasman proteiineihin keskimäärin 93-prosenttisesti riippumatta pitoisuudesta 25-1000 ng / mL, johon sisältyvät havaitut terapeuttiset plasmapitoisuudet.
metabolia: 6 terveellä miespuolisella vapaaehtoisella tehty massatasetutkimus osoitti, että 70% annetusta radioaktiivisuudesta havaittiin virtsassa ja 10% ulosteessa. Noin 50% radioaktiivisuudesta todettiin virtsassa muuttumattomana lääkkeenä. Suurin osa plasman huippu-radioaktiivisuuden nopeasta lisääntymisestä liittyi emolääkkeeseen, mikä viittaa vähäiseen ensikierron metaboliaan. Setiritsiini metaboloituu vähäisessä määrin oksidatiivisen O-dealkylaation kautta metaboliitiksi, jolla on vähäinen antihistamiinivaikutus. Metaboliasta vastaavaa entsyymiä tai entsyymejä ei ole tunnistettu.
eliminaatio: keskimääräinen eliminaation puoliintumisaika 146 terveellä vapaaehtoisella useissa farmakokineettisissä tutkimuksissa oli 8, 3 tuntia ja setiritsiinin näennäinen kokonaispuhdistuma noin 53 mL/min.
yhteisvaikutustutkimukset
farmakokineettiset yhteisvaikutustutkimukset Setiritsiinillä tehtiin aikuisilla pseudoefedriinillä, antipyriinilla, ketokonatsolilla, erytromysiinillä ja atsitromysiinillä.
yhteisvaikutuksia ei havaittu. Teofylliinin (400 mg kerran vuorokaudessa 3 vuorokauden ajan) ja setiritsiinin (20 mg kerran vuorokaudessa 3 vuorokauden ajan) moniannostutkimuksessa havaittiin setiritsiinin puhdistuman pienenevän 16%. Samanaikaisesti annettu setiritsiini ei muuttanut teofylliinin dispositiota.
erityisryhmät
lapsipotilaat: Keskimääräinen C max oli 660 ng/mL 2-5-vuotiailla lapsipotilailla, jotka saivat 5 mg setiritsiiniä. Vertailututkimusten perusteella paino normalisoitui, näennäinen kokonaispuhdistuma oli 81-111% suurempi ja eliminaation puoliintumisaika 33-41% lyhyempi lapsipotilailla kuin aikuisilla. 6-23 kuukauden ikäisillä lapsipotilailla, jotka saivat kerta-annoksena 0, 25 mg/kg Setiritsiinioraaliliuosta (keskimääräinen annos 2, 3 mg), keskimääräinen C max-arvo oli 390 ng/mL. Vertailututkimusten perusteella painon normalisoima näennäinen kokonaispuhdistuma oli 304% suurempi ja eliminaation puoliintumisaika 63% lyhyempi tässä lapsipotilasryhmässä kuin aikuisilla. Keskimääräinen AUC (0-t) 6 kk – < 2-vuotiailla lapsilla, jotka saavat Setiritsiiniliuoksen enimmäisannoksen (2, 5 mg kahdesti vuorokaudessa), on todennäköisesti kaksinkertainen verrattuna aikuisiin, jotka saavat 10 mg Setiritsiinitabletteja kerran vuorokaudessa.
sukupuolen vaikutus: sukupuolen vaikutusta setiritsiinin farmakokinetiikkaan ei ole tutkittu riittävästi.
rodun vaikutus: setiritsiinin kinetiikassa ei ole havaittu rotuun liittyviä eroja.
farmakodynamiikka: setiritsiinihydrokloridi esti 19 lapsipotilaalla (5-12-vuotiaat) voimakkaasti ihonsisäisen histamiiniruiskeen aiheuttamaa kiertokulkua ja pahenemisvaihetta 5 mg: n ja 10 mg: n annoksina ja vaikutus kesti vähintään 24 tuntia. Setiritsiinihydrokloridin antihistamiinivaikutuksille (wheal-ja flare-vasteen vaimeneminen) ei todettu siedettävyyttä 35 päivän tutkimuksessa 5-12-vuotiailla lapsilla. 10: llä 7-25 kuukauden ikäisellä pikkulapsella, jotka saivat 4-9 päivän setiritsiiniä oraaliliuoksena (0, 25 mg/kg kahdesti vuorokaudessa), havaittiin histamiinin aiheuttaman ihovaurion (10 mg/mL) estyvän 90% ja pahenemisvaiheen estyminen 87% 12 tuntia viimeisen annoksen antamisen jälkeen. Tämän histamiinin aiheuttaman wheal-vasteen ja flare-vasteen suppression kliinistä merkitystä ihotesteissä ei tunneta.
setiritsiini esti myös useiden muiden välittäjäaineiden tai histamiinia vapauttavien aineiden intradermaalisen injektion vaikutuksia, samoin kuin vaste kylmähaasteeseen kylmän aiheuttamaa urtikariaa sairastavilla potilailla. Lievästi astmaattisilla henkilöillä setiritsiinihydrokloridi 5-20 mg: n annoksella esti sumutetun histamiinin aiheuttaman bronkokonstriktion ja lähes täydellisen salpauksen 20 mg: n annoksen jälkeen. Enintään 12 tuntia ihon antigeenihaasteen jälkeen tehdyissä tutkimuksissa 20 mg: n annoksella estettiin eosinofiilien, neutrofiilien ja basofiilien, jotka ovat allergisen tulehdusvasteen osatekijöitä, myöhäisvaiheen aktivoituminen. Neljässä terveillä aikuisilla miehillä tehdyssä kliinisessä tutkimuksessa ei havaittu kliinisesti merkitsevää keskimääräistä QTc-ajan nousua setiritsiinihydrokloridihoitoa saaneilla koehenkilöillä. Ensimmäisessä tutkimuksessa, lumekontrolloidussa vaihtovuoroisessa tutkimuksessa, Setiritsiinihydrokloridia annettiin enintään 60 mg: n vuorokausiannoksina, mikä oli 6 kertaa suurempi kuin suurin kliininen annos, 1 viikon ajan, eikä merkittävää Keskimääräistä QTc-ajan pitenemistä esiintynyt. Toisessa tutkimuksessa, crossover-tutkimuksessa, Setiritsiinihydrokloridia 20 mg ja erytromysiiniä (500 mg joka 8.tunti) annettiin yksinään ja yhdistelmänä. Yhdistelmällä tai pelkällä Setiritsiinihydrokloridilla ei ollut merkittävää vaikutusta QTc: hen. Kolmannessa tutkimuksessa, myös crossover-tutkimuksessa, Setiritsiinihydrokloridia 20 mg ja ketokonatsolia (400 mg vuorokaudessa) annettiin yksinään ja yhdistelmänä.
setiritsiinihydrokloridi suurensi QTc-aikaa keskimäärin 9, 1 ms lähtötilanteeseen verrattuna 10 hoitopäivän jälkeen. Ketokonatsoli myös lisäsi QTc: tä 8,3 msek: lla. Yhdistelmä aiheutti 17,4 MS: n lisäyksen, joka vastaa yksittäisten vaikutusten summaa. Näin ollen QTc: llä ei ollut merkittävää yhteisvaikutusta Setiritsiinihydrokloridin ja ketokonatsolin yhdistelmän kanssa. Neljännessä tutkimuksessa, lumekontrolloidussa rinnakkaistutkimuksessa, Setiritsiinihydrokloridia 20 mg annettiin yksinään tai yhdessä atsitromysiinin kanssa (500 mg kerta-annoksena ensimmäisenä päivänä ja sen jälkeen 250 mg kerran vuorokaudessa). QTc-aika ei noussut merkitsevästi, kun Setiritsiinihydrokloridia annettiin 20 mg yksinään tai yhdessä atsitromysiinin kanssa. Neljän viikon kliinisessä tutkimuksessa 6-11-vuotiailla lapsipotilailla satunnaistettujen EKG-mittausten tulokset ennen hoitoa ja 2 hoitoviikon jälkeen osoittivat, että 5 mg: n tai 10 mg: n Setiritsiinihydrokloridiannos ei lisännyt QTc-aikaa lumelääkkeeseen verrattuna. Viikon mittaisessa kliinisessä tutkimuksessa (N=86), jossa Setiritsiinihydrokloridioraaliliuosta USP (0, 25 mg/kg kahdesti vuorokaudessa) verrattiin lumelääkkeeseen 6-11 kuukauden ikäisillä lapsipotilailla, EKG-mittauksissa 3 tunnin sisällä viimeisestä annoksesta ei havaittu EKG-poikkeavuuksia tai QTc-ajan pitenemistä kummassakaan ryhmässä lähtötilanteeseen verrattuna. Tiedot muista tutkimuksista, joissa Setiritsiinihydrokloridia annettiin 6-23 kuukauden ikäisille potilaille, olivat yhdenmukaisia tämän tutkimuksen tulosten kanssa.
Setiritsiinihydrokloridin vaikutusta QTc-aikaan yli 10 mg: n annoksilla ei ole tutkittu alle 12-vuotiailla lapsilla. Kuusiviikkoisessa lumekontrolloidussa tutkimuksessa, johon osallistui 186 allergista nuhaa ja lievää tai kohtalaista astmaa sairastavaa 12-64-vuotiasta potilasta, setiritsiinihydrokloridi 10 mg kerran vuorokaudessa paransi nuhaoireita eikä muuttanut keuhkojen toimintaa. Kaksi viikkoa kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa 65: llä allergista nuhaa sairastavalla lapsipotilaalla (ikä 6-11 vuotta) tehty osaanalyysi osoitti, että setiritsiinihydrokloridi ei muuttanut keuhkojen toimintaa. Nämä tutkimukset tukevat Setiritsiinihydrokloridin turvallisuutta lapsilla ja aikuisilla allergista nuhaa sairastavilla potilailla, joilla on lievä tai keskivaikea astma.
kliiniset tutkimukset: Yhdysvalloissa tehtiin satunnaistettuja, kaksoissokkoutettuja monikeskustutkimuksia, joissa 5-20 mg setiritsiiniä verrattiin lumelääkkeeseen yli 12-vuotiailla potilailla, joilla oli ympärivuotinen allerginen nuha. Näistä kahdessa ympärivuotisen allergisen nuhan oireet vähenivät merkitsevästi enimmillään 8 viikkoa. Kroonista idiopaattista urtikariaa sairastavilla potilailla tehtiin myös kaksi 4 viikon satunnaistettua, kaksoissokkoutettua monikeskustutkimusta, joissa verrattiin 5-20 mg setiritsiiniä lumelääkkeeseen. Yleisesti ottaen 10 mg: n annos oli tehokkaampi kuin 5 mg: n annos, eikä 20 mg: n annos lisännyt vaikutusta. Osaan näistä tutkimuksista osallistui 12-16-vuotiaita lapsipotilaita. Lisäksi Yhdysvalloissa tehtiin neljä satunnaistettua, lumekontrolloitua 2-4 viikon kaksoissokkotutkimusta 534: llä kausiluonteista allergista nuhaa sairastavalla 6-11-vuotiaalla lapsipotilaalla enintään 10 mg: n annoksilla.
käyttöaiheet & käyttö
ympärivuotinen allerginen nuha: setiritsiinihydrokloridi oraaliliuos, USP on tarkoitettu allergeenien, kuten pölypunkkien, eläinten hilseiden ja homeiden aiheuttaman ympärivuotisen allergisen nuhan oireiden lievittämiseen 6-23 kuukauden ikäisillä lapsilla. Oireita hoidetaan tehokkaasti ovat aivastelu, rinorrea, postnasal vastuuvapauden, nenän kutina, silmien kutina, ja repiminen.
krooninen urtikaria: Setiritsiinihydrokloridioraaliliuos, USP on tarkoitettu kroonisen idiopaattisen urtikarian komplisoitumattoman iho-oireiden hoitoon 6 kuukauden-5 vuoden ikäisillä lapsilla. Se vähentää merkittävästi esiintyminen, vakavuus, ja kesto nokkosihottuma ja vähentää merkittävästi kutinaa.
vasta-aiheet
setiritsiinihydrokloridi-oraaliliuos, USP on vasta-aiheinen potilailla, joiden tiedetään olevan yliherkkiä sille tai jollekin sen aineosalle tai hydroksitsiinille.
varotoimet
henkistä valppautta vaativat toimet: kliinisissä tutkimuksissa joillakin Setiritsiinihydrokloridia käyttävillä potilailla on raportoitu uneliaisuutta; siksi on noudatettava asianmukaista varovaisuutta ajettaessa autoa tai käytettäessä mahdollisesti vaarallisia koneita. Setiritsiinihydrokloridin samanaikaista käyttöä alkoholin tai muiden keskushermostoa lamaavien aineiden kanssa tulee välttää, koska vireystila saattaa heikentyä ja keskushermoston suorituskyky heikentyä entisestään.
lääkkeiden yhteisvaikutukset: kliinisesti merkittäviä yhteisvaikutuksia ei ole havaittu teofylliinin, atsitromysiinin, pseudoefedriinin, ketokonatsolin eikä erytromysiinin kanssa pieninä annoksina. Setiritsiinin puhdistuma pieneni hieman 400 mg: n teofylliiniannoksen seurauksena; on mahdollista, että suuremmilla teofylliiniannoksilla voi olla suurempi vaikutus.
karsinogeneesi, mutageneesi ja Fertiliteetin heikkeneminen: rotilla tehdyssä kahden vuoden karsinogeenisuustutkimuksessa setiritsiini ei ollut karsinogeeninen ravinnon kautta annosteltuna annoksella 20 mg/kg (noin 15-kertainen suurimpaan suun kautta annettuun suositeltuun vuorokausiannokseen verrattuna aikuisilla annoksella mg/m2 tai noin 7-kertainen suurimpaan suositeltuun oraaliseen vuorokausiannokseen verrattuna imeväisillä annoksella mg / m2). Hiirillä tehdyssä kaksivuotisessa karsinogeenisuustutkimuksessa setiritsiini lisäsi hyvänlaatuisten maksakasvainten ilmaantuvuutta uroksilla 16 mg/kg: n ravintoannoksella (noin 6-kertainen suun kautta annettuun enimmäisannokseen verrattuna aikuisilla mg/m 2: lla tai noin 3-kertainen imeväisikäisillä suositeltuun enimmäisannokseen verrattuna mg/m 2: lla). Hiirillä ei havaittu maksakasvainten ilmaantuvuuden lisääntymistä ravinnon kautta annetulla annoksella 4 mg/kg (noin 2 kertaa aikuisten suun kautta annettava suurin suositeltu vuorokausiannos mg/m 2: lla tai suunnilleen sama kuin imeväisille suositeltu enimmäisvuorokausiannos mg/m 2: lla). Näiden löydösten kliinistä merkitystä Setiritsiinihydrokloridin pitkäaikaiskäytössä ei tiedetä.
setiritsiini ei ollut mutageeninen Amesin testissä eikä klastogeeninen ihmisen lymfosyyttimäärityksessä, hiiren lymfoomakokeessa eikä In vivo mikronukleuskokeessa rotilla.
hiirillä tehdyssä hedelmällisyyttä ja yleistä lisääntymiskykyä mittaavassa tutkimuksessa setiritsiini ei heikentänyt hedelmällisyyttä oraalisella annoksella 64 mg/kg (noin 25-kertainen suun kautta annettuun enimmäisannokseen verrattuna aikuisilla mg/m 2: lla).
lapsipotilailla: Setiritsiinihydrokloridin turvallisuus on osoitettu 6-5-vuotiailla lapsipotilailla. Setiritsiinin turvallisuus on osoitettu 168: lla 2-5-vuotiaalla potilaalla lumekontrolloiduissa, enintään 4 viikkoa kestäneissä tutkimuksissa. Suurin osa 168 potilaasta sai mg/kg setiritsiinihydrokloridia 0, 2-0, 4 mg/kg. Setiritsiinin turvallisuus 399: llä 12-24 kuukauden ikäisellä potilaalla on osoitettu lumekontrolloidussa 18 kuukauden tutkimuksessa, jossa keskimääräinen annos oli
0, 25 mg/kg kahdesti vuorokaudessa, mikä vastaa vaihteluväliä 4-11 mg/vrk. Setiritsiinihydrokloridi – oraaliliuoksen turvallisuus on osoitettu 42: lla 6-11 kuukauden ikäisellä potilaalla lumekontrolloidussa 7 päivän tutkimuksessa. Määrätty annos oli 0, 25 mg/kg kahdesti vuorokaudessa, mikä vastasi keskiarvoa 4, 5 mg/vrk ja vaihteluväliä 3, 4-6, 2 mg/vrk.
Setiritsiinihydrokloridin teho allergisen nuhan ja kroonisen idiopaattisen urtikarian hoidossa 6-5-vuotiailla lapsipotilailla perustuu ekstrapolointiin Setiritsiinihydrokloridin osoitetusta tehosta näitä sairauksia sairastavilla aikuisilla sekä todennäköisyyteen, että taudin kulku, patofysiologia ja lääkkeen vaikutus ovat oleellisesti samanlaiset näiden kahden potilasryhmän välillä. Teho ekstrapoloidaan ympärivuotiseen allergiseen nuhaan aina 6 kuukauden ikään asti, koska tätä tautia arvellaan esiintyvän aina näihin ikiin asti lapsilla. Lapsipotilaille suositellut annokset perustuvat setiritsiinin farmakokinetiikan ja farmakodynamiikan vertailuihin aikuisilla ja lapsilla sekä setiritsiinin turvallisuusprofiiliin sekä aikuisilla että lapsipotilailla suositellun annoksen suuruisilla tai sitä suuremmilla annoksilla. Setiritsiinin AUC-ja C max-arvot 6-23 kuukauden ikäisillä lapsipotilailla, jotka saivat keskiarvon 2.3 mg kerta-annoksena ja 2-5-vuotiailla henkilöillä, jotka saivat 5 mg Setiritsiinioraaliliuosta kerta-annoksena, arvioitiin olevan 10 mg Setiritsiinitabletteja kerta-annoksena saaneiden aikuisten ja 20 mg Setiritsiinitabletteja kerta-annoksena saaneiden välillä.
setiritsiinin turvallisuutta ja tehoa alle 6 kuukauden ikäisillä lapsipotilailla ei ole osoitettu.
haittavaikutukset
pediatriset tutkimukset tehtiin Setiritsiinihydrokloridilla. Yhdysvalloissa tehtyihin kontrolloituihin ja kontrolloimattomiin kliinisiin tutkimuksiin osallistui yli 1300 6-11-vuotiasta lapsipotilasta, joita hoidettiin Setiritsiinihydrokloridilla 1, 25-10 mg: n vuorokausiannoksilla ja joita hoidettiin yli 900: lla. Hoidon kesto oli 2-12 viikkoa. Enintään 4 viikkoa kestäneissä lumekontrolloiduissa tutkimuksissa oli mukana 168 2-5-vuotiasta lapsipotilasta, jotka saivat setiritsiiniä kerta-annoksina 5 mg vuorokaudessa. 18 kuukautta kestäneeseen lumekontrolloituun tutkimukseen osallistui 399 12-24 kuukauden ikäistä setiritsiinipotilasta (0.25 mg / kg kahdesti vuorokaudessa), ja toisessa 7 päivää kestäneessä lumekontrolloidussa tutkimuksessa oli mukana 42 6-11 kuukauden ikäistä potilasta, jotka saivat setiritsiiniä (0, 25 mg/kg kahdesti vuorokaudessa).
suurin osa setiritsiinihydrokloridia saaneilla 2-11-vuotiailla lapsipotilailla ilmoitetuista haittavaikutuksista oli lieviä tai kohtalaisia. Lumekontrolloiduissa tutkimuksissa haittavaikutuksista johtuvien keskeyttämisten esiintyvyys lapsipotilailla, jotka saivat enintään 10 mg Setiritsiinihydrokloridia, oli melko harvinaista (0, 4% Setiritsiinihydrokloridia saaneilla ja 1, 0% lumelääkettä saaneilla).
taulukossa 1 luetellaan haittavaikutukset, joita raportoitiin lumekontrolloiduissa kliinisissä tutkimuksissa 6-11-vuotiailla lapsipotilailla Setiritsiinihydrokloridin annoksella 5 ja 10 mg ja jotka olivat yleisempiä Setiritsiinihydrokloridin kuin lumelääkkeen yhteydessä. Näistä vatsakipuja pidettiin hoidosta johtuvana ja uneliaisuutta annoksesta riippuvana, 1, 3%: lla lumelääkeryhmässä, 1, 9%: lla 5 mg: n annoksella ja 4, 2%: lla 10 mg: n annoksella. Lumekontrolloiduissa tutkimuksissa 2-5-vuotiailla lapsipotilailla raportoidut haittavaikutukset olivat laadullisesti ja yleisyydeltään samanlaisia kuin 6-11-vuotiailla lapsilla tehdyissä tutkimuksissa raportoidut.
lumelääkekontrolloiduissa tutkimuksissa 6-24 kuukauden ikäisillä lapsipotilailla haittavaikutusten ilmaantuvuus oli sama setiritsiini-ja lumelääkeryhmissä kussakin tutkimuksessa. Uneliaisuutta esiintyi lähes yhtä usein setiritsiiniä saaneilla potilailla ja lumelääkettä saaneilla potilailla. 1 viikon kestäneessä tutkimuksessa 6-11 kuukauden ikäisillä lapsilla setiritsiiniä saaneilla potilailla esiintyi enemmän ärtyneisyyttä/nirsoutta kuin lumelääkettä saaneilla potilailla. 18 kuukautta kestäneessä tutkimuksessa 12 kuukautta täyttäneillä potilailla unettomuutta esiintyi useammin setiritsiiniä saaneilla potilailla kuin lumelääkettä saaneilla potilailla (9, 0% V, 5, 3%). Niillä potilailla, jotka saivat setiritsiiniä vähintään 5 mg päivässä verrattuna lumelääkettä saaneisiin potilaisiin, väsymystä (3, 6% V, 1, 3%) ja huonovointisuutta (3, 6% V, 1, 8%) esiintyi useammin.
Taulukko 1.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| 1, 9% | 3, 1% | 1, 9% | |
| 1, 9% | 2, 8% | oksentelu | 2, 5% | 2, 3% |
seuraavia tapahtumia havaittiin harvoin (alle 2%) joko 3982 aikuiset ja yli 12-vuotiaat lapset tai 659: llä 6-11-vuotiaalla lapsipotilaalla, jotka saivat setiritsiinihydrokloridia yhdysvaltalaisissa tutkimuksissa, joihin sisältyi kuusi kuukautta kestänyt avoin aikuispotilastutkimus. Näiden harvojen tapahtumien syy-yhteyttä Setiritsiinihydrokloridin antoon ei ole vahvistettu.
autonominen hermosto: ruokahaluttomuus, punoitus, lisääntynyt syljeneritys, virtsaumpi.
kardiovaskulaarinen: sydämen vajaatoiminta, hypertensio, sydämentykytys, takykardia.
keskus-ja Ääreishermostot: epänormaali koordinaatio, ataksia, sekavuus, dysfonia, hyperestesia, hyperkinesia, hypertonia, hypestesia, jalkakrampit, migreeni, myeliitti, halvaantuminen, parestesia, ptoosi, pyörtyminen, vapina, Nykiminen, huimaus, näkökenttäpuutos.
Ruoansulatuselimistö: epänormaali maksan toiminta, paheneva hampaan karies, ummetus, dyspepsia, röyhtäily, ilmavaivat, gastriitti, peräpukamat, ruokahalun lisääntyminen, melena, peräsuolen verenvuoto, suutulehdus mukaan lukien haavainen suutulehdus, kielen värimuutokset, kielen turvotus.
urogenitaalinen: kystiitti, dysuria, hematuria, virtsaamistiheys, polyuria, virtsainkontinenssi, virtsatietulehdus.
kuulo ja Tasapainoeläin: kuurous, korvakipu, ototoksisuus, tinnitus.
metabolinen / ravitsemuksellinen: nestehukka, diabetes mellitus, jano.
Luusto, lihakset ja sidekudos: nivelkipu, niveltulehdus, lihasheikkous, lihaskipu.
psyykkiset: epänormaali ajattelu, agitaatio, muistinmenetys, ahdistuneisuus, libidon heikkeneminen, depersonalisaatio, masennus, mielialan horjuvuus, euforia, heikentynyt keskittymiskyky, unettomuus, hermostuneisuus, paroniria, unihäiriö.
hengityselimet: bronkiitti, hengenahdistus, hyperventilaatio, lisääntynyt yskös, keuhkokuume, hengityshäiriöt, nuha, sinuiitti, ylähengitystieinfektio.
lisääntymisterveys: dysmenorrea, naisen rintakipu, kuukautisten välinen verenvuoto, leukorrea, menorragia, vaginiitti.
Reticuloendothelial: lymfadenopatia.
iho: akne, hiustenlähtö, angioedeema, rakkulainen ihottuma, dermatiitti, kuiva iho, ekseema, punoittava ihottuma, furunkuloosi, hyperkeratoosi, hypertrikoosi, lisääntynyt hikoilu, makulopapulaarinen ihottuma, valoherkkyysreaktio, valoherkkyys toksinen reaktio, kutina, purppura, ihottuma, seborrea, ihosairaus, ihon kyhmy, urtikaria.
Erikoisaistit: parosmia, makuaistin menetys, makuaistin vääristyminen.
näkö: sokeus, sidekalvotulehdus, silmäkipu, glaukooma, akkommodaation menetys, silmäverenvuoto, kseroftalmia.
koko keho: tapaturmainen vamma, astenia, selkäkipu, rintakipu, laajentunut vatsa, kasvojen turvotus, kuume, yleistynyt turvotus, kuumat aallot, lisääntynyt paino, jalkojen turvotus, huonovointisuus, nenän polyyppi, kipu, kalpeus, periorbitaalinen turvotus, perifeerinen turvotus, jäykkyys.
Setiritsiinihoidon aikana on satunnaisesti esiintynyt ohimenevää, korjautuvaa maksan aminotransferaasiarvojen nousua. Setiritsiinihydrokloridin käytön yhteydessä on raportoitu hepatiittia, johon on liittynyt merkittävää aminotransferaasiarvojen nousua ja bilirubiiniarvojen nousua.
markkinoille tulon jälkeen
markkinoille tulon jälkeen on lisäksi raportoitu seuraavia harvinaisia, mutta mahdollisesti vakavia haittavaikutuksia: aggressiivinen reaktio, anafylaksia, kolestaasi, kouristukset, glomerulonefriitti, hallusinaatiot, hemolyyttinen anemia, hepatiitti, orofasiaalinen dyskinesia, vaikea hypotensio, kuolleena syntyminen, itsemurha-ajatukset, itsemurha, trombosytopenia ja akuutti yleistynyt eksantematoottinen pustuloosi (AGEP).
ilmoittaaksesi epäillyistä haittavaikutuksista, ota yhteyttä Torrent Pharma Inc. 800-912-9561: ssä tai FDA: ssa 1-800-FDA-1088: ssa tai www.fda.gov/medwatch.
lääkkeiden väärinkäyttö ja riippuvuus
setiritsiinihydrokloridin väärinkäytöstä tai riippuvuudesta ei ole tietoa.
yliannostus
Setiritsiinihydrokloridin yliannostusta on raportoitu. Yhdellä aikuispotilaalla, joka otti 150 mg Setiritsiinihydrokloridia, potilas oli unelias, mutta hänellä ei ollut muita kliinisiä oireita eikä poikkeavia veren kemia-tai hematologisia tuloksia. 18 kuukauden ikäisellä lapsipotilaalla, joka otti yliannostuksen Setiritsiinihydrokloridia (noin 180 mg), havaittiin aluksi levottomuutta ja ärtyneisyyttä.; tätä seurasi uneliaisuus. Yliannostustapauksessa hoidon tulee olla oireenmukaista tai elintoimintoja tukevaa ottaen huomioon samanaikaisesti nautitut lääkkeet. Setiritsiinihydrokloridille ei tunneta spesifistä vastalääkettä. Setiritsiinihydrokloridi ei poistu tehokkaasti dialyysissä, ja dialyysi on tehoton, ellei dialysoitavaa ainetta ole nautittu samanaikaisesti. Akuutit letaalit vähimmäisannokset suun kautta olivat hiirillä 237 mg/kg (noin 95-kertainen suurimpaan suositeltuun suun kautta annettavaan vuorokausiannokseen verrattuna aikuisilla annoksella mg/m2 tai noin 40-kertainen suurimpaan suositeltuun vuorokausiannokseen verrattuna imeväisillä annoksella mg/m2) ja rotilla 562 mg/kg (noin 460-kertainen suurimpaan suositeltuun vuorokausiannokseen verrattuna aikuisilla annoksella mg/m2 tai noin 190-kertainen suurimpaan suositeltuun vuorokausiannokseen verrattuna imeväisillä annoksella mg/m2. Jyrsijöillä akuutin toksisuuden kohde oli keskushermosto ja toistuvan altistuksen kohde maksa.
annostus & anto
Setiritsiinihydrokloridioraaliliuos, USP voidaan ottaa ruokailusta riippumatta.
2-5-vuotiaat lapset kroonisessa urtikariassa: setiritsiinihydrokloridi-oraaliliuoksen suositeltu aloitusannos 2-5-vuotiaille lapsille on 2, 5 mg (½ teelusikallista) oraaliliuosta kerran vuorokaudessa. Tässä ikäryhmässä annos voidaan nostaa maksimiannokseen 5 mg vuorokaudessa annettuna 1 teelusikallisena oraaliliuosta kerran vuorokaudessa tai yhtenä ½ teelusikallisena oraaliliuosta 12 tunnin välein.
Lapset 6 kuukautta – < 2 vuotta ympärivuotisessa allergisessa nuhassa ja kroonisessa urtikariassa: Setiritsiinihydrokloridioraaliliuoksen USP suositusannos 6 kuukauden-23 kuukauden ikäisille lapsille on 2, 5 mg (½ teelusikallista) kerran vuorokaudessa. 12-23 kuukauden ikäisten lasten vuorokausiannos voidaan nostaa enimmäisannokseen 5 mg ½ teelusikallisena (2, 5 mg) 12 tunnin välein.
miten setiritsiiniä toimitetaan
Setiritsiinihydrokloridioraaliliuos, USP 5 mg/5 mL (1 mg / mL) on väritön tai hieman kellertävä oraaliliuos, joka toimitetaan 120 mL: n pulloissa.
pullot, joissa on 120 mL NDC 13668-029-07
Setiritsiinihydrokloridioraaliliuos, USP 5 mg/5 mL (1 mg/mL) on väritön tai hieman kellertävä oraaliliuos, joka toimitetaan 480 mL: n pulloissa.
pullot, joiden tilavuus on 480 mL NDC 13668-029-11
säilytys
säilytä 20°-25°C (68°-77°F); poikkeamat sallitaan 15°-30°C (59°-86°F) .
Rx Only
valmistaja:
Bio-Pharm, Inc.
Levittown, PA 19057
valmistettu:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? Ja ennen tai jälkeen tietyn aterian?
lisää setiritsiinistä
- haittavaikutukset
- annostustiedot
- lääkkeiden yhteisvaikutukset
- tukiryhmä
- hinnoittelu & kupongit
- 225 arvostelua
- huumeluokka: antihistamines
raskauden tai imetyksen aikana
Potilasvihjeet
vertaa vaihtoehtoja
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 Lisää
hoito-oppaita
- allerginen nuha
- urtikaria
- korvatorven toimintahäiriö
- fyysinen urtikaria
lääketieteellinen Vastuuvapauslauseke
Leave a Reply