Cetirizine
Generic Name: Cetirizine hydrochloride
Dosage Form: oral solution
Medically reviewed by Drugs.com. Last updated on Feb 1, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
Cetirizine HYDROCHLORIDE ORAL SOLUTION, USP
For Oral Use
Rx Only
Cetirizine Description
Cetirizine hydrochloride is an orally active and selective H1-receptor antagonist. A kémiai név ( ± ) – – 1-piperazinil] etoxi] ecetsav, dihidroklorid. A cetirizin-hidroklorid egy racém vegyület, amelynek empirikus képlete c21h25cln2o3 * 2hcl. A molekulatömeg 461,82, a kémiai szerkezet az alábbiakban látható:
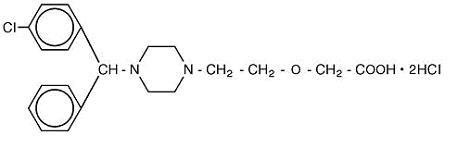
cetirizin-dihidroklorid fehér vagy csaknem fehér por, vízben szabadon oldódik, acetonban és metilén-kloridban gyakorlatilag oldhatatlan. A cetirizin-hidroklorid belsőleges oldat, az USP egy színtelen vagy enyhén sárga belsőleges oldat, amely 1 mg/mL (5 mg/5 mL) koncentrációjú cetirizin-hidrokloridot tartalmaz orális beadásra. A pH 4 és 5 között van. A belsőleges oldat inaktív összetevői: glaciális ecetsav, szőlő íz, glicerin, metilparaben, propilénglikol, propilparaben, nátrium-acetát, szacharóz és tisztított víz.
cetirizin-Klinikai farmakológia
hatásmechanizmus: a cetirizin, a hidroxizin humán metabolitja, antihisztamin; fő hatásait a perifériás H1 receptorok szelektív gátlása révén közvetítik. A cetirizin antihisztamin hatását számos állat-és humán modellben egyértelműen dokumentálták. Az in vivo és ex vivo állatmodellek elhanyagolható antikolinerg és anti-szerotonerg aktivitást mutattak. A klinikai vizsgálatokban azonban a szájszárazság gyakoribb volt a Cetirizinnel, mint a placebóval. Az In vitro receptorkötő vizsgálatok nem mutattak mérhető affinitást a H1 receptorokon kívül. Autoradiográfiás vizsgálatok radioaktív izotóppal jelzett Cetirizinnel patkányban elhanyagolható behatolást mutattak az agyba. Az egérrel végzett Ex vivo kísérletek azt mutatták, hogy a szisztematikusan beadott cetirizin nem foglalja el szignifikánsan az agyi H1 receptorokat.
farmakokinetika:
felszívódás: a cetirizin gyorsan felszívódott, a maximális koncentrációig eltelt idő (T max) körülbelül 1 óra volt a tabletta vagy belsőleges oldat felnőtteknél történő beadását követően. A tabletta és a belsőleges oldat adagolási formái között összehasonlítható biohasznosulást állapítottak meg. Egészséges önkénteseknél több adag cetirizint (10 mg tabletta naponta egyszer, 10 napon keresztül) alkalmaztak, az átlagos plazma csúcskoncentráció (C max) 311 ng / mL volt. Nem figyeltek meg akkumulációt. A cetirizin farmakokinetikája lineáris volt az 5-60 mg-os orális dózisok esetében. Az élelmiszernek nem volt hatása a cetirizin expozíció mértékére (AUC), de a T max 1,7 órával késett, a C max pedig 23% – kal csökkent élelmiszer jelenlétében.
Eloszlás: A cetirizin átlagos plazmafehérje-kötődése 93%, függetlenül a 25-1000 ng/mL koncentrációtól, amely magában foglalja a megfigyelt terápiás plazmaszinteket.
metabolizmus: egy 6 egészséges férfi önkéntesen végzett tömegmérleg-vizsgálat azt mutatta, hogy a beadott radioaktivitás 70% – a a vizeletben, 10% – a pedig a székletben található. A radioaktivitás körülbelül 50% – át a vizeletben változatlan gyógyszerként azonosították. A plazma csúcs radioaktivitás gyors növekedésének nagy része a szülő gyógyszerrel társult, ami alacsony fokú first-pass metabolizmusra utal. A cetirizin korlátozott mértékben metabolizálódik oxidatív O-dealkilációval elhanyagolható antihisztamin aktivitású metabolittá. A metabolizmusért felelős enzimet vagy enzimeket nem azonosították.
elimináció: az átlagos eliminációs felezési idő 146 egészséges önkéntesnél több farmakokinetikai vizsgálatban 8, 3 óra volt, és a cetirizin látszólagos teljes test clearance-e körülbelül 53 mL/perc volt.
interakciós vizsgálatok
A Cetirizinnel végzett farmakokinetikai interakciós vizsgálatokat felnőtteknél pszeudoefedrinnel, antipirinnel, ketokonazollal, eritromicinnel és azitromicinnel végezték.
interakciót nem figyeltek meg. A teofillinnel (400 mg naponta egyszer 3 napig) és a Cetirizinnel (20 mg naponta egyszer 3 napig) végzett többszörös dózisú vizsgálatban a cetirizin clearance-e 16% – kal csökkent. A teofillin diszpozícióját cetirizin egyidejű alkalmazása nem változtatta meg.
speciális betegcsoportok
gyermekgyógyászati betegek: Azoknál a 2-5 éves gyermekgyógyászati betegeknél, akik 5 mg cetirizint kaptak, az átlagos C max 660 ng / mL volt. A keresztvizsgálati összehasonlítások alapján a testsúly normalizált, látszólagos teljes clearance-e 81-111% – kal nagyobb volt, az eliminációs felezési idő pedig 33-41% – kal rövidebb volt a gyermekpopulációban, mint a felnőtteknél. Azoknál a 6-23 hónapos gyermekgyógyászati betegeknél, akik egyszeri 0,25 mg/ttkg cetirizin belsőleges oldatot kaptak (átlagos adag 2,3 mg), az átlagos C max 390 ng/mL volt. A keresztvizsgálati összehasonlítások alapján a testtömeg-normalizált, látszólagos teljes test clearance 304% – kal volt nagyobb, az eliminációs felezési idő pedig 63% – kal volt rövidebb ebben a gyermekpopulációban, mint a felnőtteknél. Az átlagos AUC(0-t), a gyermekek 6 hónapos, hogy a < 2 éves kor megkapta a maximális adag Cetirizin megoldás (2,5 mg naponta kétszer) várhatóan két-szer magasabb, mint a felnőttekben, kapott egy adag 10 mg Cetirizin tabletta, naponta egyszer.
A Nem hatása: a nemnek a cetirizin farmakokinetikájára gyakorolt hatását nem vizsgálták megfelelően.
a faj hatása: a cetirizin kinetikájában nem figyeltek meg faji vonatkozású különbségeket.
farmakodinámia: a cetirizin-hidroklorid 5 és 10 mg-os dózisban erősen gátolta a hisztamin intradermális injekciója által okozott wheal-és flare-t 19 (5-12 éves) gyermekkorú önkéntesnél, és az aktivitás legalább 24 órán keresztül fennmaradt. Egy 35 napos, 5-12 éves gyermekeken végzett vizsgálatban nem találtak toleranciát a cetirizin-hidroklorid antihisztamin (Wheal-és flare-válasz szuppressziója) hatásaival szemben. 10, 7-25 hónapos csecsemőnél, akik 4-9 napos cetirizint kaptak belsőleges oldatban (naponta kétszer 0,25 mg/kg), 90%-os hisztamin-indukált (10 mg/mL) bőr wheal gátlás és 87% – os flare gátlás volt 12 órával az utolsó adag beadása után. A hisztamin által kiváltott wheal-és flare-reakció ezen szuppressziójának klinikai jelentősége a bőrvizsgálatok során nem ismert.
a különböző más mediátorok vagy hisztamin releaserek intradermális injekciójának hatását a cetirizin is gátolta, csakúgy, mint a hideg okozta urticariában szenvedő betegeknél jelentkező hideg kihívásra adott válasz. Enyhén asztmás betegeknél az 5-20 mg-os cetirizin-hidroklorid blokkolta a hörgőgörcsöt a porlasztott hisztamin miatt, gyakorlatilag teljes blokáddal 20 mg-os adag után. A bőrantigén-kihívást követő 12 órán keresztül végzett vizsgálatokban az eozinofilek, neutrofilek és bazofilek, az allergiás gyulladásos válasz komponenseinek késői fázisú felvételét a cetirizin-hidroklorid 20 mg-os dózisban gátolta. Négy, egészséges felnőtt férfiaknál végzett klinikai vizsgálatban nem figyeltek meg klinikailag szignifikáns átlagos QTc-emelkedést a cetirizin-hidrokloriddal kezelt betegeknél. Az első vizsgálatban egy placebo-kontrollos keresztezett vizsgálatban a cetirizin-hidrokloridot napi 60 mg-ig, a maximális klinikai dózis 6-szorosáig, 1 hétig alkalmazták, és nem fordult elő szignifikáns átlagos QTc-megnyúlás. A második vizsgálatban egy keresztezett vizsgálatban 20 mg cetirizin-hidrokloridot és eritromicint (8 óránként 500 mg) adtak önmagában és kombinációban. A QTc-re sem önmagában, sem cetirizin-hidrokloriddal nem volt szignifikáns hatás. A harmadik vizsgálatban egy crossover vizsgálatban 20 mg cetirizin-hidrokloridot és ketokonazolt (napi 400 mg) adtak önmagában és kombinációban.
A cetirizin-hidroklorid a QTc átlagos, 9, 1 msec-os növekedését okozta a kiindulási értékhez képest 10 napos kezelés után. A ketokonazol 8, 3 msec-kal növelte a QTc-t is. A kombináció 17, 4 msec növekedést okozott, ami megegyezik az egyes hatások összegével. Így nem volt szignifikáns gyógyszerkölcsönhatás a QTc-vel a cetirizin-hidroklorid és a ketokonazol kombinációjával. A negyedik vizsgálatban egy placebo-kontrollos párhuzamos vizsgálatban 20 mg cetirizin-hidrokloridot adtak önmagában vagy azitromicinnel kombinálva (500 mg egyszeri adagban az első napon, majd 250 mg naponta egyszer). A QTc nem emelkedett szignifikánsan 20 mg cetirizin-hidrokloriddal önmagában vagy azitromicinnel kombinálva. Egy 6-11 éves gyermekgyógyászati betegekkel végzett négyhetes klinikai vizsgálatban a kezelés előtt és 2 hetes kezelés után véletlenszerűen kapott EKG-mérések eredményei azt mutatták, hogy az 5 vagy 10 mg-os cetirizin-hidroklorid nem növelte a QTc-t a placebóhoz képest. Egy egyhetes klinikai vizsgálatban (N=86) A cetirizin-hidroklorid belsőleges oldat, USP (0,25 mg/kg naponta kétszer) placebóval összehasonlítva 6-11 hónapos korú gyermekgyógyászati betegeknél az utolsó adagtól számított 3 órán belül elvégzett EKG-mérések egyik csoportban sem mutattak EKG-eltérést vagy a QTc-intervallum emelkedését a kiindulási értékelésekhez képest. Más vizsgálatokból származó adatok, amelyekben a 6-23 hónapos korú betegek cetirizin-hidrokloridot kaptak, összhangban voltak a vizsgálat eredményeivel.
a cetirizin-hidroklorid QTc-intervallumra gyakorolt hatását 10 mg-nál nagyobb dózisok esetén 12 évesnél fiatalabb gyermekeknél nem vizsgálták. Egy hathetes, placebo-kontrollos vizsgálatban, amelyben 186 (12-64 éves), allergiás rhinitisben és enyhe-középsúlyos asztmában szenvedő beteg vett részt, a napi egyszeri 10 mg cetirizin-hidroklorid javította a rhinitis tüneteit, és nem változtatta meg a tüdőfunkciót. Egy kéthetes, placebo-kontrollos klinikai vizsgálatban 65 gyermekgyógyászati (6-11 éves) allergiás rhinitis asztmás beteg alcsoport analízise kimutatta, hogy a cetirizin-hidroklorid nem változtatta meg a tüdőfunkciót. Ezek a vizsgálatok alátámasztják a cetirizin-hidroklorid alkalmazásának biztonságosságát enyhe vagy közepesen súlyos asztmában szenvedő gyermek-és felnőtt allergiás rhinitisben szenvedő betegeknél.
Klinikai Vizsgálatok: Multicentrikus, randomizált, kettős-vak klinikai vizsgálatok összehasonlítása Cetirizin 5 20 mg-os placebo-csoportban a betegek 12 évvel idősebb tartó allergiás nátha végeztek az Egyesült Államokban. Ezek közül kettő szignifikáns csökkenést mutatott az évelő allergiás rhinitis tüneteiben legfeljebb 8 hétig. Két 4-hét multicentrikus, randomizált, kettős-vak klinikai vizsgálatok összehasonlítása Cetirizin 5 20 mg-os placebo-csoportban a betegek, krónikus idiopathiás urticariában is végzett, majd mutatta, hogy jelentős javulás tünetei a krónikus idiopathiás urticariában. Általánosságban elmondható, hogy a 10 mg-os adag hatékonyabb volt, mint az 5 mg-os adag, és a 20 mg-os adag nem adott hozzáadott hatást. Ezen vizsgálatok némelyike 12-16 éves gyermekgyógyászati betegeket tartalmazott. Ezenkívül az Egyesült Államokban négy multicentrikus, randomizált, placebo-kontrollos, kettős-vak, 2-4 hetes vizsgálatot végeztek 534, szezonális allergiás rhinitisben szenvedő 6-11 éves gyermekgyógyászati betegnél, legfeljebb 10 mg dózisban.
javallatok & használat
évelő allergiás nátha: cetirizin-hidroklorid belsőleges oldat, USP javallott a tünetek enyhítésére kapcsolódó évelő allergiás rhinitis miatt allergének, mint a por atkák, állati szőr és formák gyermekeknél 6-23 hónapos korban. A hatékonyan kezelt tünetek közé tartozik a tüsszögés, orrfolyás, posztnazális kisülés, orrviszketés, szemviszketés és szakadás.
krónikus Urticaria: a cetirizin-hidroklorid belsőleges oldat, az USP a krónikus idiopátiás urticaria nem szövődményes bőrtüneteinek kezelésére javallt 6 hónapos vagy 5 éves korú gyermekeknél. Jelentősen csökkenti a csalánkiütés előfordulását, súlyosságát és időtartamát, és jelentősen csökkenti a viszketést.
ellenjavallatok
cetirizin-hidroklorid belsőleges oldat, az USP ellenjavallt azoknál a betegeknél, akiknél ismert túlérzékenység áll fenn, vagy annak bármely összetevője vagy hidroxizin.
óvintézkedések
mentális éberséget igénylő tevékenységek: klinikai vizsgálatok során egyes cetirizin-hidrokloridot szedő betegeknél aluszékonyságról számoltak be; ezért gépjárművezetéskor vagy potenciálisan veszélyes gépek üzemeltetésekor kellő óvatosság szükséges. A cetirizin-hidroklorid alkohollal vagy más központi idegrendszeri depresszánsokkal történő egyidejű alkalmazását kerülni kell, mivel az éberség további csökkenése és a központi idegrendszer teljesítményének további romlása fordulhat elő.
Gyógyszerkölcsönhatások: alacsony dózisú teofillinnel, azitromicinnel, pszeudoefedrinnel, ketokonazollal vagy eritromicinnel nem észleltek klinikailag jelentős gyógyszerkölcsönhatásokat. A cetirizin clearance-e kis mértékben csökkent a teofillin 400 mg-os dózisa miatt; lehetséges, hogy a nagyobb teofillin dózisok nagyobb hatást fejthetnek ki.
Carcinogenesis, Mutagenitási, valamint a Fertilitás károsodását: 2 év rákkeltőhatás-vizsgálat a patkányok, a Cetirizin nem rákkeltő a diétás adag legfeljebb 20 mg/kg (mintegy 15-ször, a maximális ajánlott napi orális dózis felnőtteknek mg/m 2 az alapon, vagy megközelítőleg 7-szer a maximális ajánlott napi orális dózis a csecsemők mg/m 2 alapján). Egy egereken végzett 2 éves karcinogenitási vizsgálatban a cetirizin férfiaknál a jóindulatú májdaganatok incidenciájának növekedését okozta 16 mg/kg-os étrendi dózisban (körülbelül 6-szorosa a felnőtteknél javasolt maximális napi orális adagnak mg/m 2 alapon, vagy körülbelül 3-szorosa a csecsemőknél javasolt maximális napi orális adagnak mg / m 2 alapon). A májdaganatok előfordulási gyakoriságának növekedését egerekben nem figyelték meg 4 mg/kg-os étrendi adagban (a felnőtteknél javasolt maximális napi orális adag körülbelül 2-szerese mg/m 2 alapon, vagy megközelítőleg egyenértékű a csecsemőknél javasolt maximális napi orális adaggal mg/m 2 alapon). Ezen eredmények klinikai jelentősége a cetirizin-hidroklorid hosszú távú alkalmazása során nem ismert.
a cetirizin nem volt mutagén az Ames-vizsgálatban, és nem volt klasztogén a humán lymphocyta-vizsgálatban, az egér lymphoma-vizsgálatban és in vivo mikronucleus-tesztben patkányokban.
egy egereken végzett fertilitási és általános reprodukciós teljesítményvizsgálatban a cetirizin nem károsította a fertilitást 64 mg/ttkg orális adaggal (körülbelül 25-szöröse az ajánlott maximális napi orális adagnak felnőtteknél mg/m 2 alapon).
gyermekgyógyászati alkalmazás: a cetirizin-hidroklorid biztonságosságát 6-5 éves gyermekgyógyászati betegeknél igazolták. A cetirizin biztonságosságát 168, legfeljebb 4 hetes, placebo-kontrollos vizsgálatban 2-5 éves betegen igazolták. Mg / ttkg alapon a 168 beteg közül a legtöbb 0,2-0,4 mg/ttkg cetirizin HCl-t kapott. A cetirizin biztonságosságát 399, 12-24 hónapos betegen egy placebo-kontrollos, 18 hónapos vizsgálatban igazolták, amelyben az átlagos dózis naponta kétszer
0, 25 mg/kg volt, ami 4-11 mg/nap tartománynak felel meg. A cetirizin-hidroklorid belsőleges oldat, az USP biztonságosságát 42, 6-11 hónapos betegen igazolták egy placebo-kontrollos, 7 napos vizsgálatban. Az előírt adag naponta kétszer 0,25 mg / kg volt, ami átlagosan 4,5 mg/napnak felelt meg, 3,4-6,2 mg/nap tartományban.
a cetirizin-hidroklorid hatásossága az allergiás nátha és a krónikus idiopátiás urticaria kezelésére 6-5 év közötti gyermekgyógyászati betegeknél a cetirizin-hidroklorid bizonyított hatékonyságának extrapolációján alapul az ilyen állapotú felnőtteknél, valamint annak valószínűségén, hogy a betegség lefolyása, patofiziológiája és a gyógyszer hatása e két populáció között lényegesen hasonló. A hatásosságot 6 hónapos korig extrapolálják az évelő allergiás rhinitis esetében, mivel úgy gondolják, hogy ez a betegség gyermekeknél ezeknél az életkoroknál jelentkezik. Az ajánlott adag a gyermek népesség alapján kereszt-tanulmány összehasonlítások a farmakokinetika, illetve farmakodinámiás Cetirizin a felnőtt, illetve gyermek tantárgyak, valamint a biztonsági profil Cetirizin mind a felnőtt, illetve gyermek betegek dózisban egyenlő vagy nagyobb, mint az ajánlott adag. A cetirizin AUC és C max 6-23 hónapos gyermekgyógyászati betegeknél, akik átlagosan 2-et kaptak.3 mg egyszeri adagban és 2-5 éves betegeknél, akik egyszeri 5 mg cetirizin belsőleges oldatot kaptak, a becslések szerint köztes érték volt a felnőttek között, akik egyszeri 10 mg cetirizin tablettát kaptak, és azok között, akik egyszeri 20 mg cetirizin tablettát kaptak.
a cetirizin biztonságosságát és hatásosságát 6 hónaposnál fiatalabb gyermekgyógyászati betegeknél nem igazolták.
mellékhatások
gyermekgyógyászati vizsgálatokat végeztek cetirizin-hidrokloriddal. Az Egyesült Államokban végzett kontrollos és nem kontrollált klinikai vizsgálatokban több mint 1300, 6-11 éves gyermekkorú, több mint 900, napi 1,25-10 mg cetirizin-hidrokloriddal kezelt beteg vett részt. A kezelés időtartama 2-12 hét volt. A legfeljebb 4 hétig tartó Placebo-kontrollos vizsgálatokban 168, 2-5 éves gyermekkorú, cetirizint kapó beteg vett részt, akik többsége napi egyszeri 5 mg-os adagot kapott. Egy 18 hónapos placebo-kontrollos vizsgálatban 399, 12-24 hónapos, Cetirizinnel kezelt beteg vett részt (0.25 mg/ttkg naponta kétszer) és egy másik, 7 napos placebo-kontrollos vizsgálatban 42, 6-11 hónapos, Cetirizinnel kezelt beteg vett részt (naponta kétszer 0,25 mg/ttkg).
a 2-11 éves, cetirizin-hidrokloriddal kezelt gyermekgyógyászati betegeknél jelentett mellékhatások többsége enyhe vagy közepesen súlyos volt. Placebo-kontrollos vizsgálatokban a mellékhatások miatti megszakítások incidenciája nem gyakori volt a legfeljebb 10 mg cetirizin-hidrokloridot kapó gyermekgyógyászati betegeknél (0,4% A cetirizin-hidroklorid és 1,0% a placebo mellett).
az 1. táblázat azokat a nemkívánatos tapasztalatokat sorolja fel, amelyeket az 5.és 10 mg-os cetirizin-hidrokloriddal kapcsolatban jelentettek 6-11 éves gyermekek körében az Egyesült Államokban végzett placebo-kontrollos klinikai vizsgálatokban, és gyakoribbak voltak a cetirizin-hidrokloriddal, mint a placebóval. Ezek közül a hasi fájdalmat kezelésnek tekintették, és az aluszékonyság dózisfüggő volt, 1,3% a placebónál, 1,9% az 5 mg-nál és 4,2% a 10 mg-nál. A placebo-kontrollos vizsgálatokban 2-5 éves gyermekgyógyászati betegeknél jelentett mellékhatások minőségileg hasonlóak voltak, és általában hasonlóak voltak a 6-11 éves gyermekekkel végzett vizsgálatokban jelentett gyakoriságokhoz.
a 6-24 hónapos korú gyermekgyógyászati betegekkel végzett placebo-kontrollos vizsgálatokban a mellékhatások incidenciája hasonló volt a cetirizin és a placebo kezelési csoportban minden vizsgálatban. Az aluszékonyság lényegében azonos gyakorisággal fordult elő a cetirizint kapó betegeknél és a placebót kapó betegeknél. A 6-11 hónapos korú gyermekeknél 1 hetes időtartamú vizsgálatban a cetirizint kapó betegek nagyobb ingerlékenységet/nyugtalanságot mutattak, mint a placebót kapó betegek. Egy 12 hónapos vagy idősebb betegeken végzett 18 hónapos időtartamú vizsgálatban az álmatlanság gyakrabban fordult elő cetirizint kapó betegeknél, mint a placebót kapó betegeknél (9,0% v. 5,3%). Azoknál a betegeknél, akik naponta legalább 5 mg cetirizint kaptak a placebóval kezelt betegekhez képest, gyakrabban fordult elő fáradtság (3,6% v. 1,3%) és rossz közérzet (3,6% v. 1,8%).
1. táblázat.
Adverse Experiences Reported in Pediatric Patients Aged 6 to 11 Years in Placebo-Controlled United States Cetirizine Hydrochloride Trials (5 or 10 mg Dose) Which Occurred at a Frequency of >2% in Either the 5 mg or the 10 mg Cetirizine Hydrochloride Group, and More Frequently Than in the Placebo Group
| Adverse Experiences | Placebo (N=309) |
Cetirizine Hydrochloride | |
| 5 mg (N=161) |
10mg (N=215) |
||
| Headache | 12.3% | 11.0% | 14.0% |
| Pharyngitis | 2.9% | 6.2% | 2.8% |
| Abdominal Pains | 1.9% | 4.4% | 5.6% |
| Coughing | 3.9% | 4.4% | 2.8% |
| Somnolence | 1.3% | 1.9% | 4.2% |
| Diarrhea | 1.3% | 3.1% | 1.9% |
| Epistaxis | 2.9% | 3.7% | 1.9% |
| Bronchospasmus | 1.9% | 3.1% | 1.9% |
| Hányinger | 1.9% | 1.9% | 2,8% – os |
| Hányás | 1.0% | 2.5% | 2.3% |
A következő eseményekre figyeltek meg ritkán (kevesebb, mint 2% – a), akár 3982 felnőttek, gyerekek 12 éves vagy annál idősebb vagy 659 gyermekgyógyászati betegek körében 6-11 éves, aki megkapta a Cetirizin-hidroklorid, az AMERIKAI vizsgálatok, beleértve a nyílt felnőtt tanulmány hat hónap időtartama alatt. Ezen ritka események okozati összefüggését a cetirizin-hidroklorid alkalmazásával nem igazolták.
autonóm idegrendszer: anorexia, kipirulás, fokozott nyálelválasztás, vizeletretenció.
cardiovascularis: szívelégtelenség, magas vérnyomás, palpitáció, tachycardia.
központi és perifériás idegrendszer: rendellenes koordináció, ataxia, zavartság, dysphonia, hyperesthesia, hyperkinesia, hypertonia, hypaesthesia, lábgörcsök, migrén, myelitis, bénulás, paraesthesia, ptosis, syncope, tremor, izomrángás, vertigo, látótérhiba.
: kóros májműködés, súlyosbodó fogszuvasodás, székrekedés, dyspepsia, eructatio, flatulencia, gastritis, aranyér, fokozott étvágy, melena, rektális vérzés, stomatitis, beleértve a fekélyes szájgyulladást, a nyelv elszíneződését, a nyelv ödémáját.
urogenitális: cystitis, dysuria, hematuria, vizelési gyakoriság, polyuria, vizelet inkontinencia, húgyúti fertőzés.
hallás és vesztibuláris: süketség, fülfájás, ototoxicitás, tinnitus.
metabolikus / táplálkozási: kiszáradás, diabetes mellitus, szomjúság.
: arthralgia, ízületi gyulladás, arthrosis, izomgyengeség, myalgia.
Pszichiátriai kórképek: abnormális gondolkodás, izgatottság, amnézia, szorongás, csökkent libidó, deperszonalizáció, depresszió, érzelmi labilitás, eufória, koncentrációs zavar, álmatlanság, idegesség, paroniria, alvászavar.
légzőrendszer: bronchitis, dyspnoe, hyperventiláció, fokozott köpet, tüdőgyulladás, légzési rendellenesség, rhinitis, sinusitis, felső légúti fertőzés.
reproduktív: dysmenorrhoea, női mellfájdalom, intermenstruációs vérzés, leukorrhea, menorrhagia, vaginitis.
Reticuloendothelial: lymphadenopathia.
bőr: akne, alopecia, angioödéma, hólyagos kitörés, dermatitis, száraz bőr, ekcéma, erythemás kiütés, furunculosis, hyperkeratosis, hypertrichosis, fokozott izzadás, maculopapularis kiütés, fényérzékenységi reakció, fényérzékenységi toxikus reakció, viszketés, purpura, kiütés, seborrhea, bőrbetegség, bőrcsomó, urticaria.
speciális érzékek: parosmia, ízvesztés, íz perverzió.
látás: vakság, kötőhártya-gyulladás, szemfájdalom, glaukóma, szállásvesztés, szemvérzés, xerophthalmia.
test egésze: véletlen sérülés, asthenia, hátfájás, mellkasi fájdalom, megnagyobbodott has, arcödéma, láz, generalizált ödéma, hőhullámok, megnövekedett súly, lábödéma, rossz közérzet, orrpolip, fájdalom, sápadtság, periorbitális ödéma, perifériás ödéma, szigor.
A cetirizin-kezelés során alkalmanként átmeneti, reverzibilis máj transzaminázszint-emelkedés fordult elő. A cetirizin-hidroklorid alkalmazásával összefüggésben jelentős transzamináz-emelkedéssel és emelkedett bilirubinszinttel járó hepatitisről számoltak be.
forgalomba hozatalt követő tapasztalatok
A forgalomba hozatalt követő időszakban a következő ritka, de potenciálisan súlyos nemkívánatos eseményekről számoltak be: agresszív reakció, anafilaxia, kolesztázis, görcsök, glomerulonephritis, hallucinációk, hemolitikus anémia, hepatitis, orofacialis dyskinesia, súlyos hipotenzió, halvaszületés, öngyilkossági gondolatok, öngyilkosság, thrombocytopenia és akut generalizált exanthematous pustulosis (AGEP).
a feltételezett mellékhatások bejelentéséhez vegye fel a kapcsolatot a Torrent Pharma Inc. – vel. at 800-912-9561 vagy FDA at 1-800-FDA-1088 vagy www.fda.gov/medwatch.
kábítószerrel való visszaélés és függőség
nincs olyan információ, amely arra utalna, hogy a cetirizin-hidrokloriddal visszaélés vagy függőség lép fel.
túladagolás
túladagolásról számoltak be cetirizin-hidrokloriddal. Egy felnőtt betegnél, aki 150 mg cetirizin-hidrokloridot vett be, a beteg aluszékony volt, de nem mutatott más klinikai tüneteket vagy rendellenes vérkémiai vagy hematológiai eredményeket. Egy 18 hónapos gyermekgyógyászati betegnél, aki cetirizin-hidroklorid (körülbelül 180 mg) túladagolást kapott, kezdetben nyugtalanság és ingerlékenység volt megfigyelhető; ezt követte az álmosság. Túladagolás esetén a kezelésnek tüneti vagy támogató jellegűnek kell lennie, figyelembe véve az egyidejűleg bevitt gyógyszereket. A cetirizin-hidrokloridnak Nincs ismert specifikus antidotuma. A cetirizin-hidroklorid dialízissel nem távolítható el hatékonyan, és a dialízis hatástalan lesz, kivéve, ha a dializálható hatóanyagot egyidejűleg lenyelik. Az akut minimális halálos orális dózis volt 237 mg/kg egerek (körülbelül 95 alkalommal a maximális ajánlott napi orális dózis felnőtteknek mg/m2 alapon, vagy körülbelül 40-szer a maximális ajánlott napi orális dózis a csecsemők mg/m2 alapon), valamint 562 mg/kg patkány (mintegy 460 alkalommal a maximális ajánlott napi orális dózis felnőtteknek mg/m2 alapon, vagy mintegy 190-szer a maximális ajánlott napi orális dózis a csecsemők mg/m2. Rágcsálókban az akut toxicitás célpontja a központi idegrendszer volt, a többszörös dózisú toxicitás célpontja pedig a máj volt.
adagolás & adagolás
cetirizin-hidroklorid belsőleges oldat, az USP az élelmiszer-fogyasztás figyelembevétele nélkül is bevehető.
2-5 éves gyermekek krónikus Urticaria esetén: a cetirizin-hidroklorid belsőleges oldat ajánlott kezdő adagja, az USP 2-5 éves gyermekeknél 2,5 mg (½teáskanál) belsőleges oldat naponta egyszer. A dózis ebben a korcsoportban lehet növelni, hogy a maximális adag 5 mg naponta adott 1 teáskanál belsőleges oldat naponta egyszer, vagy egy ½ teáskanál belsőleges oldat adott 12 óránként.
gyermekek 6 hónap – < 2 év évelő allergiás Rhinitis és krónikus Urticaria esetén: a cetirizin-hidroklorid belsőleges oldat ajánlott adagja, USP 6 hónapos és 23 hónapos korú gyermekeknél 2,5 mg (½ teáskanál) naponta egyszer. A 12-23 hónapos gyermekek adagja napi 5 mg-os maximális dózisra emelhető, ½ teáskanál (2,5 mg) 12 óránként.
hogyan kerül forgalomba a cetirizin
Cetirizine Hydrochloride belsőleges oldat, az USP 5 mg/5 mL (1 mg/mL) színtelen vagy enyhén sárga belsőleges oldat, 120 mL-es palackokban.
120 mL NDC 13668-029-07
cetirizin-hidroklorid belsőleges oldat, USP 5 mg/5 mL (1 mg/mL) színtelen vagy enyhén sárga belsőleges oldat, 480 mL-es palackokban.
480 mL NDC 13668-029-11
Tárolás
tárolandó 20°-25°C-on (68°-77°F); kirándulások megengedett 15°-30°C-on (59°-86°F) .
Rx Only
gyártotta:
Bio-Pharm, Inc.
Levittown, PA 19057
gyártott:
TORRENT PHARMA INC.
150 Allen Road, Suite 102
Basking Ridge, NJ 07920
PRINCIPAL DISPLAY PANEL – Bottle Label
NDC 13668-029-07
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
120 mL
Rx only

NDC 13668-029-11
Cetirizine Hydrochloride Oral Solution, USP
1 mg/mL
FOR ORAL USE ONLY
480 mL
Rx only

| Cetirizine HYDROCHLORIDE ORAL SOLUTION Cetirizine hydrochloride oral solution solution |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Torrent Pharma, Inc. (916488547)
Registrant – Torrent Pharma Inc (790033935)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Torrent Pharmaceuticals Limited | 916488547 | manufacture(13668-029), analysis(13668-029), pack(13668-029), label(13668-029) | |
Frequently asked questions
- Should cetirizine be taken at bedtime or upon awakening? És egy bizonyos étkezés előtt vagy után?
További információk a cetirizin
- Mellékhatások
- a Terhesség vagy a Szoptatás
- Adagolási Információ
- Beteg Tippek
- Kábítószer Képek
- Gyógyszerkölcsönhatások
- Hasonlítsa össze Alternatívák
- Támogató Csoport
- Árképzési & Kuponok
- 225 Vélemények
- a Kábítószer-osztály: antihistamines
Consumer resources
- Patient Information
- Cetirizine Intravenous (Advanced Reading)
Professional resources
- Prescribing Information
- Cetirizine (Systemic) (Professional Patient Advice)
- Cetirizine Oral Solution (FDA)
- Cetirizine Tablets (FDA)
- Cetirizine Tablets Chewable (FDA)
Other brands Zyrtec, Aller-Tec, Quzyttir, All Day Allergy, … + 3 további
kapcsolódó kezelési útmutató
- allergiás Rhinitis
- Urticaria
- Eustachian cső diszfunkció
- fizikai Urticaria
orvosi nyilatkozat
Leave a Reply