Duricef
Generic Name: cefadroxil Drugs.com. última atualização em 21 de abril de 2020.
- Descrição
- Efeitos Colaterais
- Dosagem
- Profissional
- Medicamentosas
- Mais
Para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia do Duricef® e outros medicamentos antibacterianos, Duricef deve ser usado somente para o tratamento ou prevenção de infecções, que são comprovadas ou fortemente suspeito de ser causada por bactérias.
Duricef Description
Duricef é um antibiótico de cefalosporina semi-sintético destinado à administração oral. É um produto pulverulento cristalino de cor branca a amarelada. É solúvel em água e estável em ácido. É designado quimicamente como ácido 5-tia-1-azabiciclooct-2-Eno-2-carboxílico, 7-amino]-3-metil-8-oxo -, mono-hidratado] -. Tem a fórmula C16H17N3O5S * H2O e o peso molecular de 381.40. Ele tem a seguinte fórmula estrutural:
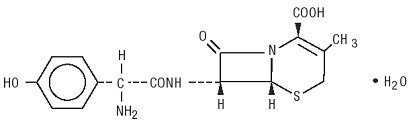
Duricef comprimidos revestidos por película, 1 g, contém os seguintes ingredientes inativos: celulose microcristalina, hidroxipropil metilcelulose, estearato de magnésio, polietileno glicol, polissorbato 80, simethicone emulsão, e dióxido de titânio.
Duricef para Suspensão Oral contém os seguintes ingredientes inactivos: FDC Amarelo n. o 6, sabores (naturais e artificiais), polissorbato 80, benzoato de sódio, sacarose e goma xantana.
Duricef cápsulas contém os seguintes ingredientes inativos: D&C Vermelho Nº 28, FD&C Azul # 1, FD&C Vermelho Nº 40, de gelatina, estearato de magnésio e dióxido de titânio.Duricef – Farmacologia Clínica Duricef Duricef é rapidamente absorvido após administração oral. Após doses únicas de 500 mg e 1000 mg, as concentrações séricas máximas médias foram aproximadamente 16 e 28 µg/mL, respectivamente. Os níveis mensuráveis estiveram presentes 12 horas após a administração. Mais de 90% do fármaco é excretado inalterado na urina em 24 horas. As concentrações máximas na urina são de aproximadamente 1800 µg/mL durante o período após uma dose oral única de 500 mg. Os aumentos na dosagem geralmente produzem um aumento proporcional na concentração urinária de Duricef (cefadroxil mono-hidratado, USP). A concentração de antibióticos na urina, após uma dose de 1 g, manteve-se bem acima da CMI de agentes patogénicos urinários susceptíveis durante 20 a 22 horas.os testes in vitro de Microbiologia
demonstraram que as cefalosporinas são bactericidas devido à sua inibição da síntese da parede celular. O Cefadroxil demonstrou ser activo contra os seguintes organismos, tanto in vitro como em infecções clínicas (ver indicações e utilização).:
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Não tem actividade contra as espécies de Pseudomonas e Acinetobacter calcoaceticus (anteriormente espécies Mima e Herellea).testes de susceptibilidade: técnicas de difusão a utilização de métodos antibióticos de teste de susceptibilidade ao disco que medem o diâmetro da Zona permite uma estimativa precisa da susceptibilidade aos antibióticos. Um desses procedimentos padrão (1) que foi recomendado para utilização com discos para testar a susceptibilidade dos organismos à cefadroxil utiliza o disco da classe cefalosporina (cefalotina). A interpretação envolve a correlação dos diâmetros obtidos no ensaio em disco com a concentração inibitória mínima (MIC) para o cefadroxil.os relatórios do laboratório que dão os resultados do teste padrão de sensibilidade de um disco único com um disco de cefalotina de 30 µg devem ser interpretados de acordo com os seguintes critérios::
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of “Susceptível” indica que é provável que o patogénico seja inibido por níveis sanguíneos geralmente alcançáveis. Um relatório de” susceptibilidade intermediária ” sugere que o organismo seria suscetível se a alta dosagem é usada ou se a infecção é confinada aos tecidos e fluidos (por exemplo, urina) em que os níveis elevados de antibióticos são atingidos. Um relatório de “resistente” indica que é improvável que concentrações alcançáveis do antibiótico sejam inibitórias e deve ser seleccionada outra terapêutica.os procedimentos normalizados requerem a utilização de organismos de controlo laboratorial. O disco de cefalotina de 30 µg deve ter os seguintes diâmetros de zona::
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution método (incluindo microdilução) 2 ou equivalente, um isolado bacteriano pode ser considerado susceptível se o valor da CIM (concentração inibitória mínima) para a cefalotina for igual ou inferior a 8 µg/mL. Os organismos são considerados resistentes se a CMI for igual ou superior a 32 µg/mL. Os organismos com um valor CMI inferior a 32 µg/mL mas superior a 8 µg/mL são intermediários.tal como acontece com os métodos de difusão padrão, os procedimentos de diluição requerem a utilização de organismos de controlo laboratoriais. O pó-padrão para cefalotina deve apresentar valores de CMI de 0, 12 µg/mL e 0, 5 µg/mL para Staphylococcus aureus ATCC 29213. Para Escherichia coli ATCC 25922, o intervalo CIM deve situar-se entre 4, 0 µg/mL e 16, 0 µg/mL. Para o Streptococcus faecalis ATCC 29212, o intervalo CIM deve situar-se entre 8, 0 e 32, 0 µg/mL.
indicações e utilização de Duricef
Duricef está indicado no tratamento de doentes com infecção causada por estirpes sensíveis dos organismos designados nas seguintes doenças:
infecções do tracto urinário causadas por E. coli, P. mirabilis e Klebsiella.infecções da pele e estrutura cutânea causadas por estafilococos e/ou estreptococos.faringite e / ou amigdalite causadas por Streptococcus pyogenes (estreptococos beta-hemolíticos do grupo a).nota: apenas a penicilina por via intramuscular demonstrou ser eficaz na profilaxia da febre reumática. O Duricef é geralmente eficaz na erradicação dos estreptococos da orofaringe. No entanto, não estão disponíveis dados que estabeleçam a eficácia de Duricef na profilaxia da febre reumática subsequente.Nota: Os testes de cultura e susceptibilidade devem ser iniciados antes e durante a terapêutica. Os estudos da função Renal devem ser realizados quando indicado.
para reduzir o desenvolvimento de bactérias resistentes aos medicamentos e manter a eficácia de Duricef e de outros medicamentos antibacterianos, Duricef deve ser utilizado apenas para tratar ou prevenir infecções comprovadas ou fortemente suspeitas de serem causadas por bactérias susceptíveis. Quando estão disponíveis informações sobre cultura e susceptibilidade, estas devem ser consideradas na selecção ou modificação da terapêutica antibacteriana. Na ausência de tais dados, os padrões locais de Epidemiologia e susceptibilidade podem contribuir para a seleção empírica da terapia.
contra-indicações
Duricef está contra-indicado em doentes com alergia conhecida ao grupo de antibióticos da cefalosporina.
advertências
antes da terapêutica com Duricef ser instituída, deve efectuar-se uma investigação cuidadosa para determinar se o doente teve anteriormente reacções de hipersensibilidade à CEFADROXIL, cefalosporinas, penicilinas ou a outros fármacos. SE ESTE MEDICAMENTO FOR ADMINISTRADO A DOENTES SENSÍVEIS À PENICILINA, DEVE TER-SE CUIDADO PORQUE A SENSIBILIDADE CRUZADA ENTRE OS ANTIBIÓTICOS BETA-LACTÂMICOS ESTÁ CLARAMENTE DOCUMENTADA E PODE OCORRER EM ATÉ 10% DOS DOENTES COM ANTECEDENTES DE ALERGIA À PENICILINA.se ocorrer uma reacção alérgica a Duricef, o medicamento deve ser interrompido. AS REACÇÕES DE HIPERSENSIBILIDADE AGUDA GRAVES PODEM REQUERER TRATAMENTO COM EPINEFRINA E OUTRAS MEDIDAS DE EMERGÊNCIA, INCLUINDO OXIGÉNIO, FLUIDOS INTRAVENOSOS, ANTI-HISTAMÍNICOS INTRAVENOSOS, CORTICOSTERÓIDES, AMINAS PRESSORAS E GESTÃO DAS VIAS AÉREAS, CONFORME INDICADO CLINICAMENTE.
Clostridium difficile associated diarréia (CDAD) foi relatado com o uso de quase todos os agentes antibacterianos, incluindo Duricef, e pode variar em gravidade desde diarréia ligeira a colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas a e B que contribuem para o desenvolvimento da CDAD. Estirpes produtoras de hipertoxina C. difficile causam morbilidade e mortalidade aumentadas, uma vez que estas infecções podem ser refractárias à terapêutica antimicrobiana e podem requerer colectomia. A CDAD deve ser considerada em todos os pacientes que apresentam diarreia após o uso de antibióticos. É necessária uma história clínica cuidadosa, uma vez que foi notificada a ocorrência de CDAD ao longo de dois meses após a administração de agentes antibacterianos.
Se a CDAD for suspeita ou confirmada, pode ser necessário interromper a utilização contínua de antibióticos não dirigidos contra C. difficile. Deve instituir-se uma gestão adequada dos fluidos e electrólitos, suplementação proteica, tratamento antibiótico de C. difficile e avaliação cirúrgica conforme indicado clinicamente.
Precauções
Geral
Duricef deve ser usada com cuidado na presença de bastante prejudicada função renal (taxa de depuração da creatinina inferior a 50 mL/min/1.73 M2). (Ver Posologia e administração).) Em doentes com compromisso renal conhecido ou suspeito, deve efectuar-se uma cuidadosa observação clínica e estudos laboratoriais apropriados antes e durante a terapêutica.não é provável que a prescrição de Duricef na ausência de infecção bacteriana comprovada ou fortemente suspeita ou de uma indicação profiláctica traga benefícios para o doente e aumente o risco de desenvolvimento de bactérias resistentes ao fármaco.o uso prolongado de Duricef pode resultar no crescimento excessivo de organismos não-concebíveis. É essencial uma observação cuidadosa do doente. Se ocorrer superinfecção durante o tratamento, devem ser tomadas medidas apropriadas.Duricef deve ser prescrito com precaução em indivíduos com história de doença gastrointestinal particularmente colite.
informação para doentes
os doentes devem ser aconselhados a que os medicamentos antibacterianos, incluindo Duricef, apenas sejam utilizados para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, a constipação comum). Quando Duricef é prescrito para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum se sentir melhor no início do curso da terapêutica, a medicação deve ser tomada exatamente como indicado. Saltar doses ou não completar o curso completo de terapia pode: (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de que as bactérias desenvolvem resistência e não irá ser tratada por Duricef ou outros medicamentos antibacterianos no futuro.
diarréia é um problema comum causado por antibióticos que geralmente termina quando o antibiótico é descontinuado. Por vezes, após o início do tratamento com antibióticos, os doentes podem desenvolver fezes aguadas e Ensanguentadas (com ou sem cãibras no estômago e febre) até dois ou mais meses após terem tomado a última dose do antibiótico. Se tal ocorrer, os doentes devem contactar o seu médico o mais rapidamente possível.durante o tratamento com os antibióticos das cefalosporinas, foram notificadas Interacções medicamentosas/laboratoriais
testes de Coombs directos positivos. Em estudos hematológicos ou em procedimentos de cruzamento de transfusões quando os testes de Antiglobulina são realizados no lado menor ou no teste de Coombs de recém-nascidos cujas mães receberam antibióticos de cefalosporina antes do parto, deve reconhecer-se que um teste de Coombs positivo pode ser devido ao medicamento.carcinogénese, mutagénese e diminuição da fertilidade não foram realizados estudos a longo prazo para determinar o potencial carcinogénico. Não foram realizados testes de toxicidade genética.gravidez: Gravidez categoria B
foram realizados estudos de reprodução em ratinhos e ratos em doses até 11 vezes superiores à dose humana e não revelaram qualquer evidência de diminuição da fertilidade ou dano para o feto devido à cefadroxil mono-hidratada. Não existem, no entanto, estudos adequados e bem controlados em mulheres grávidas. Uma vez que os estudos de reprodução em animais nem sempre prevêem a resposta humana, este medicamento só deve ser utilizado durante a gravidez se for claramente necessário.Duricef não foi estudado para uso durante o parto e o parto. O tratamento só deve ser administrado se for claramente necessário.devem tomar-se precauções quando a cefadroxil mono-hidratada é administrada a uma mãe lactante.
Utilização Pediátrica
(ver Posologia e administração).)
Utilização geriátrica
de aproximadamente 650 doentes que receberam cefadroxil para o tratamento de infecções do tracto urinário em três ensaios clínicos, 28% tinham 60 anos ou mais, enquanto 16% tinham 70 anos ou mais. De aproximadamente 1000 doentes que receberam cefadroxil para o tratamento de infecções cutâneas e da estrutura cutânea em 14 ensaios clínicos, 12% tinham 60 anos ou mais, enquanto 4% tinham 70 anos ou mais. Nestes estudos não foram observadas diferenças globais de segurança entre os doentes idosos e os doentes mais jovens. Os estudos clínicos com cefadroxil para o tratamento da faringite ou amigdalite não incluíram um número suficiente de doentes com idade igual ou superior a 65 anos para determinar se respondem de forma diferente dos doentes mais jovens. Outra experiência clínica notificada com cefadroxil não identificou diferenças nas respostas entre doentes idosos e doentes mais jovens, mas não pode ser excluída uma maior sensibilidade de alguns indivíduos mais velhos.
Cefadroxil é substancialmente excretado pelo rim, e o ajuste posológico está indicado em doentes com compromisso renal (ver Posologia e administração: compromisso Renal). Uma vez que é mais provável que os doentes idosos tenham uma função renal diminuída, deve ter-se cuidado na selecção da dose, e pode ser útil monitorizar a função renal.podem ocorrer reacções adversas
Gastrointestinal
início dos sintomas de colite pseudomembranosa durante ou após o tratamento com antibiótico (ver advertências). Dispepsia, náuseas e vómitos foram notificados raramente. Também ocorreu diarreia.foram observadas reacções alérgicas (sob a forma de erupção cutânea, urticária, angioedema e prurido). Estas reacções geralmente diminuído após a descontinuação da droga. Foi também notificada anafilaxia.outras reacções incluíram disfunção hepática incluindo colestase e aumento das transaminases séricas, prurido genital, monilíase genital, vaginite, neutropenia transitória moderada, febre. Foram notificados raramente agranulocitose, trombocitopenia, insuficiência hepática idiossincrática, eritema multiforme, Síndrome de Stevens-Johnson, doença do soro e artralgia.para além das reacções adversas acima listadas que foram observadas em doentes tratados com cefadroxil, foram notificadas as seguintes reacções adversas e testes laboratoriais alterados para antibióticos da classe das cefalosporinas::
necrólise epidérmica Tóxica, dor abdominal, superinfecção, disfunção renal, nefropatia tóxica, anemia aplástica, anemia hemolítica, hemorragia, tempo de protrombina, Coombs positivo’ teste, aumento do BUN, aumento da creatinina, elevação da fosfatase alcalina, elevação da aspartato aminotransferase (AST), elevados de alanina aminotransferase (ALT), elevação da bilirrubina, elevação da LDH, eosinofilia, pancitopenia, neutropenia.
várias cefalosporinas foram implicadas no desencadeamento de crises, particularmente em doentes com insuficiência renal, quando a dose não foi reduzida (ver dose e administração e sobredosagem). Se ocorrerem convulsões associadas à terapêutica medicamentosa, o medicamento deve ser interrompido. O tratamento anticonvulsivante pode ser administrado se clinicamente indicado.
sobredosagem
um estudo em crianças com menos de seis anos de idade sugeriu que a ingestão de menos de 250 mg/kg de cefalosporinas não está associada a resultados significativos. Não é necessária qualquer acção para além do apoio geral e da observação. Para quantidades superiores a 250 mg/kg, induzir o esvaziamento gástrico.em cinco doentes anúricos, demonstrou-se que, em média, 63% de uma dose oral de 1 g é extraída do organismo durante uma sessão de hemodiálise de 6 a 8 horas.Duricef é estável em ácido e pode ser administrado por via oral, independentemente das refeições. A administração com alimentos pode ser útil na diminuição do potencial de queixas gastrointestinais, ocasionalmente associadas à terapêutica com cefalosporina oral.
adultos
infecções do tracto urinário: Para infecções não complicadas do tracto urinário inferior (isto é, cistite), a dose habitual é de 1 ou 2 g por dia numa dose única (Q. D.) ou dividida (B. I. D.).
para todas as outras infecções do tracto urinário, a dose habitual é de 2 g por dia em doses divididas (B. I. D.).infecções da estrutura da pele e da pele: para infecções da estrutura da pele e da pele a dose habitual é de 1 g por dia em doses únicas (Q. D.) ou divididas (B. I. D.).faringite e amigdalite: tratamento da faringite estreptocócica beta-hemolítica e da amigdalite—1 g por dia em doses únicas (Q. D.) ou divididas (B. I. D.) durante 10 dias.
crianças
para infecções do tracto urinário, a dose diária recomendada para crianças é de 30 mg/kg/dia em doses divididas a cada 12 horas. Para a faringite, a amigdalite e o impetigo, a dose diária recomendada para crianças é de 30 mg/kg/dia numa dose única ou dividida em doses iguais de 12 em 12 horas. Para outras infecções da pele e estrutura cutânea, a dose diária recomendada é de 30 mg/kg/dia, dividida em doses iguais de 12 em 12 horas. No tratamento de infecções estreptocócicas beta-hemolíticas, deve ser administrada uma dose terapêutica de Duricef durante pelo menos 10 dias.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 colheres de chá |
insuficiência Renal
Em pacientes com insuficiência renal, a dosagem de cefadroxil monohidrato deve ser ajustada de acordo com a depuração da creatinina taxas para impedir a acumulação de drogas. Sugere-se o seguinte calendário. Em adultos, a dose inicial é de 1000 mg de Duricef e a dose de manutenção (com base na taxa de depuração da creatinina ) é de 500 mg nos intervalos de tempo listados abaixo.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients com taxas de depuração da creatinina superiores a 50 mL/min podem ser tratados como se fossem doentes com função renal normal.
| Tamanho da Garrafa | Reconstituição de Direções |
| 100 mL |
Suspender, em um total de 67 mL de água.método : Frasco Da Torneira ligeiramente para soltar o pó.adicionar 67 mL de água em duas porções.agitar bem após cada adição. |
| 75 mL |
Suspender, em um total de 51 mL de água.método : Frasco Da Torneira ligeiramente para soltar o pó.adicionar 51 mL de água em duas porções.agitar bem após cada adição. |
| 50 mL |
Suspensão de um total de 34 mL de água.método : Frasco Da Torneira ligeiramente para soltar o pó.adicionar 34 mL de água em duas porções.agitar bem após cada adição.após reconstituição, conservar no frigorífico. Agitar bem antes de usar.manter o recipiente bem fechado. Rejeitar a porção não utilizada após 14 dias. |
Como é Duricef Fornecido
Duricef® (cefadroxil monohidratada, USP) 500 mg Cápsulas: opaco, marrom e branco cápsulas de gelatina dura, impresso com “PPP” e “784” em uma extremidade e com “Duricef” e “500 mg” na outra extremidade.as cápsulas são fornecidas da seguinte forma:
N 0430-0780-19 Frasco de 50
conservar à temperatura ambiente controlada a 15°-30° C (59°-86° F).comprimidos
Duricef® 1 grama: brancos a esbranquiçados, de forma oval, com impressão “PPP” num dos lados do bisect e “785” no outro lado do bisect. Os comprimidos são fornecidos da seguinte forma:
N 0430-0781-19 Frasco de 50
conservar à temperatura ambiente controlada a 15°-30° C (59°-86° F).Duricef® para Suspensão Oral tem sabor a laranja-ananás e é fornecido da seguinte forma: :
250 mg/5 mL N 0430-2782-15 50 mL Frasco
N 0430-2782-17 Frasco de 100 mL
500 mg/5 mL N 0430-2783-16 75 mL Frasco
N 0430-2783-17 Frasco de 100 mL
Antes da reconstituição: conservar à temperatura ambiente controlada de 15°-30° C (59°-86° F).1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk Susceptibility Test, 4th Edition, Vol. 10 (7): M2-A4, Villanova, PA, abril de 1990.2. Comité Nacional de normas laboratoriais clínicas, norma aprovada: Methods for Diluution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, April, 1990.fabricado por Bristol-Myers Squibb Co.Princeton, NJ 08543 For Warner Chilcott Company, Inc.
Fajardo, PR 00738
Comercializado por Warner Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: primeira geração cefalosporinas
recursos para o Consumidor
- Avançado de Leitura
recursos
- Informação de Prescrição
- Cefadroxil Suspensão Oral (FDA)
Relacionados guias de tratamento
- Endocardite Bacteriana Prevenção
- a Pele e a Estrutura Infecção
- Impetigo
- Infecções Renais
- … + 4 Mais
Declaração de exoneração de responsabilidade médica
Leave a Reply