Duricef
generisk navn: Duricef
doseringsform: pulver,til suspension
medicinsk gennemgået af Drugs.com. sidst opdateret den 21. April 2020.
- oversigt
- bivirkninger
- dosering
- professionel
- interaktioner
- mere
for at reducere udviklingen af lægemiddelresistente bakterier og opretholde effektiviteten af Duricef kur og andre antibakterielle lægemidler, bør Duricef kun anvendes til behandling eller forebyggelse af infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af bakterier.
Duricef beskrivelse
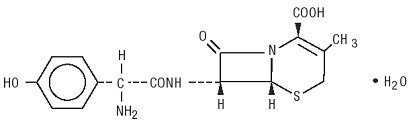
Duricef er et semisyntetisk cephalosporin antibiotikum beregnet til oral administration. Det er et hvidt til gulligt hvidt krystallinsk pulver. Det er opløseligt i vand, og det er syrestabilt. Det er kemisk betegnet som 5-Thia-1-acabicyclooct-2-en-2-carboksilsyre, 7-amino]-3-methyl-8-okso -, monohydrat] -. Det har formlen C16H17N3O5S * H2O og molekylvægten på 381,40. Det har følgende strukturformel:
Duricef filmovertrukne tabletter, 1 g, indeholder følgende inaktive ingredienser: mikrokrystallinsk cellulose, hydroksipropylmethylcellulose, magnesiumstearat, polyethylenglycol, polysorbat 80, simethiconemulsion og titaniumdioksid.
Duricef til oral Suspension indeholder følgende inaktive ingredienser: FD&C gul No. 6, smagsstoffer (naturlige og kunstige), polysorbat 80, natriumbensoat, saccharose og ksanthan gummi.
Duricef kapsler indeholder følgende inaktive ingredienser: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, gelatine, magnesiumstearat og titaniumdiokse.
Duricef – Klinisk Farmakologi
Duricef absorberes hurtigt efter oral administration. Efter enkeltdoser på 500 mg og 1000 mg var de gennemsnitlige maksimale serumkoncentrationer henholdsvis ca.16 og 28 liter/mL. Målbare niveauer var til stede 12 timer efter administration. Over 90% af lægemidlet udskilles uændret i urinen inden for 24 timer. De maksimale urinkoncentrationer er ca.1800 liter/mL i perioden efter en enkelt oral dosis på 500 mg. Dosisforøgelser giver generelt en forholdsmæssig stigning i urinkoncentrationen i Duricef (USP). Urinantibiotikumkoncentrationen efter en dosis på 1 g blev opretholdt et godt stykke over MIC af modtagelige urinpatogener i 20 til 22 timer.
Mikrobiologi
In vitro-test viser, at cephalosporinerne er bakteriedræbende på grund af deres inhibering af cellevægssyntese. Cefadroksil har vist sig at være aktiv mod følgende organismer både in vitro og i kliniske infektioner (se indikationer og anvendelse):
Beta-hemolytic streptococci
Staphylococci, including penicillinase-producing strains
Streptococcus (Diplococcus) pneumoniae
Escherichia coli
Proteus mirabilis
Klebsiella species
Moraxella (Branhamella) catarrhalis
Note: Most strains of Enterococcus faecalis (formerly Streptococcus faecalis) and Enterococcus faecium (formerly Streptococcus faecium) are resistant to Duricef. It is not active against most strains of Enterobacter species, Morganella morganii (formerly Proteus morganii), and P. vulgaris. Det har ingen aktivitet mod Pseudomonas arter og Acinetobacter calcoaceticus (tidligere Mima og herellea arter).
følsomhedstest: Diffusionsteknikker
anvendelse af antibiotiske diskfølsomhedstestmetoder, der måler områdediameter, giver en nøjagtig estimering af antibiotikasensitivitet. En sådan standardprocedure1, som er blevet anbefalet til brug sammen med diske til at teste organismernes følsomhed over for cefadroksil, bruger cephalosporinklassen (cephalothin) disken. Fortolkning involverer korrelationen af diametrene opnået i disktesten med den minimale inhiberende koncentration (MIC) for cefadroksil.
rapporter fra laboratoriet, der giver resultater af standard-enkeltdisk-følsomhedstest med en 30-liters cephalothindisk, skal fortolkes i henhold til følgende kriterier:
| Zone diameter (mm) | Interpretation |
| ≥ 18 | (S) Susceptible |
| 15–17 | (I) Intermediate |
| ≤ 14 | (R) Resistant |
A report of “Modtagelig” indikerer, at patogenet sandsynligvis vil blive hæmmet af generelt opnåelige blodniveauer. En rapport om” mellemliggende modtagelighed ” antyder, at organismen ville være modtagelig, hvis der anvendes høj dosis, eller hvis infektionen er begrænset til væv og væsker (f.eks. En rapport om” resistent ” indikerer, at opnåelige koncentrationer af antibiotika sandsynligvis ikke er hæmmende, og anden behandling bør vælges.
standardiserede procedurer kræver anvendelse af laboratoriekontrolorganismer. 30-cephalothin-disken skal give følgende områdediametre:
| Organism | Zone Diameter (mm) |
| Staphylococcus aureus ATCC 25923 | 29–37 |
| Escherichia coli ATCC 25922 | 17–22 |
Dilution Techniques
When using the NCCLS agar dilution or broth dilution (inklusive mikrofortynding) metode2 eller tilsvarende kan et bakterieisolat betragtes som modtageligt, hvis MIC-værdien (minimum inhiberende koncentration) for cephalothin er 8 liter/mL eller derunder. Organismer betragtes som resistente, hvis MIC er 32 Liter/mL eller derover. Organismer med en MIC-værdi på mindre end 32 Liter/mL, men større end 8 liter/mL, er mellemliggende.
som med standarddiffusionsmetoder kræver fortyndingsprocedurer anvendelse af laboratoriekontrolorganismer. Standard cephalothinpulver skal give MIC-værdier i området 0,12 liter / mL og 0,5 liter/mL for Staphylococcus aureus ATCC 29213. For Escherichia coli ATCC 25922 bør MIC-området være mellem 4,0 liter/mL og 16,0 liter/mL. For Streptococcus faecalis ATCC 29212 bør MIC-området være mellem 8,0 og 32,0 liter/mL.
indikationer og anvendelse for Duricef
Duricef er indiceret til behandling af patienter med infektion forårsaget af modtagelige stammer af de udpegede organismer i følgende sygdomme:
urinvejsinfektioner forårsaget af E. coli, P. mirabilis og Klebsiella arter.
hud-og hudstrukturinfektioner forårsaget af stafylokokker og/eller streptokokker.Pharyngitis og/eller tonsillitis forårsaget af Streptococcus pyogenes (gruppe A beta-hæmolytiske streptokokker).
Bemærk: kun penicillin ved den intramuskulære indgivelsesvej har vist sig at være effektiv til profylakse af gigtfeber. Duricef er generelt effektiv til udryddelse af streptokokker fra oropharynks. Data, der fastslår duricefs virkning til profylakse af efterfølgende gigtfeber, er imidlertid ikke tilgængelige.
Bemærk: Kultur-og følsomhedstest bør initieres før og under behandlingen. Nyrefunktionsundersøgelser skal udføres, når det er indiceret.
for at reducere udviklingen af lægemiddelresistente bakterier og opretholde effektiviteten af Duricef og andre antibakterielle lægemidler, bør Duricef kun anvendes til behandling eller forebyggelse af infektioner, der er bevist eller stærkt mistænkt for at være forårsaget af modtagelige bakterier. Når oplysninger om kultur og følsomhed er tilgængelige, bør de overvejes ved valg eller ændring af antibakteriel terapi. I mangel af sådanne data kan lokal epidemiologi og følsomhedsmønstre bidrage til den empiriske udvælgelse af terapi.
kontraindikationer
Duricef er kontraindiceret hos patienter med kendt allergi over for cephalosporingruppen af antibiotika.
advarsler
før behandling med Duricef indledes, skal der foretages en omhyggelig undersøgelse for at afgøre, om patienten tidligere har haft overfølsomhedsreaktioner over for CEFADROKSIL, cephalosporiner, penicilliner eller andre lægemidler. HVIS DETTE PRODUKT SKAL GIVES TIL PENICILLINFØLSOMME PATIENTER, SKAL DER UDVISES FORSIGTIGHED, FORDI KRYDSFØLSOMHED BLANDT BETA-LACTAM-ANTIBIOTIKA ER KLART DOKUMENTERET OG KAN FOREKOMME HOS OP TIL 10% AF PATIENTERNE MED EN HISTORIE MED PENICILLINALLERGI.
Hvis der opstår en allergisk reaktion på Duricef, afbryd lægemidlet. ALVORLIGE AKUTTE OVERFØLSOMHEDSREAKTIONER KAN KRÆVE BEHANDLING MED EPINEPHRIN OG ANDRE NØDFORANSTALTNINGER, HERUNDER ILT, INTRAVENØSE VÆSKER, INTRAVENØSE ANTIHISTAMINER, KORTIKOSTEROIDER, PRESSORAMINER OG LUFTVEJSSTYRING, SOM KLINISK INDICERET.Clostridium difficile associeret diarre (CDAD) er blevet rapporteret ved brug af næsten alle antibakterielle midler, herunder Duricef, og kan variere i sværhedsgrad fra mild diarre til dødelig colitis. Behandling med antibakterielle midler ændrer den normale flora i tyktarmen, hvilket fører til overvækst af C. difficile.C. difficile producerer toksiner A og B, som bidrager til udviklingen af CDAD. Hypertoksinproducerende stammer af C. difficile forårsager øget sygelighed og dødelighed, da disse infektioner kan være ildfaste over for antimikrobiel terapi og kan kræve kolektomi. CDAD skal overvejes hos alle patienter, der har diarre efter brug af antibiotika. Omhyggelig medicinsk historie er nødvendig, da CDAD er rapporteret at forekomme over to måneder efter administration af antibakterielle midler.
Hvis CDAD er mistænkt eller bekræftet, kan det være nødvendigt at afbryde den igangværende antibiotikabehandling, der ikke er rettet mod C. difficile. Passende væske-og elektrolytstyring, proteintilskud, antibiotikabehandling af C. difficile og kirurgisk evaluering bør indledes som klinisk indiceret.
forholdsregler
generelt
Duricef skal anvendes med forsigtighed i nærvær af markant nedsat nyrefunktion (kreatininclearance på mindre end 50 mL/min / 1, 73 M2). (Se dosering og ADMINISTRATION.) Hos patienter med kendt eller mistanke om nedsat nyrefunktion skal der foretages omhyggelig klinisk observation og passende laboratorieundersøgelser før og under behandlingen.
ordination af Duricef i fravær af en påvist eller stærkt mistænkt bakteriel infektion eller en profylaktisk indikation vil sandsynligvis ikke give patienten gavn og øger risikoen for udvikling af lægemiddelresistente bakterier.
langvarig brug af Duricef kan resultere i overvækst af nonsusceptible organismer. Omhyggelig observation af patienten er vigtig. Hvis der opstår superinfektion under behandlingen, skal der træffes passende foranstaltninger.
Duricef bør ordineres med forsigtighed hos personer med tidligere gastrointestinal sygdom, især colitis.
Information til patienter
patienter bør rådes om, at antibakterielle lægemidler inklusive Duricef kun bør anvendes til behandling af bakterielle infektioner. De behandler ikke virusinfektioner (f.eks. Når Duricef ordineres til behandling af en bakteriel infektion, skal patienterne få at vide, at selv om det er almindeligt at føle sig bedre tidligt i løbet af behandlingen, skal medicinen tages nøjagtigt som anvist. Spring over doser eller ikke fuldfører det fulde behandlingsforløb kan (1) mindske effektiviteten af den øjeblikkelige behandling og (2) øge sandsynligheden for, at bakterier udvikler resistens og ikke kan behandles af Duricef eller andre antibakterielle lægemidler i fremtiden.
diarre er et almindeligt problem forårsaget af antibiotika, som normalt slutter, når antibiotikumet afbrydes. Nogle gange efter start af behandling med antibiotika kan patienter udvikle vandig og blodig afføring (med eller uden mavekramper og feber), selv så sent som to eller flere måneder efter at have taget den sidste dosis af antibiotika. Hvis dette sker, skal patienter kontakte Deres læge så hurtigt som muligt.
lægemiddel – /Laboratorietestinteraktioner
Positive direkte Coombs’ test er rapporteret under behandling med cephalosporinantibiotika. I hæmatologiske undersøgelser eller i transfusionskrydsmatchningsprocedurer, når antiglobulintest udføres på den mindre side eller i Coombs’ test af nyfødte, hvis mødre har modtaget cephalosporinantibiotika før fødslen, skal det erkendes, at en positiv Coombs’ test kan skyldes lægemidlet.
carcinogenese, mutagenese og nedsat fertilitet
der er ikke udført langtidsstudier for at bestemme karcinogent potentiale. Der er ikke udført genetiske toksicitetstest.
graviditet: Graviditetskategori B
reproduktionsstudier er udført på mus og rotter i doser op til 11 gange den humane dosis og har ikke vist tegn på nedsat fertilitet eller skade på fosteret på grund af cefadroksilmonohydrat. Der er dog ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Da dyreproduktionsundersøgelser ikke altid er forudsigelige for menneskelig respons, bør dette lægemiddel kun bruges under graviditet, hvis det er klart nødvendigt.
arbejdskraft og levering
Duricef er ikke undersøgt til brug under fødsel og fødsel. Behandling bør kun gives, hvis det er klart nødvendigt.
ammende mødre
der skal udvises forsigtighed, når cefadroksilmonohydrat administreres til en ammende mor.
pædiatrisk anvendelse
(se dosering og ADMINISTRATION.)
geriatrisk anvendelse
af cirka 650 patienter, der fik cefadroksil til behandling af urinvejsinfektioner i tre kliniske forsøg, var 28% 60 år og ældre, mens 16% var 70 år og ældre. 1000 patienter, der fik cefadroksil til behandling af hud-og hudstrukturinfektion i 14 kliniske forsøg, var 12% 60 år og ældre, mens 4% var 70 år og derover. Der blev ikke observeret nogen overordnede forskelle i sikkerhed mellem de ældre patienter i disse undersøgelser og yngre patienter. Kliniske studier af cefadroksil til behandling af pharyngitis eller tonsillitis omfattede ikke tilstrækkeligt antal patienter 65 år og ældre til at afgøre, om de reagerer forskelligt fra yngre patienter. Andre rapporterede kliniske erfaringer med cefadroksil har ikke identificeret forskelle i respons mellem ældre og yngre patienter, men større følsomhed hos nogle ældre individer kan ikke udelukkes.dosisjustering er indiceret til patienter med nedsat nyrefunktion (se dosering og ADMINISTRATION: nedsat nyrefunktion). Da ældre patienter er mere tilbøjelige til at have nedsat nyrefunktion, skal der udvises forsigtighed ved valg af dosis, og det kan være nyttigt at overvåge nyrefunktionen.
bivirkninger
Gastrointestinal
indtræden af pseudomembranøs colitis symptomer kan forekomme under eller efter antibiotikabehandling (se advarsler). Dyspepsi, kvalme og opkastning er rapporteret i sjældne tilfælde. Der er også opstået diarre.
overfølsomhed
allergier (i form af udslæt, urticaria, angioødem og kløe) er blevet observeret. Disse reaktioner aftog normalt ved seponering af lægemidlet. Anafylaksi er også rapporteret.
andre
andre reaktioner har inkluderet leverdysfunktion, herunder kolestase og stigninger i serumtransaminase, genital pruritus, genital moniliasis, vaginitis, moderat forbigående neutropeni, feber. Agranulocytose, trombocytopeni, idiosynkratisk leversvigt, erythema multiforme, Stevens-Johnsons syndrom, serumsygdom og artralgi er sjældent rapporteret.
ud over de ovennævnte bivirkninger, som er observeret hos patienter behandlet med cephalosporin, er følgende bivirkninger og ændrede laboratorietest rapporteret for cephalosporin-klasse antibiotika:
toksisk epidermal nekrolyse, mavesmerter, superinfektion, nyresvigt, toksisk nefropati, aplastisk anæmi, hæmolytisk anæmi, blødning, forlænget protrombintid, positiv Coombs-test, øget BUN, øget kreatinin, forhøjet alkalisk phosphatase, forhøjet aspartataminotransferase (AST), forhøjet alaninaminotransferase (ALT), forhøjet bilirubin, forhøjet LDH, eosinofili, pancytopeni, neutropeni.
flere cephalosporiner er blevet impliceret i udløsningen af anfald, især hos patienter med nedsat nyrefunktion, når doseringen ikke blev reduceret (se dosering og ADMINISTRATION og overdosering). Hvis anfald i forbindelse med lægemiddelterapi forekommer, skal lægemidlet seponeres. Antikonvulsiv behandling kan gives, hvis det er klinisk indiceret.
overdosering
en undersøgelse af børn under seks år antydede, at indtagelse af mindre end 250 mg / kg cephalosporiner ikke er forbundet med signifikante resultater. Der kræves ingen anden handling end generel støtte og observation. For mængder større end 250 mg/kg induceres gastrisk tømning.
hos fem anuriske patienter blev det påvist, at et gennemsnit på 63% af en oral dosis på 1 g ekstraheres fra kroppen under en 6-8 timers hæmodialysesession.
Duricef Dosering og Administration
Duricef er syrestabil og kan indgives oralt uden hensyntagen til måltider. Administration sammen med mad kan være nyttigt til at mindske potentielle gastrointestinale klager, der lejlighedsvis er forbundet med oral cephalosporinbehandling.
voksne
urinvejsinfektioner: Ved ukomplicerede nedre urinvejsinfektioner (dvs. blærebetændelse) er den sædvanlige dosis 1 eller 2 g pr.
for alle andre urinvejsinfektioner er den sædvanlige dosis 2 g pr.
hud-og Hudstrukturinfektioner: ved infektioner i hud og hudstruktur er den sædvanlige dosis 1 g pr.dag i enkeltdoser eller opdelte doser (b. I.d.).
Pharyngitis og Tonsillitis: behandling af gruppe A beta-hæmolytisk streptokokfaryngitis og tonsillitis—1 g pr.dag i enkelt (K. D.) eller opdelte doser (b.I. d.) i 10 dage.
børn
Ved urinvejsinfektioner er den anbefalede daglige dosis til børn 30 mg/kg/dag i opdelte doser hver 12.time. For faryngitis, tonsillitis og impetigo er den anbefalede daglige dosis til børn 30 mg/kg/dag i en enkelt dosis eller i lige opdelte doser hver 12.time. Ved andre hud-og hudstrukturinfektioner er den anbefalede daglige dosis 30 mg/kg/dag i lige opdelte doser hver 12.time. Ved behandling af beta-hæmolytiske streptokokinfektioner bør en terapeutisk dosis af Duricef administreres i mindst 10 dage.
See chart for total daily dosage for children.
| CHILD’S WEIGHT | |||
| lbs kg | 250 mg/5 mL | 500 mg/5 mL | |
| 10 | 4.5 | ½ tsp | |
| 20 | 9.1 | 1 tsp | |
| 30 | 13.6 | 1½ tsp | |
| 40 | 18.2 | 2 tsp | 1 tsp |
| 50 | 22.7 | 2½ tsp | 1¼ tsp |
| 60 | 27.3 | 3 tsp | 1½ tsp |
|
70 & above |
31.8+ | — | 2 tsk |
Renal værdiforringelse
hos patienter med nedsat nyrefunktion bør dosis af cefadroksilmonohydrat justeres i henhold til kreatininclearance for at forhindre lægemiddelakkumulering. Følgende tidsplan foreslås. Hos voksne er initialdosis 1000 mg Duricef, og vedligeholdelsesdosis (baseret på kreatininclearance ) er 500 mg med de nedenfor anførte tidsintervaller.
| Creatinine Clearances | Dosage Interval |
| 010 mL/min | 36 hours |
| 1025 mL/min | 24 hours |
| 2550 mL/min | 12 hours |
Patients med kreatininclearance over 50 mL / min kan behandles som om de var patienter med normal nyrefunktion.
| flaskestørrelse | rekonstitution kørselsvejledning |
| 100 ml |
suspendere i alt 67 ml vand. metode: Tryk let på flasken for at løsne pulveret. tilsæt 67 mL vand i to portioner. Ryst godt efter hver tilsætning. |
| 75 mL |
suspendere i alt 51 mL vand. metode: Tryk let på flasken for at løsne pulveret. tilsæt 51 mL vand i to portioner. Ryst godt efter hver tilsætning. |
| 50 mL |
suspendere i alt 34 mL vand. metode: Tryk let på flasken for at løsne pulveret. tilsæt 34 mL vand i to portioner. Ryst godt efter hver tilsætning. |
|
efter rekonstitution opbevares i køleskab. Ryst godt inden brug. Hold beholderen tæt lukket. Bortskaf ubrugt portion efter 14 dage. |
|
hvordan leveres Duricef
Duricef 500 mg kapsler: uigennemsigtige, rødbrune og hvide hårde gelatinekapsler, præget med “PPP” og “784” på den ene ende og med “Duricef” og “500 mg” i den anden ende.
kapsler leveres som følger:
N 0430-0780-19 flaske med 50
opbevares ved kontrolleret stuetemperatur 15 liter -30 liter C (59 liter -86 liter f).
Duricef kurst 1 gram tabletter: hvide til råhvide, tophalverede, ovale, præget med “PPP” på den ene side af bisect og “785” på den anden side af bisect. Tabletter leveres som følger:
N 0430-0781-19 flaske med 50
opbevares ved kontrolleret stuetemperatur 15 liter -30 liter C (59 liter -86 liter f).
Duricef Kurt til oral Suspension er orange-ananas aromatiseret og leveres som følger:
250 mg/5 mL N 0430-2782-15 50 mL flaske
N 0430-2782-17 100 mL flaske
500 mg/5 mL N 0430-2783-16 75 mL flaske
N 0430-2783-17 100 mL flaske
før rekonstitution: opbevares på kontrolleret stuetemperatur 15 liter -30 liter C (59 liter -86 liter f).
1. Nationalt udvalg for kliniske laboratoriestandarder, godkendt Standard, præstationsstandarder for antimikrobiel Diskfølsomhedstest, 4.udgave, Vol. 10 (7): M2-A4, Villanova, PA, April, 1990.
2. Nationalt udvalg for kliniske laboratoriestandarder, godkendt Standard: Metoder til fortynding af antimikrobielle følsomhedstest for bakterier, der vokser aerobt, 2.udgave, Vol. 10 (8): M7-A2, Villanova, PA, April, 1990.
fremstillet af Bristol-Myers.
Princeton, NJ 08543
for Chilcott Company, Inc.
Fajardo, PR 00738
markedsført af Chilcott, Inc.
Rockaway, NJ 07866
2782G073
Revised April 2007
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil powder, for suspension |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
| Duricef cefadroxil tablet |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Duricef cefadroxil capsule |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Labeler – Warner Chilcott, Inc.
Frequently asked questions
- What is the best antibiotic to treat strep throat?
More about Duricef (cefadroxil)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Drug Images
- Drug Interactions
- Drug class: første generation cephalosporiner
Forbrugerressourcer
- avanceret læsning
professionelle ressourcer
- ordineringsinformation
-
- bakteriel Endocarditis forebyggelse
- hud-og Strukturinfektion
- impetigo
- nyreinfektioner
- … + 4 mere
relaterede behandlingsvejledninger
li>
medicinsk ansvarsfraskrivelse
Leave a Reply